
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
本文中专家成员单位信息有误更正,见文后。
肺癌是全球最常见的恶性肿瘤,也是恶性肿瘤死亡的首要原因[1]。在中国,肺癌是发病率及死亡率最高的恶性肿瘤;2015年新发病例73.3万,死亡病例61.0万[2]。
在组织学分类上,肺癌分为小细胞肺癌和非小细胞肺癌(NSCLC)。大多数NSCLC患者在确诊时已属晚期。随着精准医学的发展,NSCLC患者治疗策略愈加细化,根据国内外有关指南[3,4,5,6,7],可以将NSCLC患者细分为驱动基因突变型、野生型及程序性死亡受体-配体1(PD-L1)高表达者。根据患者体质、驱动基因突变状态以及PD-L1表达水平,一、二线治疗可选择靶向治疗、含铂两药化疗或免疫治疗等方案。然而,针对三线治疗的临床研究结果较少,目前仍无标准的治疗方案。值得一提的是,抗肿瘤血管生成药物如贝伐珠单抗[8]和重组人血管内皮抑素[9]已成为NSCLC治疗的重要选择之一。
盐酸安罗替尼(AL3818)是我国自主研发的1.1类新药,是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制血管内皮细胞生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维生长因子受体、干细胞生长因子受体等激酶的活性,进而发挥抗肿瘤血管生成和抑制肿瘤生长的作用[10,11]。该药在晚期NSCLC的三线及以上治疗中显示出了良好的安全性,2018年5月9日国家食品药品监督管理总局(CFDA)批准其上市[12]。为更好地指导临床上合理、有效地使用盐酸安罗替尼,中国医师协会肿瘤医师分会、中国临床肿瘤学会血管靶向治疗专家委员会和中国抗癌协会肿瘤靶向治疗专业委员会共同组织专家制定了本共识,以供同道借鉴参考。本共识将随盐酸安罗替尼新研究成果的不断问世适时更新。
Ⅰ期临床研究结果表明,盐酸安罗替尼血药浓度呈剂量非依赖型,蓄积指数为12±7,消除半衰期为(96±17)h,且连续给药会导致其在体内蓄积[13]。研究发现,采用连续给药方式,当剂量达到10 mg 1次/d时,3例受试者中有2例出现剂量限制毒性。因此,后续研究采用连续用药2周停药1周的方式进行探索,最终确定盐酸安罗替尼的给药方式为12 mg 1次/d,早餐前口服,连续用药2周停药1周,用药期间如出现漏服,确认距下次用药时间<12 h时,不再补服[13]。
盐酸安罗替尼单药适用于既往至少接受过2种系统化疗后复发或进展的局部晚期或转移性NSCLC患者。对于存在表皮生长因子受体(EGFR)基因敏感突变或间变性淋巴瘤激酶(ALK)融合基因阳性的患者,在开始盐酸安罗替尼治疗前应接受过相应的标准靶向药物治疗后进展或不可耐受、且至少接受过2种系统化疗后复发或进展[14]。
安慰剂对照的随机双盲多中心的Ⅱ期临床研究(ALTER0302)和Ⅲ期临床研究(ALTER0303)结果均显示,与安慰剂组相比,盐酸安罗替尼单药应用于晚期NSCLC患者的三线及以上治疗时,患者临床获益显著(表1)[15,16]。根据ALTER0303研究结果,与安慰剂组相比,盐酸安罗替尼组患者无进展生存期(PFS)延长4.0个月(HR=0.25,P<0.000 1),总生存期(OS)延长3.3个月(HR=0.68,P=0.001 8)[16]。
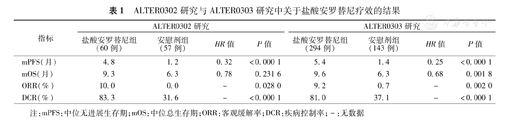
ALTER0302研究与ALTER0303研究中关于盐酸安罗替尼疗效的结果
ALTER0302研究与ALTER0303研究中关于盐酸安罗替尼疗效的结果
| 指标 | ALTER0302研究 | ALTER0303研究 | ||||||
|---|---|---|---|---|---|---|---|---|
| 盐酸安罗替尼组(60例) | 安慰剂组(57例) | HR值 | P值 | 盐酸安罗替尼组(294例) | 安慰剂组(143例) | HR值 | P值 | |
| mPFS(月) | 4.8 | 1.2 | 0.32 | <0.000 1 | 5.4 | 1.4 | 0.25 | <0.000 1 |
| mOS(月) | 9.3 | 6.3 | 0.78 | 0.231 6 | 9.6 | 6.3 | 0.68 | 0.001 8 |
| ORR(%) | 10.0 | 0.0 | - | 0.028 0 | 9.2 | 0.7 | - | 0.002 0 |
| DCR(%) | 83.3 | 31.6 | - | <0.000 1 | 81.0 | 37.1 | - | <0.000 1 |
注:mPFS:中位无进展生存期;mOS:中位总生存期;ORR:客观缓解率;DCR:疾病控制率;-:无数据
ALTER0303研究的亚组分析结果显示,对于既往接受过2种系统性化疗的EGFR基因野生型患者或靶向药物治疗失败并接受过后续2种系统性化疗后进展或复发的EGFR基因敏感突变阳性患者,盐酸安罗替尼均能带来PFS与OS的双重获益(表2)[17]。
ALTER0303研究中病理类型亚组分析结果显示,肺腺癌和肺鳞癌患者均可从盐酸安罗替尼治疗中获益。在肺腺癌患者中,盐酸安罗替尼组与安慰剂组相比PFS与OS均显著获益;在肺鳞癌患者中,盐酸安罗替尼组PFS显著延长,OS有延长趋势但无统计学意义(表3)[18]。
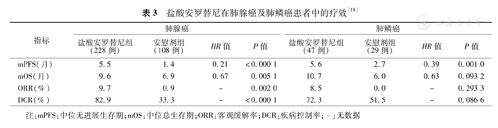
盐酸安罗替尼在肺腺癌及肺鳞癌患者中的疗效[18]
盐酸安罗替尼在肺腺癌及肺鳞癌患者中的疗效[18]
| 指标 | 肺腺癌 | 肺鳞癌 | ||||||
|---|---|---|---|---|---|---|---|---|
| 盐酸安罗替尼组(228例) | 安慰剂组(108例) | HR值 | P值 | 盐酸安罗替尼组(47例) | 安慰剂组(29例) | HR值 | P值 | |
| mPFS(月) | 5.5 | 1.4 | 0.21 | <0.000 1 | 5.6 | 2.7 | 0.39 | 0.001 0 |
| mOS(月) | 9.6 | 6.9 | 0.67 | 0.005 1 | 10.7 | 6.0 | 0.63 | 0.093 2 |
| ORR(%) | 9.7 | 0.9 | - | 0.002 0 | 8.5 | 0.0 | - | 0.293 3 |
| DCR(%) | 82.9 | 33.3 | - | <0.000 1 | 72.3 | 51.5 | - | 0.086 6 |
注:mPFS:中位无进展生存期;mOS:中位总生存期;ORR:客观缓解率;DCR:疾病控制率;-:无数据
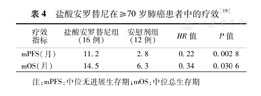
ALTER0303研究中共纳入≥70岁的患者28例,疗效分析结果显示盐酸安罗替尼治疗相比安慰剂能够显著提高老年患者的PFS与OS(表4)[19];安全性分析结果显示盐酸安罗替尼组的老年患者主要出现的不良事件为高血压[81.25%,其中3级发生率为12.50%(2/16),无≥4级者]、手足皮肤反应[75.00%,其中3级发生率为12.50%(2/16)]和血促甲状腺激素(TSH)升高[68.75%,其中3级发生率为6.25%(1/16)无≥4级者]。ALTER0303研究中≥70岁的患者未进行过盐酸安罗替尼用药的剂量调整[18],总体耐受性良好,提示盐酸安罗替尼是老年患者多线治疗失败后的可选药物。
中央型肺鳞癌或具有大咯血风险的患者、重度肝肾功能不全患者、妊娠期以及哺乳期妇女禁用盐酸安罗替尼。
建议避免与CYP1A2和CYP3A4的抑制剂及诱导剂合用:盐酸安罗替尼主要由CYP1A2和CYP3A4/5代谢,CYP3A4/5诱导剂(利福平、利福布丁、利福喷丁、地塞米松、苯妥英、卡马西平或苯巴比妥等)和CYP1A2诱导剂(孟鲁司特、奥美拉唑、莫雷西嗪等)等均可能加速盐酸安罗替尼的代谢,降低其血浆浓度;CYP3A4/5强抑制剂(酮康唑、伊曲康唑、克拉霉素、伏立康唑、泰利霉素、沙奎那韦、利托拉韦等)和CYP1A2强抑制剂(环丙沙星、依诺沙星和氟伏沙明)等则可能减慢盐酸安罗替尼代谢,增加其血浆浓度。
柑橘、杨桃、葡萄柚和葡萄柚汁会影响细胞色素P450活性,应避免合用。
本共识所列不良反应指ALTER0303研究中经研究者判断为除与盐酸安罗替尼治疗肯定无关的不良事件[14],常见的不良反应包括高血压(67.35%)、乏力(51.02%)、TSH升高(46.60%)、食欲减退(45.24%)、高三酰甘油血症(42.86%)、高胆固醇血症(40.48%)、手足皮肤反应(43.54%)、咳嗽(37.41%)、腹泻(35.03%)、GGT升高(29.59%)、蛋白尿(28.91%)等[14]。盐酸安罗替尼的不良反应多数可通过调整剂量、暂停给药及对症处理得到控制。
建议根据盐酸安罗替尼治疗过程中出现不良反应的程度(美国国家癌症研究所常见药物毒性反应分级标准4.0版)[20]和患者治疗获益情况进行延迟给药和(或)剂量调整(表5)。肝功能异常、出血、蛋白尿等不良反应处理参考其相对应的剂量调整原则。
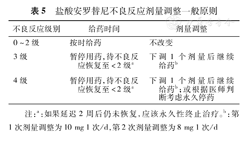
盐酸安罗替尼不良反应剂量调整一般原则
盐酸安罗替尼不良反应剂量调整一般原则
| 不良反应级别 | 给药时间 | 剂量调整 |
|---|---|---|
| 0~2级 | 按时给药 | 不改变 |
| 3级 | 暂停用药,待不良反应恢复至<2级a | 下调1个剂量后继续给药b |
| 4级 | 暂停用药,待不良反应恢复至<2级a | 下调1个剂量后继续给药b;或根据医师判断考虑永久停药 |
注:a:如果延迟2周后仍未恢复,应该永久性终止治疗。b:第1次剂量调整为10 mg 1次/d,第2次剂量调整为8 mg 1次/d
抗血管生成药物引起高血压的机制目前尚未明确,可能的机制有:(1)一氧化氮和前列腺素I2产生减少[21];(2)微血管网络稀疏[22,23];(3)内皮素-1分泌增多[24];(4)活性氧合成增多[24,25]。ALTER0303研究中高血压一般在用药后2周内出现,发生率为67.35%,其中≥3级发生率为13.61%(3级39/294,4级1/294)。使用利尿剂、β-受体阻滞剂和钙离子通道拮抗剂等常规降压药物可以控制[14]。
【防治建议】患者宣教,监测血压;对于无应用降压药指征的1级高血压,可进行生活方式干预,包括减少钠盐摄入、增加钾盐摄入、控制体重、戒烟、限制饮酒、体育运动和减轻精神压力[26]。2级及以上程度高血压建议进行医疗干预(表6)。

盐酸安罗替尼治疗期间高血压干预建议
盐酸安罗替尼治疗期间高血压干预建议
| 分级 | 症状 | 防治建议 |
|---|---|---|
| 1级 | 高血压前期:(收缩压120~139 mmHg,舒张压80~89 mmHg) | 无使用降压药指征,仅监测血压;生活方式干预 |
| 2级 | 第一阶段高血压(收缩压140~159 mmHg,舒张压90~99 mmHg),需要医学干预;反复或持久的(≥24 h)、有症状的收缩压增加>20 mmHg;既往在正常范围内,增加至>140/90 mmHg | 需要单药治疗同时监测血压;多数使用噻嗪类利尿剂,也可考虑使用血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体阻滞剂(ARB)、β-受体阻滞剂、钙离子通道阻滞剂 |
| 3级a | 第二阶段高血压(收缩压≥160 mmHg,舒张压≥100 mmHg); | 对症治疗,通常为>1种降压药物治疗或需要较以前更为增强的治疗。可选择噻嗪类利尿剂与ACEI或β-受体阻滞剂或钙离子通道阻滞剂进行治疗 |
| 4级a | 危及生命(如恶性高血压,一过性或持久性神经损伤,高血压危象);需要紧急治疗 | 紧急干预,可静脉应用硝普钠或钙离子通道阻滞剂进行降压,积极治疗相关并发症;一旦出现高血压危象,应永久性终止盐酸安罗替尼的使用 |
| 5级 | 死亡 | 无 |
注:a:若收缩压≥180 mmHg,舒张压≥110 mmHg,应暂停用药;如恢复用药后再次出现3/4级血压升高则降低1个剂量等级后继续给予盐酸安罗替尼治疗。如3/4级高血压持续,建议永久停用盐酸安罗替尼;1 mmHg=0.133 kPa
既往罹患高血压的患者开始盐酸安罗替尼治疗前应充分控制血压,治疗过程中应常规监测血压;用药6周内每天监测血压,后续用药期间每周监测血压2~3次,发现血压升高或出现头痛头晕症状时应及时就诊并接受降压药物治疗,必要时暂停盐酸安罗替尼治疗或进行剂量调整[14]。
抗血管生成治疗导致手足皮肤反应的发病机制可能是药物同时抑制VEGFR和PDGFR两条信号传导通路,破坏手足受压部位血管的修复机制[27];也可能是药物通过外分泌腺(汗腺)富集在手掌与足底等腺体较丰富的区域而导致局部组织损伤[28]。ALTER0303研究中手足皮肤反应的发生率为43.54%,其中3级发生率为3.74%(11/294),无4级不良反应发生[14],一般在服药2周期左右出现,进行对症治疗后常可减轻或缓解。
【防治建议】在使用盐酸安罗替尼治疗期间,若出现手足皮肤反应,需根据其严重程度采用支持治疗或其他治疗措施[29]积极对症治疗,具体防治建议见表7。

盐酸安罗替尼手足皮肤反应干预建议
盐酸安罗替尼手足皮肤反应干预建议
| 分级 | 症状 | 防治建议 |
|---|---|---|
| 1级 | 无痛性轻微皮肤改变或皮肤炎(如红斑,水肿,角化过度) | 常无需支持治疗 |
| 2级 | 痛性皮肤改变(如剥落,水泡,出血,肿胀,角化过度);影响工具性日常生活活动 | ≥2级毒性患者考虑应用以下对症支持治疗:加强皮肤护理,保持皮肤清洁,避免继发感染;避免压力或摩擦;使用润肤霜或润滑剂,局部使用含尿素和皮质类固醇成分的乳液或润滑剂;必要时局部使用抗真菌或抗生素治疗 |
| 3级 | 重度皮肤改变(剥落,水泡,出血,水肿,角化过度),伴疼痛;影响个人日常生活活动 | 应对症支持治疗,待恢复至<2级后,下调1个剂量继续用药。如不良反应仍持续则停药 |
VEGF/VEGFR信号传导通路通过和多条信号传导通路之间形成复杂的交互作用而调控内皮细胞多方面的功能。因此,抑制VEGF信号传导通路可能导致新生血管形成受损、血小板-内皮细胞间相互作用紊乱以及凝血系统和血小板活化系统受阻,从而降低伤口愈合能力,增加出血风险[21]。咯血是ALTER0303研究中最常见的出血反应,盐酸安罗替尼组发生率为19.73%,≥3级发生率为3.06%(3级3/294,4级4/294,5级2/294),咯血发生的中位时间为62.5 d。安慰剂组发生率为7.69%,≥3级发生率为1.40%(3级2/143,无≥4级者)。虽然盐酸安罗替尼并未显著增加≥3级咯血发生率,但由于咯血后果的严重性,必须高度重视,用药时应密切关注相关症状。此外,ALTER0303研究中观察到的其他出血事件包括消化道出血(4.42%)、鼻出血(4.42%)、牙龈出血(1.02%)和血尿(0.68%)等,未观察到脑出血的发生[14]。
【防治建议】对于高出血风险患者,如存在出血风险、出血迹象或病史、用药前4周内出现≥3级的任何出血事件、存在未愈合创口、溃疡或骨折、6个月内发生过动/静脉血栓事件如脑血管意外(包括暂时性缺血性发作)、深静脉血栓、肺栓塞及接受抗凝治疗者,应在医师指导下慎用盐酸安罗替尼;具有出血风险、凝血功能异常患者亦应慎用盐酸安罗替尼。治疗期间应密切监测凝血酶原时间和国际标准化比率,出现1级出血事件,如鼻出血、牙龈出血等,可进行标准治疗;出现2级出血事件应暂停用药,如2周内能恢复至2级以下,则将盐酸安罗替尼下调1个剂量继续用药;如未能恢复至2级以下或调整剂量后再次出现,则应考虑永久停药。一旦出现≥3级的出血事件,则永久停药(表8)。

盐酸安罗替尼出血不良反应干预建议
盐酸安罗替尼出血不良反应干预建议
| 分级 | 症状 | 防治建议 |
|---|---|---|
| 1级 | 轻症,无需治疗 | 维持原有剂量 |
| 2级 | 有症状,需要治疗或轻微止血治疗 | 积极处理出血症状;延迟给药,2周内能恢复至<2级,降低1个剂量水平继续用药;如不良反应仍持续则停药 |
| 3级 | 需要输血、介入治疗、内镜、手术或放射治疗 | 紧急医学干预,永久性终止用药 |
| 4级 | 威胁生命,需要紧急治疗 | 紧急医学干预,永久性终止用药 |
| 5级 | 死亡 | 无 |
抗血管靶向药物治疗引起肝功能异常的机制尚未明确,可能的原因为:药物及其中间代谢产物对肝脏的直接毒性作用或由于VEGF/VEFGR信号传导通路被抑制,削弱了其对肝脏细胞的保护作用而造成肝功能异常。盐酸安罗替尼通过细胞色素通路在肝脏代谢,有一定肝毒性[30,31]。ALTER0303研究中,盐酸安罗替尼引起的肝功能异常主要包括转氨酶升高和胆红素升高,通常为1~2级。其中丙氨酸氨基转移酶升高发生率为15.65%,≥3级发生率为0.68%(3级2/294,无≥4级者)。天门冬氨酸氨基转移酶升高发生率为14.96%,≥3级发生率为1.02%(3级3/294,无≥4级者)。血胆红素升高发生率为25.85%,其中≥3级发生率为1.70%(3级5/294,无≥4级者)。
【防治建议】服用盐酸安罗替尼时应监测转氨酶和胆红素,建议在治疗开始前、每个周期后以及临床需要时检测转氨酶及胆红素等肝功能指标。当发生2级转氨酶或总胆红素升高时应增加检测频率、发生3/4级转氨酶或总胆红素升高时应暂停用药,同时每周监测转氨酶及总胆红素2~3次,2周内恢复至2级以下后,下调盐酸安罗替尼1个剂量后继续用药;如下调剂量后3/4级转氨酶或胆红素未好转,则建议永久停用盐酸安罗替尼。
蛋白尿是抗血管生成药物治疗较为常见的不良反应,大约40%的患者会产生无症状性蛋白尿[29]。抗VEGF治疗引起蛋白尿的机制尚不确定,推测VEGF信号传导通路受到抑制后可能破坏肾小球滤过屏障,影响肾小球滤过功能。此外,肾小球内皮细胞受损及增殖降低引起肾病综合征和血栓性肾小球微血管病变同样会导致蛋白尿的发生[28,29]。ALTER0303研究中,蛋白尿一般在服用盐酸安罗替尼3个周期内出现,发生率为28.91%,其中3级发生率为2.38%(7/294),未观察到4级蛋白尿的发生。
【防治建议】建议患者每6周检查尿常规,对连续2次尿蛋白≥++者需进行24 h尿蛋白测定,根据不良反应严重程度采取包括暂停用药、剂量调整和永久停药等处理措施(表9)。肾功能不全的患者应在医师指导下慎用盐酸安罗替尼并密切监测。

盐酸安罗替尼蛋白尿不良反应分级及干预建议
盐酸安罗替尼蛋白尿不良反应分级及干预建议
| 分级 | 症状 | 防治建议 |
|---|---|---|
| 1级 | 尿常规检查示尿蛋白+或24 h尿蛋白定量检测<1.0 g | 维持原有剂量 |
| 2级 | (1)尿常规检查示尿蛋白++,但24 h尿蛋白定量检测在1.0~2.0 g(不含2.0 g)(2)尿常规检查示尿蛋白++或以上,24 h尿蛋白定量检测在2.0~3.5 g(不含3.5 g) | (1)维持原有剂量,积极治疗并监测尿常规(1次/周),必要时请肾内科医师会诊(2)延迟给药;积极治疗,必要时请肾内科医师会诊,2周内恢复至<2级,后续用药降低1个剂量水平;第3次出现须永久性终止用药 |
| 3级 | 24 h尿蛋白定量≥3.5 g | 延迟给药;积极治疗,必要时请肾内科医师会诊;2周内恢复至<2级,后续用药降低1个剂量水平;第3次出现须永久性终止用药 |
乏力常与肿瘤本身及抗肿瘤治疗相关,同时可受多种因素影响,例如:合并药物治疗、甲状腺功能减退、合并症、心力衰竭、疼痛、疾病进展、炎症、中枢或周围神经肌肉病变和自主神经病变等。乏力通常并非仅由药物不良反应所致,因此应针对病因对症处理。在ALTER0303临床研究中,盐酸安罗替尼组乏力的发生率为51.02%,≥3级发生率为0.34%(3级1/294,无≥4级者)。
甲状腺功能减退是引起乏力的重要因素之一[32],ALTER0303研究中盐酸安罗替尼组甲状腺功能减退的发生率为19.39%,其中≥3级发生率为0.34%(1/294,无≥4级者)。患者应在初次用药前检查甲状腺功能,基础甲状腺功能异常的患者在接受盐酸安罗替尼治疗之前应给予相应的标准治疗。所有患者在接受盐酸安罗替尼治疗时应密切监测甲状腺功能减退的症状和体征,包含畏寒、食欲下降和水肿等;对有甲状腺功能不全症状或体征的患者建议检查甲状腺功能;对于在盐酸安罗替尼治疗期间出现甲状腺功能减退的患者建议内分泌专科就诊接受规范治疗;若发生3/4级甲状腺功能减退,建议暂停盐酸安罗替尼治疗;如恢复用药后再次出现,可下调1个剂量后继续用药,每3~6周进行甲状腺功能检查,如不良反应仍持续,则建议停药。
腹泻是肿瘤患者最常见的消化道不良反应之一,腹泻严重影响肿瘤患者的生活质量和治疗效果。目前对于抗血管生成药物导致腹泻的机制尚未完全阐明,可能与药物进入胃肠道后吸收时间较长、药物在代谢过程中酸碱度随时间变化直接刺激胃肠道黏膜等相关[29,30,33]。在ALTER0303研究中,盐酸安罗替尼组腹泻的发生率为35.03%,其中≥3级发生率为1.02%(3级3/294,无≥4级者)。针对该不良反应的程度可选择观察或者对症进行药物止泻处理。若在盐酸安罗替尼治疗期间发生3/4级腹泻,建议暂停盐酸安罗替尼治疗,及时就诊,以纠正电解质紊乱及容量不足;如恢复用药后再次出现3/4级腹泻,可下调1个剂量后继续用药,如不良反应仍持续,建议永久停用盐酸安罗替尼。
盐酸安罗替尼在三线及以上治疗晚期NSCLC的有效性及安全性已经在临床研究中获得了肯定,为晚期NSCLC患者提供了新的治疗选择。受限于临床研究严格的入排标准和医学干预,相关结果并不能全面、准确地反映盐酸安罗替尼在真实世界中治疗晚期NSCLC患者的情况。本共识结合了盐酸安罗替尼治疗晚期NSCLC的临床研究数据、上市后临床用药情况、专家学者的临床实践经验以及其他抗血管生成靶向药物的使用情况,为临床医师合理、安全地应用盐酸安罗替尼提供用药参考。
由于上市时间仅数月,有关盐酸安罗替尼的优势人群、剂量调整办法、不良反应的类型和程度以及相应的防治措施等,都需要不断地积累经验,以期在提高患者疗效的同时降低用药风险。
顾问:孙燕(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科抗肿瘤分子靶向药物临床研究北京市重点实验室);廖美琳(上海交通大学附属胸科医院呼吸内科)
组长:石远凯(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科抗肿瘤分子靶向药物临床研究北京市重点实验室);韩宝惠(上海交通大学附属胸科医院呼吸内科);李凯(天津医科大学肿瘤医院肺部肿瘤内科天津市肿瘤研究所)
委员(按姓氏笔画排序):丁翠敏(河北医科大学第四医院呼吸内科);于雁(哈尔滨医科大学附属肿瘤医院呼吸肿瘤内科);马智勇(郑州大学附属肿瘤医院/河南省肿瘤医院内科);王子平(北京大学肿瘤医院暨北京市肿瘤防治研究所胸部肿瘤内一科);王东林(重庆市肿瘤医院肿瘤内科);王秀问(山东大学齐鲁医院肿瘤中心化疗科);王启鸣(郑州大学附属肿瘤医院/河南省肿瘤医院内科);王哲海(山东省肿瘤医院内科);王晶(天津医科大学肿瘤医院肺部肿瘤内科天津市肿瘤研究所);支修益(首都医科大学宣武医院胸外科);方健(北京大学肿瘤医院暨北京市肿瘤防治研究所胸部肿瘤内二科);石建华(临沂市肿瘤医院内二科);冯继锋(江苏省肿瘤医院肿瘤内科);伍钢(华中科技大学同济医学院附属协和医院肿瘤中心);邬麟(湖南省肿瘤医院胸部内二科);刘云鹏(中国医科大学附属第一医院肿瘤内科);刘华(甘肃省人民医院呼吸科);刘安文(南昌大学第二附属医院肿瘤科);刘晓晴(解放军第三〇七医院肺部肿瘤科);刘基巍(大连医科大学附属第一医院肿瘤一科);许建萍(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科抗肿瘤分子靶向药物临床研究北京市重点实验室);李宝兰(首都医科大学附属北京胸科医院北京市结核病胸部肿瘤研究所综合科);李恩孝(西安交通大学第一附属医院肿瘤内科);杨磊(甘肃省肿瘤医院呼吸肿瘤内科);束永前(江苏省人民医院肿瘤科);肖文华(解放军总医院第一附属医院肿瘤内科);吴国明(陆军军医大学第二附属医院呼吸科);吴密璐(青海大学附属医院肿瘤内科);余萍(四川省肿瘤医院临床研究标准化治疗病区);宋勇(解放军南京总医院呼吸科);宋霞(山西省肿瘤医院呼吸二科);张力(中国医学科学院北京协和医院呼吸与危重症医学科);张树才(首都医科大学附属北京胸科医院北京市结核病胸部肿瘤研究所肿瘤内科);张贺龙(空军军医大学唐都医院肿瘤内科);张翠英(内蒙古自治区人民医院肿瘤内科);陈军(天津医科大学总医院肺部肿瘤外科);陈岩菊(海南省人民医院肿瘤内科);陈理明(汕头大学医学院第一附属医院肿瘤科);陈颖兰(江西省肿瘤医院胸部肿瘤内科);金发光(空军军医大学唐都医院呼吸与重症监护医学科);周建英(杭州市肿瘤医院胸部灌注内科);赵君慧(青海大学附属医院肿瘤内科);赵怡卓(上海交通大学附属胸科医院呼吸内科);赵琼(杭州市肿瘤医院胸部灌流内科);胡春宏(中南大学湘雅二医院肿瘤科);胡晓桦(广西医科大学第一附属医院肿瘤内科);柳江(新疆维吾尔自治区人民医院肿瘤科);郭其森(山东省肿瘤医院内科);黄诚(福建省肿瘤医院胸部肿瘤内科);黄建瑾(浙江大学医学院附属第二医院肿瘤内科);常建华(复旦大学附属肿瘤医院肿瘤内科);董坚(云南省肿瘤医院内一科);程颖(吉林省肿瘤医院胸部肿瘤内科);焦顺昌(解放军总医院肿瘤内科)
学术秘书:姜时雨(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科抗肿瘤分子靶向药物临床研究北京市重点实验室)



























对本刊2018年第98卷44期第3566页专家成员中委员单位信息更正:周建英(杭州市肿瘤医院胸部灌注内科);赵琼(杭州市肿瘤医院胸部灌流内科)更正为:周建英(浙江大学附属第一医院呼吸内科);赵琼(杭州市肿瘤医院胸部肿瘤内科)
更正的同时表示歉意!