
探讨右美托咪啶对胸腹腔镜下食管癌根治术患者围手术期应激和术后疼痛的影响。
本研究为前瞻性研究。选取2016年1月至2017年10月在郑州大学附属肿瘤医院行胸腹腔镜下食管癌根治术患者100例,随机数字表法分为对照组(C组)、右美托咪啶组(D组)。两组患者均进行静脉靶控输注丙泊酚和瑞芬太尼、静脉推注苯磺酸阿曲库铵进行麻醉诱导和维持,脑电双频指数(BIS)监测麻醉深度,术中维持BIS值45~60,术毕前30 min单次静脉注射舒芬太尼(0.3 μg/kg)后接静脉镇痛泵进行术后患者自控镇痛(PCA)。D组患者诱导前20 min静脉滴注右美托咪啶(1 μg/kg)、术中静脉泵注右美托咪啶(0.2 μg·kg-1·h-1),PCA舒芬太尼0.025 μg·kg-1·h-1 +右美托咪啶0.1 μg·kg-1·h-1,单次按压给予舒芬太尼0.025 μg/kg+右美托咪啶0.1 μg/kg。C组PCA舒芬太尼0.04 μg·kg-1·h-1,单次按压给予舒芬太尼0.04 μg/kg。记录患者手术时间、液体出入量、术后PCA按压次数,并于术前1 d(T0)、麻醉诱导前即刻(T1)、麻醉苏醒后1 h(T2)、术后24 h(T3)、术后3 d(T4)、术后7 d(T5)、术后1个月(T6)、术后3个月(T7)、术后6个月(T8)采集静脉血检测血清去甲肾上腺素、肾上腺素、皮质酮水平;并于T2、T3、T4、T5、T6、T7、T8时间点对患者进行疼痛模拟评分。
2组患者年龄、性别、体质指数(BMI)、美国麻醉医师协会(ASA)分级差异均无统计学意义(均P>0.05)。2组患者手术时间、术中补液量、术中出血量差异均无统计学意义(均P>0.05)。D组术后24 h内舒芬太尼用量为(35.86±8.65)μg,明显少于C组的(59.53±15.26)μg,差异有统计学意义(t=7.061, P<0.05)。D组术后24 h内PCA按压次数为(2.15±1.38)次,明显少于C组[(5.85±2.16)次,t=4.971, P<0.05]。D组血清去甲肾上腺素水平在T1、T2、T3、T4、T5时间点均明显低于C组(t=13.276、16.027、14.319、12.771、12.296,均P<0.05);其余时间点两组差异均无统计学意义(均P>0.05)。D组血清肾上腺素水平在T2、T3、T4、T5时间点均明显低于C组(t=6.153、8.774、9.127、8.409,均P<0.05);其余时间点两组差异均无统计学意义(均P>0.05)。D组血清皮质酮水平在T2、T3、T4、T5时间点明显低于C组(t=16.364、15.306、12.153、12.592,均P<0.05);其余时间点两组差异均无统计学意义(均P>0.05)。2组术后疼痛VAS评分在T2、T3、T4、T5时间点差异均无统计学意义(均P>0.05);D组在T6、T7、T8时间点疼痛患者(VAS评分≥4分)分别为10例(20%)、4例(8%)、3例(6%),均明显低于C组20例(40%)、12例(24%)、10例(20%),差异均有统计学意义(χ2=4.762、4.762、4.332,均P<0.05)。
围手术期应用右美托咪啶可以有效减轻胸外科胸腹腔镜联合食管癌根治术患者围手术期应激水平,减少围手术期阿片类药物应用,并减少患者术后慢性疼痛的发生率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胸外科开胸手术的术后慢性痛发生率为30%~40%,严重影响患者术后康复[1]。目前郑州大学附属肿瘤医院(河南省肿瘤医院)胸外科食管癌手术以胸腹腔镜食管癌根治术为主,以达到微创治疗效果和患者快速康复的目的。但在术后随访中发现部分患者仍然会出现严重的术后急性痛和持久的术后慢性痛。最新研究表明[2,3],围手术期应激可导致患者术后疼痛加剧,部分患者的术后疼痛会明显延长。如何有效地抑制围手术期应激反应是麻醉科医师一直探讨的问题。研究表明[4,5,6],右美托咪啶可有效减轻围手术期患者的应激反应。本研究拟在术前、术中和术后应用右美托咪啶,观察我院胸腹腔镜联合食管癌根治术患者的应激水平和术后疼痛的转归情况,以期能指导临床麻醉对食管癌根治术患者进行围手术期管理和术后疼痛的干预管理。
本研究为前瞻性研究,经本院伦理委员会批准(批准文号:ZLYJY20151012-001),所有患者均签署知情同意书。(1)纳入标准:2016年1月至2017年10月期间我院拟行胸腹腔镜联合食管癌根治术患者,年龄40~70岁,体质量50~80 kg,身高150~180 cm,美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级,无明显心、肺、肝、肾功能异常,无慢性疼痛病史,无阿片类药物等用药史。(2)排除标准:围手术期应用肾上腺素能(α/β受体)激动剂/抑制剂3次以上或单次持续输注血管活性药物30 min以上的患者;围手术期出现大出血、严重感染、休克等危重情况的患者;术后6个月内任何原因再次手术或死亡的、因危急重症住院治疗的、伤口感染或影像学检查证实肿瘤转移的患者;非食管癌手术相关疼痛或其他原因需定期服用镇痛药物的患者;任何原因不能完成所有试验数据采集的患者。采用随机数字表法将入组患者分为对照组(C组,n=50)和右美托咪啶组(D组,n=50)。
两组患者均行胸腹联合腔镜下食管癌根治术,所有入组患者术前常规禁食、禁水,入手术室后吸氧,常规补液,检测心电图(ECG)、无创血压(NIBP)、血氧饱和度(SpO2)、呼气末二氧化碳分压(PETCO2)和脑电双频指数(BIS)。两组均应用丙泊酚(血浆靶控3 μg/ml)和瑞芬太尼(血浆靶控4 ng/ml)、静脉推注顺苯磺酸阿曲库铵(0.2 mg/kg)进行麻醉诱导,单腔气管内插管,机械通气。术中丙泊酚(血浆靶控3~5 μg/ml)和瑞芬太尼(血浆靶控3~6 ng/ml)、间断静脉推注顺苯磺酸阿曲库铵维持麻醉,BIS值维持在45~60。D组麻醉诱导前20 min静脉输注右美托咪啶(江苏恩华药业股份有限公司,批号:16012215,1 μg/kg ,>10 min),术中静脉泵注右美托咪啶(0.2 μg·kg-1·h-1),手术结束前30 min停止泵入右美托咪啶。术中桡动脉穿刺置管测动脉血压(术后1 h完成数据采集后拔除动脉穿刺针,术前和术后24 h及后续血压通过上肢袖带测压获得)。所有患者手术结束前约30 min静脉推注舒芬太尼(0.3 μg/kg)并连接术后镇痛泵,术毕患者均送入麻醉复苏室。术后患者自控镇痛(PCA):C组舒芬太尼0.04 μg·kg-1·h-1,单次按压给予舒芬太尼0.04 μg/kg;D组舒芬太尼0.025 μg·kg-1·h-1 +右美托咪啶0.1 μg·kg-1·h-1,单次按压给予舒芬太尼0.025 μg/kg+右美托咪啶0.1 μg/kg。PCA间隔时间为≥10 min。
于术前1 d(T0)、麻醉诱导前即刻(T1)、麻醉苏醒后1 h(T2)、术后24 h(T3)、术后3 d(T4)、术后7 d(T5)、术后1个月(T6)、术后3个月(T7)、术后6个月(T8)采集患者静脉血5 ml,静置30 min后,900×g离心10 min,分离保留血清,-70 ℃保存,酶联免疫吸附试验(ELISA)方法检测血肾上腺素、去甲肾上腺素和皮质酮水平,试剂盒均购自碧云天生物技术公司。记录患者年龄、体质指数(BMI)、手术时间、液体出入量、术后24 h内舒芬太尼用量和PCA按压次数,并于T2、T3、T4、T5、T6、T7、T8时间点对患者进行疼痛模拟评分。患者术后来我院复查时进行T6、T7、T8时间点数据采集,记录T6、T7、T8时间点疼痛模拟评分≥4分的患者例数。
采用统计学软件SPSS 21.0进行数据分析,正态分布计量资料以 ±s表示,2组比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
±s表示,2组比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
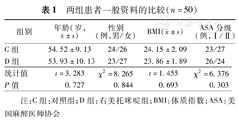
部分患者因术后未能按时复诊导致样本被排除,为了保证样本量,根据随机原则进行增补。两组患者年龄、性别、BMI、ASA分级构成比差异均无统计学意义(均P>0.05),见表1。
两组患者一般资料的比较(n=50)
两组患者一般资料的比较(n=50)
| 组别 | 年龄(岁, ±s) ±s) | 性别(例,男/女) | BMI( ±s) ±s) | ASA分级(例,Ⅰ/Ⅱ) |
|---|---|---|---|---|
| C组 | 54.52±9.13 | 24/26 | 24.15±2.09 | 23/27 |
| D组 | 53.93±10.13 | 23/27 | 23.86±1.89 | 26/24 |
| 统计值 | t=3.283 | χ2=8.265 | t=1.455 | χ2=6.376 |
| P值 | 0.727 | 0.844 | 0.693 | 0.303 |
注:C组:对照组;D组:右美托咪啶组;BMI:体质指数;ASA:美国麻醉医师协会
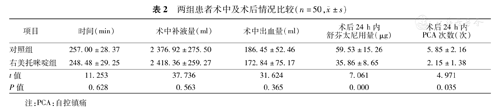
两组患者的手术时间、术中补液量、术中出血量差异均无统计学意义。D组术后24 h内舒芬太尼用量明显少于C组,PCA按压次数明显少于C组。见表2。
两组患者术中及术后情况比较(n=50, ±s)
±s)
两组患者术中及术后情况比较(n=50, ±s)
±s)
| 项目 | 时间(min) | 术中补液量(ml) | 术中出血量(ml) | 术后24 h内舒芬太尼用量(μg) | 术后24 h内PCA次数(次) |
|---|---|---|---|---|---|
| 对照组 | 257.00±28.37 | 2 376.92±275.50 | 186.45±52.46 | 59.53±15.26 | 5.85±2.16 |
| 右美托咪啶组 | 248.48±29.25 | 2 418.36±259.27 | 172.84±75.17 | 35.86±8.65 | 2.15±1.38 |
| t值 | 11.253 | 37.736 | 31.624 | 7.061 | 4.971 |
| P值 | 0.628 | 0.563 | 0.365 | 0.000 | 0.035 |
注:PCA:自控镇痛
两组的去甲肾上腺素水平在T0、T6、T7、T8时间点差异无统计学意义;D组在T1、T2、T3、T4、T5时间点均明显低于C组。两组肾上腺素水平在T0、T1、T6、T7、T8时间点差异无统计学意义;D组在T2、T3、T4、T5时间点均明显低于C组。两组皮质酮水平在T0、T6、T7时间点差异无统计学意义;D组在T1、T2、T3、T4、T5时间点均明显低于C组。见表3。

两组患者血清去甲肾上腺素和肾上腺素及皮质酮在不同时间点水平的比较(n=50, ±s)
±s)
两组患者血清去甲肾上腺素和肾上腺素及皮质酮在不同时间点水平的比较(n=50, ±s)
±s)
| 指标 | 对照组 | 右美托咪啶组 | t值 | P值 | |
|---|---|---|---|---|---|
| 去甲肾上腺素(ng/L) | |||||
| T0 | 208.20±15.13 | 206.19±18.42 | 8.164 | 0.458 | |
| T1 | 232.77±26.95 | 179.62±27.88 | 13.276 | 0.014 | |
| T2 | 400.06±41.69 | 275.65±25.46 | 16.027 | 0.004 | |
| T3 | 348.50±35.73 | 211.29±18.36 | 14.319 | 0.013 | |
| T4 | 303.71±25.53 | 178.22±12.28 | 12.771 | 0.001 | |
| T5 | 211.42±26.17 | 154.34±16.21 | 12.296 | 0.002 | |
| T6 | 149.84±20.48 | 142.18±12.18 | 6.347 | 0.261 | |
| T7 | 143.37±15.18 | 143.71±13.74 | 5.279 | 0.854 | |
| T8 | 152.43±15.92 | 145.63±14.25 | 6.335 | 0.275 | |
| 肾上腺素(ng/L) | |||||
| T0 | 128.83±11.47 | 129.45±14.58 | 2.273 | 0.116 | |
| T1 | 130.18±12.45 | 131.77±17.58 | 2.115 | 0.155 | |
| T2 | 151.39±11.53 | 107.62±10.44 | 6.153 | 0.003 | |
| T3 | 113.46±9.23 | 88.36±8.03 | 8.774 | 0.023 | |
| T4 | 109.18±10.24 | 78.43±7.15 | 9.127 | 0.002 | |
| T5 | 86.38±5.52 | 71.38±5.11 | 8.409 | 0.026 | |
| T6 | 80.48±8.17 | 76.87±8.34 | -1.281 | 0.796 | |
| T7 | 80.58±7.12 | 76.36±8.56 | 0.283 | 0.623 | |
| T8 | 83.76±8.06 | 79.33±7.34 | 1.026 | 0.683 | |
| 皮质醇(μg/L) | |||||
| T0 | 318.29±22.39 | 321.26±23.25 | 12.395 | 0.951 | |
| T1 | 450.40±24.46 | 438.91±33.29 | 13.285 | 0.632 | |
| T2 | 513.59±24.37 | 415.22±17.05 | 16.364 | 0.003 | |
| T3 | 489.26±23.29 | 367.60±21.16 | 15.306 | 0.000 | |
| T4 | 405.77±17.31 | 321.98±20.26 | 12.153 | 0.003 | |
| T5 | 388.79±21.38 | 313.84±21.44 | 12.592 | 0.017 | |
| T6 | 297.29±15.69 | 288.55±11.26 | 6.117 | 0.510 | |
| T7 | 270.68±14.81 | 263.72±20.15 | 4.324 | 0.235 | |
| T8 | 267.03±20.20 | 256.13±27.62 | 5.025 | 0.641 | |
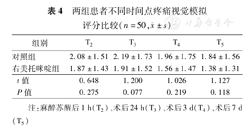
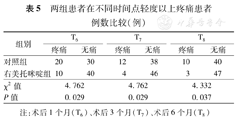
两组患者术前均无疼痛主诉。两组在T2、T3、T4、T5时间点疼痛视觉模拟评分(VAS)差异无统计学意义(表4)。与C组相比,D组在T6、T7、T8时点轻度疼痛以上(VAS评分≥4分)的患者分别为10例(20%)、4例(8%)、3例(6%),均明显少于C组的20例(40%)、12例(24%)、10例(20%),见表5。
两组患者不同时间点疼痛视觉模拟评分比较(n=50, ±s)
±s)
两组患者不同时间点疼痛视觉模拟评分比较(n=50, ±s)
±s)
| 组别 | T2 | T3 | T4 | T5 |
|---|---|---|---|---|
| 对照组 | 2.08±1.51 | 2.19±1.73 | 1.96±1.75 | 1.84±1.56 |
| 右美托咪啶组 | 1.87±1.43 | 1.91±1.52 | 1.56±1.47 | 1.38±1.31 |
| t值 | 0.648 | 1.200 | 1.026 | 1.127 |
| P值 | 0.275 | 0.077 | 0.219 | 0.118 |
注:麻醉苏醒后1 h(T2)、术后24 h(T3)、术后3 d(T4)、术后7 d(T5)
两组患者在不同时间点轻度以上疼痛患者例数比较(例)
两组患者在不同时间点轻度以上疼痛患者例数比较(例)
| 组别 | T6 | T7 | T8 | |||
|---|---|---|---|---|---|---|
| 疼痛 | 无痛 | 疼痛 | 无痛 | 疼痛 | 无痛 | |
| 对照组 | 20 | 30 | 12 | 38 | 10 | 40 |
| 右美托咪啶组 | 10 | 40 | 4 | 46 | 3 | 47 |
| χ2值 | 4.762 | 4.762 | 4.332 | |||
| P值 | 0.029 | 0.029 | 0.037 | |||
注:术后1个月(T6)、术后3个月(T7)、术后6个月(T8)
外科手术创伤和围术期患者紧张等精神因素均会导致不良的应激反应。胸腔内手术因为其手术区域重要脏器和神经的分布,术中手术操作容易诱发剧烈的应激反应,进而引起明显的血流动力学变化。我院胸腹腔镜下食管癌根治术中,为了暴露、清扫气管隆突周围淋巴结,术中采用单腔气管插管、小潮气量快频率维持通气,但高碳酸血症、肺不张-复张引起的肺缺血再灌注等因素均可加重机体应激反应。手术创伤将刺激信号通过脊髓外侧丘脑束传导致大脑皮质,到达下丘脑-垂体-肾上腺轴,启动肾上腺皮质髓质释放皮质醇和儿茶酚胺。皮质醇和儿茶酚胺(肾上腺素和去甲肾上腺素)的水平常用来反映创伤和应激反应程度。
右美托咪啶作为高选择性的α2 -肾上腺素能受体激动剂,它主要通过激动交感神经突触前膜α2受体,抑制突触前膜释放去甲肾上腺素、降低血液中儿茶酚胺浓度,减轻患者应激导致的机体反应[7,8]。本研究结果提示,术前应用1 μg/kg的右美托咪啶缓慢泵注,可以明显降低诱导前患者的去甲肾上腺素水平;结合右美托咪啶术中和术后镇痛时应用可以明显降低术后7 d内的去甲肾上腺素、肾上腺素和皮质醇的水平,明显抑制了术后应激水平。
右美托咪啶还可通过其他多种通路抑制机体过度的应激反应[9,10,11]:右美托咪啶通过抑制谷氨酸的释放、激动α2肾上腺素受体和咪唑啉受体减轻应激对中枢神经系统的损害;右美托咪啶通过调节炎性因子等减轻应激对肺脏的损伤[12];右美托咪啶通过激活受体调节和非受体调节的促存活蛋白[13]、通过促进Erk1/2、蛋白激酶B和内皮型一氧化氮合酶的磷酸化减轻应激对心血管系统损害[14,15]。
围手术期过度的应激反应是术后疼痛慢性化的危险因素[2]。围手术期过度的应激将直接影响患者苏醒期的舒适度和术后的康复状况[16,17,18,19,20,21,22],还会导致患者术后长时间的疼痛[2]。
右美托咪啶通过激活脊髓突触前、后膜α2肾上腺素受体受体,使细胞发生超极化进而抑制疼痛信号传导,在脊髓水平发生镇痛[23,24,25];通过抑制Aα纤维和C纤维对外周神经产生镇痛作用;通过抑制突触前膜P物质的释放,减轻疼痛刺激。本研究在试验组患者术前给予右美托咪啶(1 μg/kg)、术中给予右美托咪啶(0.4 μg·kg-1)、术后给予右美托咪啶(0.1 μg·kg-1·h-1)复合舒芬太尼(0.025 μg·kg-1·h-1)静脉镇痛,结果显示右美托咪啶复合较少剂量的舒芬太尼即可有效抑制术后急性疼痛。值得一提的是,尽管两组患者术后1个月时,应激水平均降低,而且两组并无明显差别,但右美托咪啶组患者术后疼痛明显低于对照组。
此外,右美托咪啶还能与阿片类药物联合应用产生协同效果,在不影响镇痛作用的前提下减少阿片类药物在围手术期使用剂量。研究证明[26],右美托咪啶与阿片类药物产生的协同效应可使疼痛很好地被缓解或消除。本研究中,围手术期应用右美托咪啶可减少术后镇痛时舒芬太尼约40%的用量。
国际疼痛研究协会将由手术引起并继发于术后急性疼痛,持续时间>3个月的疼痛定义为术后慢性疼痛。虽然广大患者和医务工作者提高了术后慢性疼痛的治疗和预防措施,但术后慢性疼痛的发生率仍然较高。研究表明,因胸腔镜开孔数目和手术类别不同,术后3个月时慢性疼痛发生率由11%至54.46%不等,术后5 d仍较明显的疼痛是发生术后疼痛的危险因素,开孔越少术后慢性痛发生率越低[27,28,29]。之前研究多为肺癌手术患者术后疼痛的研究,鲜有腔镜下食管癌根治术患者术后疼痛的研究,食管癌根治术在胸、腹腔内均有操作,对患者的创伤明显大于肺部手术。我们的平行研究表明,开胸食管癌根治术患者术后3个月时慢性痛发生率为30.56%。本研究中,胸腹腔镜联合食管癌根治术患者术后3个月慢性痛发生率为24%低于开胸食管癌根治术。本研究结果提示,围手术期(术前、术中、术后)使用右美托咪啶可使术后1个月慢性痛发生率由40%降至20%,术后3个月慢性痛发生率由24%降至8%,术后6个月慢性痛发生率由20%降至6%,这可能与右美托咪啶有效抑制围手术期患者过度的应激反应和右美托咪啶-阿片类药物协同镇痛有关。动物实验研究还提示,尽管术前应激引起的体内儿茶酚胺和皮质酮在术后1个月时已恢复正常水平,但应激导致的脊髓背角神经元AMPA受体长时间处于高度磷酸化水平(>2个月),高水平AMPA受体磷酸化可能参与、介导了术后疼痛慢性化机制[2]。
此外,右美托咪啶还能与阿片类药物联合应用产生协同效果,在不影响镇痛作用的前提下减少阿片类药物在围手术期使用剂量。研究证明,右美托咪啶与阿片类药物产生的协同效应可使疼痛很好地被缓解或消除[26]。本研究中,围手术期应用右美托咪啶在术后24 h内达到同样镇痛效果情况下可减少术后镇痛时舒芬太尼约40%[100%×(59.53-35.86)/59.53]的用量。
围手术期应用右美托咪啶也可通过激动突触后膜受体,抑制交感神经活性,减少术前因紧张、术中创伤等因素引起的血压升高和心率加快的发生率[30]。李彩伟等[31]研究提示,右美托咪啶在麻醉诱导前、诱导同步或诱导后给药均是安全的,术中患者血流动力学稳定可以减少术中麻醉药物用量并减少围手术期应用心血管活性药物的机会,患者从而获益。
综上所述,围手术期应用右美托咪啶可以有效抑制胸腹腔镜下食管癌根治术患者围手术期应激反应,减轻术后急性痛,降低术后慢性痛的发生率,并明显减少术后阿片药物使用量。但本研究根据临床经验使用右美托咪啶,是否有更合适的应用剂量有待进一步研究和探讨。



























