
探讨骨髓增生异常综合征(MDS)患者在接受异基因造血干细胞移植(allo-HSCT)后基于WT1基因及流式细胞术(FCM)监测微小残留病(MRD)的意义。
分别采用实时定量聚合酶链反应(RQ-PCR)和8色FCM检测2011年2月至2015年10月于北京大学人民医院接受allo-HSCT的MDS患者移植前及移植后骨髓中WT1基因表达及异常免疫表型,并与临床结果进行相关分析。
92例患者中,40例(48.2%)移植后WT1阳性,9例(10.8%)FCM阳性(FCM检测骨髓表型异常髓系幼稚细胞≥0.01%),27例(29.3%)患者MRDco阳性[连续2次WT1≥0.6%(间隔2周)或连续2次FCM阳性(间隔2周)或同一骨髓标本WT1≥0.6%且FCM阳性]。单因素分析显示移植后FCM阳性、MRDco阳性与复发相关(P<0.001,P=0.017)。FCM(+)、FCM(-)组移植后2年累积复发率(CIR)分别为66.7%、1.2%(P<0.001);MRDco(+)、MRDco(-)组移植后2年CIR分别为23.0%、1.6%(P=0.004)。移植后WT1、FCM、MRDco预测复发的敏感性均为66.7%,特异性分别为59.0%、96.4%、74.7%。
FCM和基于WT1/FCM的MRDco可作为MDS患者MRD监测的有效指标;基于MRDco标准进行干预可降低移植后复发率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
异基因造血干细胞移植(allo-HSCT)是治疗包括骨髓增生异常综合征(MDS)在内的血液系统恶性疾病的有效方法,移植后复发仍是导致移植失败的最主要原因之一。有效的微小残留病(MRD)检测手段以及基于MRD的复发干预策略是降低移植后复发的关键。近年来国内外越来越多的研究已逐步证实分子生物学和流式细胞术(FCM)检测可有效监测急性白血病移植后MRD[1,2,3],其中泛白血病基因WT1及FCM检测的白血病相关免疫表型(LAIP)在急性白血病移植后MRD监测中的意义也逐渐得到认可[4,5]。MDS缺乏特异性基因以及公认的免疫残留标准,其移植后MRD的监测方法及临床意义尚不明确。本研究中,我们对92例MDS患者allo-HSCT前后的WT1基因及MDS相关免疫表型检测结果和预后进行回顾性分析,对其作为MRD监测指标的临床意义进行了探讨。
本研究纳入2011年2月至2015年10月在北京大学人民医院接受allo-HSCT并满足以下条件的MDS患者:①根据WHO修订的MDS国际预后积分系统(WPSS)[6]评估为高危和极高危患者;②在移植前和移植后规定时间点均进行WT1基因和FCM检测的患者。共纳入92例患者,男56例,女36例,中位年龄38(8~60)岁。难治性血小板减少伴多系发育异常(RCMD)12例,难治性贫血伴原始细胞增多(RAEB)-1 27例,RAEB-2 53例。患者一般临床特点见表1。
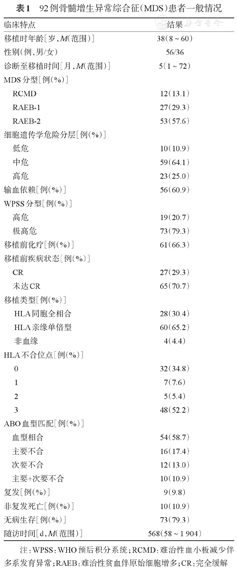
92例骨髓增生异常综合征(MDS)患者一般情况
92例骨髓增生异常综合征(MDS)患者一般情况
| 临床特点 | 结果 | |
|---|---|---|
| 移植时年龄[岁,M(范围)] | 38(8~60) | |
| 性别(例,男/女) | 56/36 | |
| 诊断至移植时间[月,M(范围)] | 5(1~72) | |
| MDS分型[例(%)] | ||
| RCMD | 12(13.1) | |
| RAEB-1 | 27(29.3) | |
| RAEB-2 | 53(57.6) | |
| 细胞遗传学危险分层[例(%)] | ||
| 低危 | 10(10.9) | |
| 中危 | 59(64.1) | |
| 高危 | 23(25.0) | |
| 输血依赖[例(%)] | 56(60.9) | |
| WPSS分型[例(%)] | ||
| 高危 | 19(20.7) | |
| 极高危 | 73(79.3) | |
| 移植前化疗[例(%)] | 61(66.3) | |
| 移植前疾病状态[例(%)] | ||
| CR | 27(29.3) | |
| 未达CR | 65(70.7) | |
| 移植类型[例(%)] | ||
| HLA同胞全相合 | 28(30.4) | |
| HLA亲缘单倍型 | 60(65.2) | |
| 非血缘 | 4(4.4) | |
| HLA不合位点[例(%)] | ||
| 0 | 32(34.8) | |
| 1 | 7(7.6) | |
| 2 | 5(5.4) | |
| 3 | 48(52.2) | |
| ABO血型匹配[例(%)] | ||
| 血型相合 | 54(58.7) | |
| 主要不合 | 16(17.4) | |
| 次要不合 | 12(13.0) | |
| 主要+次要不合 | 10(10.9) | |
| 复发[例(%)] | 9(9.8) | |
| 非复发死亡[例(%)] | 10(10.9) | |
| 无病生存[例(%)] | 73(79.3) | |
| 随访时间[d,M(范围)] | 568(58~1 904) | |
注:WPSS:WHO预后积分系统;RCMD:难治性血小板减少伴多系发育异常;RAEB:难治性贫血伴原始细胞增多;CR:完全缓解
采用北京大学血液病研究所常规方案[7],全相合移植采用改良白消安+环磷酰胺或环磷酰胺+全身照射方案,单倍型及非血缘移植加用抗胸腺细胞球蛋白(ATG)。
患者分别在移植前,移植后30、60、90、135、180、270、360 d采集骨髓标本,移植1年后根据患者临床情况每3~6个月进行骨髓检查。
①提取RNA及逆转录:骨髓标本经Na2EDTA抗凝,用相对密度为1.077 g/L的淋巴细胞分离液分离单个核细胞。经TRIzol试剂(美国Invitrogen公司产品)提取总RNA。10 μl逆转录体系中包含2 μg总RNA进行逆转录。②实时定量聚合酶链反应(RQ-PCR):在ABI Prism7500实时荧光定量PCR反应仪(美国ABI公司产品)上进行。WT1基因序列源自Tamaki的报道[8],上游引物:5′-GATAACCACACAACGCCCATC-3′,下游引物:5′-CACACGTCGCACATCCTGAAT-3′,探针:FAM-ACACCGTGCGTGTGTATTCTGTATTGG-TAMRA。③内参照基因选用ABL基因。检测方法如上述,albU上游引物Ia:5′-TCCTCGTCCTC CAGCTGTTATC- 3′,Ib:5′- TTATCAAAGGAGCA GGGAAGAAG-3′;ablU下游引物a2:5′-CTCAGACCCTGAGGCTCAAAGT- 3′,探针:FAM-AGCCCT-TCAGCGGCCAGTAGCATCT-TAMRA。④WT1表达水平计算公式:WT1基因表达水平(%)=(WT1拷贝数/ABL拷贝数)×100%,<0.6%为阴性[4]。
采用八色FCM对MDS的MRD进行检测。骨髓标本抗体组合:CD38/CD33/CD34/CD117/CD45/CD13/CD11b/D16抗体标记。
复发包括血液学复发、髓外复发,均通过骨髓细胞形态学或组织病理学检查确诊。FCM阳性:FCM检测骨髓异常髓系幼稚细胞≥0.01%。MRDco阳性:连续2次(间隔2周)WT1≥0.6%或连续2次(间隔2周)FCM阳性或同一骨髓标本WT1≥0.6%且FCM阳性。干预措施:对移植后MRDco阳性患者进行的干预措施包括减停免疫抑制剂、使用干扰素、化疗和(或)供者淋巴细胞输注(DLI)等。患者如有严重的移植物抗宿主病、感染或器官衰竭等暂不进行复发干预。
采用查阅门诊病例和电话方式进行随访。随访截止日期为2016年5月31日,中位随访时间为568(58~1 904)d。总生存(OS)时间指输注造血干细胞至任何原因导致的死亡或随访截止的时间。无病生存(DFS)时间指输注造血干细胞至疾病复发或任何原因导致患者死亡的时间。
采用SPSS 22.0统计学软件,非连续变量用独立样本t检验。生存率的计算采用Kaplan-Meier法,两组生存曲线比较采用Log-rank检验,单因素分析采用卡方检验,多因素分析采用Cox回归模型。以P<0.05为差异有统计学意义。
92例患者中,有9例患者移植后复发(9.8%),均为血液学复发,中位复发时间为移植后167(64~672)d。共有10例(10.9%)患者发生移植相关死亡,中位死亡时间为移植后115(58~457)d,死亡原因包括重症肺炎(3例)、严重移植物抗宿主病(2例)、感染中毒性休克(1例)、弥漫性肺泡出血(2例)、颅内真菌感染(1例)、血栓性微血管病(1例)。
移植前所有患者均进行了WT1和FCM检测,WT1中位表达水平为9.70%(0.05%~90.60%),FCM中位水平为0.75%(0~25.62%)。RCMD、RAEB-1、RAEB-2三组患者的移植前WT1中位水平分别为4.75%(0.11%~55.7%)、9.70%(0.32%~30.40%)、12.30%(0.05%~90.60%),RCMD组WT1表达低于RAEB-2组,但差异无统计学意义(P=0.070)。RCMD组FCM水平明显低于REAB-1、RAEB-2组(P=0.033,P=0.016),而RAEB-1和RAEB-2组之间差异无统计学意义。移植后WT1阳性、FCM阳性与移植前两者的水平无相关性(P=0.439,P=0.928)。
92例患者中共有40例(48.2%)在随访期内出现过WT1阳性,中位阳性时间为137(28~579)d,WT1的中位表达水平为0.96%(0.61%~5.30%)。共有9例(10.8%)患者检出FCM阳性,中位阳性时间为140(59~180)d,FCM中位水平为0.47%(0.01%~2.13%)。随访期内共27例(29.3%)患者达到MRDco阳性标准,中位阳性时间为148(46~409)d。
WT1(+)、WT1(-)组2年累积复发率(CIR)分别为15.7%、7.2%(P=0.069);FCM(+)、FCM(-)组2年CIR分别为66.7%、1.2%(P<0.001);MRDco(+)、MRDco(-)组2年CIR分别为23.0%、1.6%(P=0.004)(图1)。移植后WT1、FCM、MRDco预测复发的敏感性均为66.7%,特异性分别为59.0%、96.4%、74.7%。
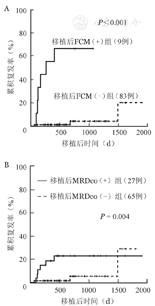

FCM:流式细胞术;MRD:微小残留病
FCM(+)与MRDco(+)组均未发生移植相关死亡。FCM(+)、FCM(-)组的2年DFS率分别为33.3%、87.7%(P<0.001),WT1(+)、WT1(-)组2年DFS分别为78.9%、77.8%(P>0.05),MRDco(+)、MRDco(-)组的2年DFS率分别为77.0%、78.9%(P>0.05);WT1(+)、WT1(-)组2年OS率分别为86.6%、76.3%(P>0.05),MRDco(+)、MRDco(-)组2年OS率分别为88.7%、77.8%(P>0.05)。
27例移植后出现MRDco阳性的患者中,18例接受不同类型的干预,最终5例(27.8%)复发。化疗+DLI干预7例,MRD转阴4例,复发3例;干扰素治疗9例,6例MRD转阴,2例MRD未转阴未复发,1例复发;仅接受化疗1例,MRD转阴;减停免疫抑制剂1例,MRD未转阴而复发。9例患者未接受上述干预,其中7例为连续2次WT1阳性但WT1表达均<1.5%),5例MRD转阴,2例未转阴未复发,另2例为同一骨髓标本WT1和FCM同时阳性,放弃干预并死于复发。
对移植后复发进行单因素分析,结果发现仅移植后FCM(+)(P<0.001)、MRDco(+)(P=0.017)与移植后复发相关(表2)。因本研究入组病例中随访期内复发人数较少,故未进行多因素分析。
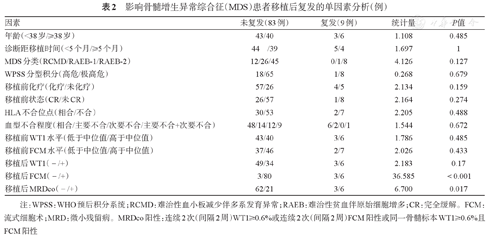
影响骨髓增生异常综合征(MDS)患者移植后复发的单因素分析(例)
影响骨髓增生异常综合征(MDS)患者移植后复发的单因素分析(例)
| 因素 | 未复发(83例) | 复发(9例) | 统计量 | P值 |
|---|---|---|---|---|
| 年龄(<38岁/≥38岁) | 43/40 | 3/6 | 1.108 | 0.485 |
| 诊断距移植时间(<5个月/≥5个月) | 44 /39 | 5/4 | 1.697 | 1 |
| MDS分类(RCMD/RAEB-1/RAEB-2) | 12/26/45 | 0/1/8 | 4.126 | 0.127 |
| WPSS分型积分(高危/极高危) | 18/65 | 1/8 | 0.268 | 0.679 |
| 移植前化疗(化疗/未化疗) | 57/26 | 4/5 | 2.134 | 0.159 |
| 移植前状态(CR/未CR) | 26/57 | 1/8 | 2.164 | 0.274 |
| HLA不合位点(相合/不合) | 30/53 | 2/7 | 2.205 | 0.488 |
| 血型不合程度(相合/主要不合/次要不合/主要不合+次要不合) | 48/14/12/9 | 6/2/0/1 | 1.544 | 0.672 |
| 移植前WT1水平(低于中位值/高于中位值) | 43/40 | 3/6 | 1.786 | 0.485 |
| 移植前FCM水平(低于中位值/高于中位值) | 37/46 | 2/7 | 2.026 | 0.433 |
| 移植后WT1(-/+) | 49/34 | 3/6 | 2.183 | 0.17 |
| 移植后FCM(-/+) | 3/80 | 3/6 | 36.585 | <0.001 |
| 移植后MRDco(-/+) | 62/21 | 3/6 | 6.700 | 0.017 |
注:WPSS:WHO预后积分系统;RCMD:难治性血小板减少伴多系发育异常;RAEB:难治性贫血伴原始细胞增多;CR:完全缓解。FCM:流式细胞术;MRD:微小残留病。MRDco阳性:连续2次(间隔2周)WT1≥0.6%或连续2次(间隔2周)FCM阳性或同一骨髓标本WT1≥0.6%且FCM阳性
MDS是一种异质性很强的血液系统克隆性疾病[9],随着新一代DNA测序技术的发展,近80%的患者可以找到体细胞遗传性突变[10],其中TP53、RUNX1、ETV6、EZH2、ASXL1及SRSF2等基因已被证实对MDS有重要的预后意义[11]。但目前为止,可用于MDS患者MRD监测的指标尚未明确。allo-HSCT是MDS有效的根治手段,MDS与急性髓性白血病(AML)的生物学发病机制不同,在移植前>60%的MDS患者未接受过化疗,因此在移植后MDS和AML的MRD监测也不尽相同。由于MDS缺乏特异性融合基因,人们越来越关注泛白血病的过表达基因WT1与FCM在MDS患者MRD监测中的意义。
本中心以往研究结果证实WT1基因和FCM是预测包括MDS在内的髓系恶性肿瘤移植后复发的有效指标[5],但该研究MDS患者仅占11%,未进行亚组分析。此外,MDS的免疫残留和AML表型也存在一定差异,因此本研究仅针对MDS的移植患者进行了分析。结果提示移植后FCM阳性和MRDco阳性与疾病复发明显相关,而移植后WT1阳性与复发虽有相关的趋势,但缺乏统计学意义。
近年来,尽管FCM在MDS诊断及预后中的地位得到逐步认可[12],并已在NCCN指南中被推荐使用,但目前尚无研究明确FCM作为MDS患者移植后MRD监测指标的预测价值。本研究结果初次证实应用8色FCM结合MDS特有的抗体组合监测MRD对MDS移植后的复发有较好的敏感性和特异性,比单独WT1预测复发更有意义,这与在AML中的结果有所不同,提示这种MDS抗体组合监测MDS患者MRD的有效性。Yoon等[13]对82例接受allo-HSCT的MDS患者进行回顾性分析,显示移植后1个月WT1水平升高对预测复发具有重要意义。但这项研究中约60%的患者是减低预处理,而本研究所有患者均为清髓性预处理。移植后早期的WT1水平不仅反映了MDS的克隆数量,也在一定程度上反映了MDS克隆对化疗药物的敏感性,因此应与预处理强度密切相关。这可能是本研究中移植后WT1水平与复发未显示出统计学相关性的原因之一。另一种可能是由于本研究中复发病例相对较少,可能影响到移植后WT1预测复发的敏感性和特异性。
本中心以往研究证实移植后WT1和FCM形成的组合诊断指标MRDco预测急性白血病患者移植后复发有较好的敏感性且不降低特异性[4]。但该研究未包括因达到MRDco阳性而实施有效干预的患者。而本研究中18例达到MRDco阳性的患者接受了不同类型的干预,干预后仅有27.8%的患者复发,明显低于未接受化疗+DLI干预人群的复发率[5],这可能是导致本研究中MRDco预测复发的特异性略低于移植后FCM的主要原因。此外,在未接收任何干预的9例患者中,7例仅为连续两次WT1低水平阳性,均未复发,而同时满足WT1和FCM阳性的2例患者最终均血液学复发,也在一定程度上提示移植后FCM是预测MDS复发更为准确的MRD指标。
本研究结果还显示移植前MDS患者的WT1水平及FCM水平与移植后复发无相关性,与移植后WT1和FCM的阳性率也无明显相关性。这可能与本研究中患者均接受的是强度较大的清髓预处理有关。Festuccia等[14]的研究结果表明移植前对FCM及细胞遗传学检出的微小可识别疾病(minimal identifiable disease, MID)阳性人群进行减低强度预处理后,导致死亡的主要原因为疾病复发,他们认为高强度预处理可以克服MID对移植后复发的影响。
综上所述,本研究对WT1和FCM监测MDS独立人群移植后MRD的临床意义进行了分析。结果提示FCM和基于WT1/FCM的MRDco可作为MDS患者MRD监测的有效指标,基于MRDco标准进行复发的干预可降低移植后复发率。



























