
探讨胎龄和日龄对新生儿脑脊液白细胞计数、葡萄糖、蛋白质含量测定值的影响。
收集2013年1月至2015年12月复旦大学附属儿科医院新生儿科和深圳市龙岗中心医院新生儿科住院患儿的脑脊液白细胞计数、葡萄糖、蛋白质含量结果,按照胎龄和生后日龄分组,对比各组患儿脑脊液参数,并分析各检测指标随胎龄和生后日龄的变化。应用STATA 12.0统计软件进行数据分析。
共1 410例新生儿纳入研究,腰椎穿刺前使用抗生素1 208例(85.7%);早产儿516例(36.6%)。早产儿与足月儿脑脊液白细胞计数差异无统计学意义(P>0.05),上限值均为12.5×106/L;早产儿脑脊液葡萄糖水平低于足月儿(下限值:早产儿1.6 mmol/L,足月儿1.8 mmol/L),脑脊液蛋白质含量高于足月儿(上限值:早产儿226.6 mg/dl,足月儿140.3 mg/dl)。早产儿脑脊液白细胞计数随生后日龄增加而下降(回归系数-0.030,P=0.035);足月儿脑脊液蛋白质含量随生后日龄增加而下降(回归系数-1.254,P<0.001),脑脊液葡萄糖水平随生后日龄增加下降不明显(回归系数-0.009,P=0.012)。
新生儿脑脊液白细胞计数不受胎龄和日龄影响;脑脊液葡萄糖水平早产儿较足月儿低;脑脊液蛋白质含量随胎龄及生后日龄增加而下降。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腰椎穿刺(腰穿)留取脑脊液是诊断中枢神经系统感染最重要的检查方法。脑脊液检查项目包括外观、培养与涂片检菌、病毒分离、聚合酶链反应(polymerase chain reaction,PCR)检测病原、白细胞计数、蛋白质、葡萄糖、乳酸含量等,其中病原检测阳性率低[1],临床医生更多地依赖脑脊液白细胞计数、蛋白质、葡萄糖含量等参数进行综合分析判断是否存在中枢神经系统感染[2]。新生儿细菌性脑膜炎发病率不高,但致死率及神经系统致残率极高,需要早期诊断、及时治疗,以降低不良结局的发生[3,4,5,6]。而新生儿细菌性脑膜炎临床表现多不典型,脑脊液培养阳性率低,因此脑脊液参数的解读对诊断极为重要[7]。脑脊液参数受胎龄、日龄、体重、延迟分析、腰穿损伤等因素影响,正确解读脑脊液检查结果必须考虑其影响因素[8,9,10]。国外对新生儿脑脊液参数参考值的研究不断更新,但是由于样本量、纳入人群不同,以及腰穿损伤和脑膜炎诊断标准不同,造成标准不统一,胎龄和日龄对脑脊液影响的研究结果存在差异[11]。国内尚无新生儿脑脊液参数影响因素的研究。本研究旨在了解不同胎龄、日龄对新生儿脑脊液参数参考值的影响,为新生儿细菌性脑膜炎的诊断提供帮助。
选取2013年1月至2015年12月复旦大学附属儿科医院和深圳市龙岗中心医院新生儿科收治患儿中,行腰穿但排除中枢神经系统细菌、病毒、真菌、梅毒等感染者。符合以下条件之一者行腰穿:(1)有中枢神经系统感染症状,如嗜睡、易激惹、惊厥、前囟膨隆、肌张力改变;(2)血培养阳性;(3)2次以上发热,且均超过38℃;(4)发热且C反应蛋白>20 mg/L。若同一患儿多次腰穿仅以第一次腰穿结果为准。腰穿所得脑脊液标本于30 min内送检,若不能及时检测需置于4 ℃冰箱保存,并于24 h内检测。腰穿需患儿家属签署知情同意书。
(1)足月儿(早产儿校正胎龄40周后)日龄>28 d;(2)脑脊液培养阳性或情况不明;(3)脑脊液病毒DNA或RNA检测阳性;(4)低血糖或高血糖;(5)腰穿损伤(脑脊液红细胞计数>1 000×106/L)[12];(6)遗传代谢性疾病;(7)近期行颅脑手术、先天脑发育异常、重度颅内出血。
本研究为回顾性分析,通过查阅病例收集患儿资料。
(1)根据出生胎龄分为早产儿组(胎龄<37周)和足月儿组(37~42周),以及<28周、28~29周、30~31周、32~33周、34~35周、36~37周、≥38周组;(2)根据生后日龄分为≤7 d组和>7 d组。
脑脊液白细胞计数、葡萄糖和蛋白质含量。
(1)细菌性脑膜炎诊断标准[13]:有感染的临床表现,并且至少符合以下指标中的一项:①脑脊液培养有病原菌生长,脑脊液涂片找到G+菌和(或)G-菌;②脑脊液白细胞计数>20×106/L,多核细胞>0.6,蛋白>170 mg/dl,糖浓度<2.2 mmol/L。(2)真菌性脑膜炎诊断标准[14]:脑脊液发现真菌感染的微生物学证据;或同时具备以下3条:①至少具有1项危险(宿主)因素,②具有可能感染部位的1项主要临床特征(有中枢神经系统感染的特殊影像学改变证据)或2项次要临床特征(有中枢神经系统感染的相应症状、体征及支持感染的实验室证据,如脑脊液常规或生化检查),③血培养发现真菌感染的微生物学证据。
应用STATA 12.0统计软件进行数据分析。偏态分布的计量资料以中位数(M)和四分位间距(interquartile range,IQR)表示集中与离散程度,以IQR上限+1.5 IQR或第95百分位数表示参考值范围上限,以IQR下限-1.5 IQR或第5百分位数表示参考值范围下限,组间比较采用Wilcoxon秩和检验;计数资料以例(%)表示,组间比较采用χ2检验;采用线性回归分析各检测指标随生后日龄的变化。P<0.05为差异有统计学意义。
研究期间复旦大学附属儿科医院新生儿科和深圳市龙岗中心医院新生儿科行腰穿检查的新生儿共2 278例,其中腰穿损伤453例,损伤率19.9%。诊断细菌性脑膜炎306例,其他中枢神经系统感染66例,先天性脑积水12例,脑脊膜膨出1例,腰穿时低血糖或高血糖12例(其中3例合并中枢神经系统感染),遗传代谢病5例,日龄(校正胎龄40周后)>28 d及信息不全18例(其中2例合并中枢神经系统感染)。根据排除标准最终纳入研究1 410例。其中早产儿514例,足月儿896例,腰穿前使用抗生素1 208例,使用率85.7%。见表1。
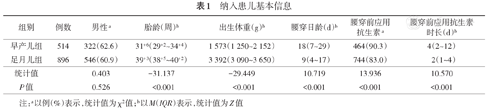
纳入患儿基本信息
纳入患儿基本信息
| 组别 | 例数 | 男性a | 胎龄(周)b | 出生体重(g)b | 腰穿日龄(d)b | 腰穿前应用抗生素a | 腰穿前应用抗生素时长(d)b |
|---|---|---|---|---|---|---|---|
| 早产儿组 | 514 | 322(62.6) | 31+6(29+2~34+4) | 1 573(1 250~2 152) | 18(7~29) | 464(90.3) | 4(2~12) |
| 足月儿组 | 896 | 546(60.9) | 39+3(38+5~40+2) | 3 392(3 090~3 650) | 9(4~17) | 744(83.0) | 2(1~4) |
| 统计值 | 0.403 | -31.137 | -29.449 | 10.719 | 13.936 | 10.570 | |
| P值 | 0.526 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
注:a以例(%)表示,统计值为χ2值;b以M(IQR)表示,统计值为Z值
1 410例新生儿脑脊液白细胞计数、葡萄糖、蛋白质含量,见表2。
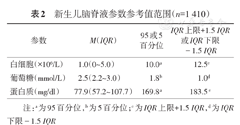
新生儿脑脊液参数参考值范围(n=1 410)
新生儿脑脊液参数参考值范围(n=1 410)
| 参数 | M(IQR) | 95或5百分位 | IQR上限+1.5 IQR或IQR下限-1.5 IQR |
|---|---|---|---|
| 白细胞(×106/L) | 1.0(0~5.0) | 10.0a | 12.5c |
| 葡萄糖(mmol/L) | 2.5(2.2~3.0) | 1.8b | 1.0d |
| 蛋白质(mg/dl) | 77.9(57.2~107.7) | 169.8a | 183.5 c |
注:a为95百分位,b为5百分位;c为IQR上限+1.5 IQR,d为IQR下限-1.5 IQR
早产儿与足月儿脑脊液白细胞计数比较,差异无统计学意义(P>0.05);早产儿脑脊液葡萄糖水平中位数低于足月儿,脑脊液蛋白质含量中位数高于足月儿,差异均有统计学意义(P<0.01)。见表3。
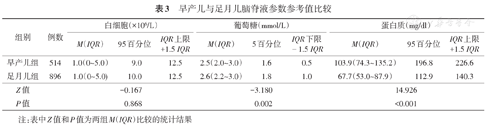
早产儿与足月儿脑脊液参数参考值比较
早产儿与足月儿脑脊液参数参考值比较
| 组别 | 例数 | 白细胞(×106/L) | 葡萄糖(mmol/L) | 蛋白质(mg/dl) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M(IQR) | 95百分位 | IQR上限+1.5 IQR | M(IQR) | 5百分位 | IQR下限-1.5 IQR | M(IQR) | 95百分位 | IQR上限+1.5 IQR | ||
| 早产儿组 | 514 | 1.0(0~5.0) | 9.0 | 12.5 | 2.5(2.0~3.0) | 1.6 | 0.5 | 103.9(74.3~135.2) | 196.8 | 226.6 |
| 足月儿组 | 896 | 1.0(0~5.0) | 10.0 | 12.5 | 2.6(2.2~3.0) | 1.8 | 1.0 | 67.7(53.0~87.9) | 112.9 | 140.3 |
| Z值 | -0.167 | -3.180 | 14.926 | |||||||
| P值 | 0.868 | 0.002 | <0.001 | |||||||
注:表中Z值和P值为两组M(IQR)比较的统计结果
各胎龄组脑脊液白细胞计数差异无统计学意义(P=0.621);不同胎龄新生儿脑脊液葡萄糖水平差异有统计学意义(P=0.016);不同胎龄新生儿脑脊液蛋白质含量差异有统计学意义(P<0.01),胎龄<28周脑脊液蛋白质含量最高,胎龄≥38周脑脊液蛋白质含量最低。见表4。
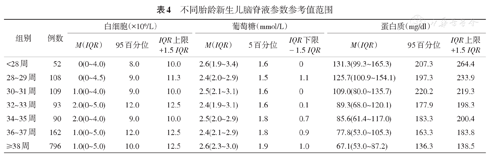
不同胎龄新生儿脑脊液参数参考值范围
不同胎龄新生儿脑脊液参数参考值范围
| 组别 | 例数 | 白细胞(×106/L) | 葡萄糖(mmol/L) | 蛋白质(mg/dl) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M(IQR) | 95百分位 | IQR上限+1.5 IQR | M(IQR) | 5百分位 | IQR下限-1.5 IQR | M(IQR) | 95百分位 | IQR上限+1.5 IQR | ||
| <28周 | 52 | 0(0~4.0) | 8.0 | 10.0 | 2.6(1.9~3.4) | 1.6 | 0 | 131.3(99.3~165.3) | 207.3 | 264.4 |
| 28~29周 | 108 | 0(0~4.5) | 9.0 | 11.3 | 2.4(2.0~2.9) | 1.5 | 1.1 | 125.7(100.9~154.1) | 197.3 | 233.9 |
| 30~31周 | 109 | 1.0(0~4.0) | 9.0 | 10.0 | 2.5(2.1~3.1) | 1.6 | 0 | 109.0(80.0~135.7) | 220.2 | 219.3 |
| 32~33周 | 93 | 2.0(0~5.0) | 12.0 | 12.5 | 2.4(1.9~3.1) | 1.6 | 0.1 | 89.3(68.0~120.1) | 177.9 | 198.3 |
| 34~35周 | 90 | 2.0(0~4.0) | 9.0 | 10.0 | 2.5(2.0~2.9) | 1.8 | 0.7 | 85.6(61.4~117.0) | 183.3 | 200.4 |
| 36~37周 | 162 | 1.0(0~5.0) | 12.0 | 12.5 | 2.4(2.1~2.9) | 1.8 | 0.9 | 77.8(53.0~105.3) | 163.3 | 183.8 |
| ≥38周 | 796 | 1.0(0~5.0) | 10.0 | 12.5 | 2.6(2.3~3.0) | 1.9 | 1.0 | 67.1(53.0~87.2) | 136.3 | 138.5 |
线性回归分析发现,早产儿和足月儿脑脊液白细胞计数、葡萄糖含量与胎龄均不存在线性回归关系;早产儿脑脊液蛋白质含量随胎龄增加呈下降趋势,胎龄每增加1周,脑脊液蛋白质含量下降5.1 mg/dl(回归系数-0.726,P<0.001)。
生后日龄>7 d与生后日龄≤7 d相比,脑脊液白细胞计数、葡萄糖、蛋白质含量均降低,差异有统计学意义(P<0.05),见表5。
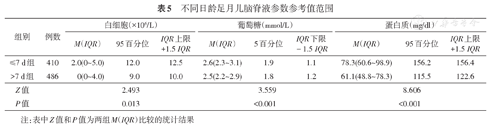
不同日龄足月儿脑脊液参数参考值范围
不同日龄足月儿脑脊液参数参考值范围
| 组别 | 例数 | 白细胞(×106/L) | 葡萄糖(mmol/L) | 蛋白质(mg/dl) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M(IQR) | 95百分位 | IQR上限+1.5 IQR | M(IQR) | 5百分位 | IQR下限-1.5 IQR | M(IQR) | 95百分位 | IQR上限+1.5 IQR | ||
| ≤7 d组 | 410 | 2.0(0~5.0) | 12.0 | 12.5 | 2.6(2.3~3.1) | 1.9 | 1.1 | 78.3(60.6~98.9) | 156.2 | 156.4 |
| >7 d组 | 486 | 0(0~4.0) | 9.0 | 10.0 | 2.5(2.2~2.9) | 1.8 | 1.2 | 61.1(48.8~78.3) | 115.5 | 122.6 |
| Z值 | 2.493 | 3.559 | 8.606 | |||||||
| P值 | 0.013 | <0.001 | <0.001 | |||||||
注:表中Z值和P值为两组M(IQR)比较的统计结果
生后日龄>7 d天与生后日龄≤7 d相比,脑脊液白细胞计数、葡萄糖、蛋白质含量均降低,差异有统计学意义(P<0.05),见表6。
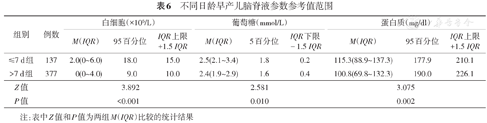
不同日龄早产儿脑脊液参数参考值范围
不同日龄早产儿脑脊液参数参考值范围
| 组别 | 例数 | 白细胞(×106/L) | 葡萄糖(mmol/L) | 蛋白质(mg/dl) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| M(IQR) | 95百分位 | IQR上限+1.5 IQR | M(IQR) | 5百分位 | IQR下限-1.5 IQR | M(IQR) | 95百分位 | IQR上限+1.5 IQR | ||
| ≤7 d组 | 137 | 2.0(0~6.0) | 18.0 | 15.0 | 2.5(2.1~3.4) | 1.8 | 0.2 | 115.3(88.9~137.3) | 177.9 | 210.1 |
| >7 d组 | 377 | 0(0~4.0) | 9.0 | 10.0 | 2.4(1.9~2.9) | 1.6 | 0.4 | 100.8(69.8~132.3) | 190.0 | 226.1 |
| Z值 | 3.892 | 2.581 | 3.075 | |||||||
| P值 | <0.001 | 0.010 | 0.002 | |||||||
注:表中Z值和P值为两组M(IQR)比较的统计结果
线性回归分析发现,早产儿脑脊液白细胞计数随生后日龄增加呈下降趋势,下降速度为每周0.21×106/L(回归系数-0.030,P=0.035),足月儿脑脊液白细胞计数未见明显变化。早产儿脑脊液葡萄糖含量不随生后日龄而改变,足月儿脑脊液葡萄糖含量随生后日龄增加有下降趋势,但回归系数仅为-0.009(P=0.012),即日龄每增加1 d,脑脊液葡萄糖含量下降0.009 mmol/L,下降程度不明显。早产儿脑脊液蛋白质含量随生后日龄无明显变化;足月儿脑脊液蛋白质含量随生后日龄增加呈明显下降趋势,下降速度为每周8.78 mg/dl(回归系数-1.254,P<0.001)。
新生儿脑脊液参数参考值在新生儿颅内感染尤其是细菌感染的诊断中有重要意义,而胎龄和日龄对脑脊液参数的影响关系到诊断的准确性[15]。国外既往研究中给出了小婴儿及新生儿的脑脊液参考值范围,但一直存在争议[11]。早期的研究[16,17,18]样本量多较小,有些未明确排除腰穿损伤及病毒性脑膜炎患儿;近期的研究[19,20]虽然明确定义了排除标准,样本量也较前增大,但对于不同胎龄、日龄新生儿的脑脊液参数未加以分层研究,尤其缺乏早产儿的研究。目前国内尚无新生儿脑脊液参数影响因素的研究,国外既往研究所形成的并不完善的参考值范围是否适用于国内新生儿并不可知。本研究分别研究了不同胎龄及日龄对新生儿脑脊液白细胞、葡萄糖、蛋白质含量的影响,为新生儿细菌性脑膜炎的诊断提供了一定帮助。
早期关于新生儿脑脊液白细胞计数的研究[16,17,21]样本量仅10~155,研究对象为日龄0~90 d的正常小婴儿,所得脑脊液白细胞计数上限值为(15~36)×106/L,由于包含了2~3月龄的小婴儿、样本量小,不能作为新生儿脑脊液白细胞计数参考值。Martín-Ancel等[22]也对正常新生儿脑脊液白细胞计数进行分析,中位数为1×106/L,范围(0~5)×106/L,接近于成人正常值,明显低于有任何症状的新生儿[中位数7×106/L,范围(0~30)×106/L]。脑脊液参数参考值的确立是为了从可疑颅内感染的患儿中鉴别出真正颅内感染的患儿,而并非是从完全健康者中找出颅内感染患儿[8,9]。因此,本研究对中枢感染、颅内出血、脑发育异常、代谢性脑病等影响脑脊液参数的因素予以排除后,获得的结果可作为新生儿脑脊液参考值范围。
Srinivasan等[8]排除腰穿损伤、菌血症、脑膜炎、惊厥、脑室-腹腔分流术的患儿后,检测生后7 d内新生儿的脑脊液白细胞计数,中位数为3×106/L,范围(1~6)×106/L,上限值14×106/L,早产儿与足月儿之间并无差别。本研究中早产儿与足月儿脑脊液白细胞计数差异也无统计学意义,中位数均为1×106/L,上限值均为12.5×106/L;生后日龄≤7 d组白细胞计数高于>7 d组;早产儿脑脊液白细胞计数随生后日龄增加有下降趋势,这与多项研究结论相似[12,19,20]。本研究结果还显示,无论早产儿还是足月儿,脑脊液白细胞计数均不随胎龄而改变,这与Mhanna等[23]的研究结果一致。
新生儿脑脊液葡萄糖水平受血糖浓度影响而有较大波动性,颅内出血或腰穿损伤均可使脑脊液葡萄糖水平降低[2],中枢神经系统细菌感染时由于脑代谢增加、脑脊液中白细胞和细菌的糖酵解增加常使脑脊液葡萄糖含量下降。早期部分研究[16,24]并未考虑血糖、颅内出血或腰穿损伤、延迟分析等的影响,所得出的脑脊液葡萄糖水平参考值并不可靠[25]。脑脊液红细胞数达500×106/L即有可能使脑脊液葡萄糖水平明显降低[2]。Leen等[26]严格排除了影响脑脊液葡萄糖水平的因素,得出新生儿脑脊液葡萄糖水平下限值为1.9 mmol/L;本研究中足月儿脑脊液葡萄糖水平中位数为2.6 mmol/L,下限值以第5百分位数表示时为1.8 mmol/L;早产儿脑脊液葡萄糖水平较足月儿低,这可能与早产儿易发生低血糖、血糖水平低有关[26]。但早产儿及足月儿脑脊液葡萄糖水平并不随胎龄而有明显改变,Mhanna等[23]的研究结果亦与此结果相符。脑脊液葡萄糖水平随生后日龄变化不明显,这与既往研究[12,23]结果相同。
新生儿由于血脑屏障不完善,脑脊液蛋白质水平高于成人和儿童[27]。Bauer等[28]和Wallenstein、Wusthoff[29]的报道显示,有腰穿指征的相对正常者和无腰穿指征者所测得的脑脊液蛋白质含量差异无统计学意义,新生儿脑脊液蛋白质含量参考值的确立多建立于排除颅内感染、颅内出血、代谢性脑病的有腰穿指征的新生儿群体。早期研究得出的脑脊液蛋白质含量上限为54~180 mg/dl,其中包括了病毒性脑膜炎、腰穿损伤或颅内出血的患儿,结果并不可靠。近期研究表明[30,31],脑脊液红细胞每增加1 000×106/L,脑脊液蛋白质含量增加1.1~1.9 mg/dl。Garges等[1]严格排除了影响脑脊液蛋白质水平的因素,得出脑脊液蛋白质含量上限为142 mg/dl,但包含了日龄0~150 d的小婴儿,且并未考虑胎龄和日龄对脑脊液蛋白质含量的影响。Shah等[32]研究不同日龄新生儿脑脊液蛋白质含量参考值,结果显示,0~14 d中位数为78 mg/dl,上限132 mg/dl;15~28 d中位数为65 mg/dl,上限100 mg/dl。本研究结果也显示日龄≤7 d组脑脊液蛋白质含量高于日龄>7 d组,且足月儿脑脊液蛋白质含量随生后日龄增加呈下降趋势,这与Shah等[32]和Srinivasan等[8]的结论一致。既往研究显示[2,8]早产儿脑脊液蛋白质含量高于足月儿,本研究也得出相同结果,而且早产儿脑脊液蛋白质含量随胎龄增长呈下降趋势。其原因可能是随着胎龄、日龄的增长,新生儿血脑屏障功能逐渐增强,渗透性下降[8]。
本研究与既往研究相比,样本量大,且包含514例早产儿;明确排除了脑脊液红细胞>1 000×106/L者,消除了血性脑脊液对脑脊液参数的影响;充分分析了不同胎龄、日龄对脑脊液参数的影响;对偏态资料采用中位数、四分位间距、百分位数表示,更加准确。但本研究也存在一定局限性,由于抗生素使用率高,可能造成部分仅有脑脊液参数改变的中枢感染患儿因应用抗生素后脑脊液参数迅速恢复正常,而被纳入研究中;对脑脊液红细胞计数>1 000×106/L者排除后,不能判断基质-脑室内出血、分娩时硬膜下出血、腰穿损伤等对脑脊液参数的影响,今后还需要更多相关研究,为新生儿细菌性脑膜炎的诊断提供帮助。
所有作者均声明不存在利益冲突



























