
系统评价二甲双胍对乳腺癌患者预后的影响。
计算机检索PubMed、EMbase、Cochrane Library、ClinicalTrials、ScineceDirect、中国生物医学文献数据库、中国知网、万方数据库、维普数据库2018年4月18日前发表的关于二甲双胍对乳腺癌患者预后影响的文献。根据纳入及排除标准,由2名研究者独立筛选文献后提取资料并评价质量,使用Review Manager 5.1软件进行统计分析。
共纳入2篇随机对照研究和17篇队列研究,合计8 929例患者。分析结果显示,与对照组相比,二甲双胍组病理完全缓解(pCR)率升高(RR=2.97,95% CI 1.80~4.90,P<0.01);肿瘤特异生存(CSS)时间延长(HR=0.70,95% CI 0.57~0.87,P=0.001);根据研究地域不同对总生存(OS)时间进行亚组分析,结果均显示二甲双胍组OS时间延长(欧美研究亚组:HR=0.75,95% CI 0.65~0.86,P<0.01;亚洲研究亚组:HR=0.48,95% CI 0.37~0.61,P<0.01)。
二甲双胍对乳腺癌患者预后有积极作用,可提高患者的pCR率,延长患者的CSS和OS时间。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在我国,乳腺癌在城乡女性癌症发病率中排在首位,且呈上升趋势[1]。目前乳腺癌的治疗已有较大进展,但仍有约30%的患者会出现复发转移,影响其预后[2]。二甲双胍是广泛用于2型糖尿病的口服降糖药,可增加对胰岛素的敏感性,有效控制血糖。近年来,许多体内和体外研究显示二甲双胍具有直接和间接的抗肿瘤作用,特别是对于乳腺癌[3,4,5,6],但也有部分研究显示了不同的结果[7,8]。因此二甲双胍在乳腺癌治疗中的作用还存在争议。本研究对关于二甲双胍影响乳腺癌患者预后的研究进行Meta分析,旨在为二甲双胍是否可用于改善乳腺癌患者预后提供理论依据。
计算机检索PubMed、EMbase、Cochrane Library、Clinical Trials、ScineceDirect、中国生物医学文献数据库、中国知网、万方数据库、维普数据库,检索时间限定为建库至2018年4月18日。英文数据库使用"Title/Abstract"检索,检索词包括"metformin""breast cancer""breast tumor",检索词之间用"and"和(或)"or"连接。中文数据库用"主题词"或"题名或关键词"检索,检索词包括"二甲双胍""乳腺癌",之间用"and"连接。
纳入标准:(1)已公开发表的随机对照研究和队列研究;(2)研究对象为临床上已确诊的乳腺癌患者;(3)治疗组为服用二甲双胍的乳腺癌患者,对照组为未服用二甲双胍的乳腺癌患者;(4)主要分析指标为病理完全缓解(pCR)率、肿瘤特异生存(CSS)时间和总生存(OS)时间;(5)文献提供了CSS和OS的危险比(HR)及95%置信区间(95% CI),或有充足数据可计算出HR及95% CI。
排除标准:(1)原始文献无完整数据;(2)原始文献为临床前研究;(3)无本研究关注的结局指标;(4)重复发表的文献。
由2名研究者根据纳入及排除标准相互独立地对文献进行纳入和排除,有歧义时通过讨论或由第3名研究者协助解决。提取的数据内容包括:作者及发表年、研究类型、患者疾病类型、研究样本量、随访时间、结局指标等。非随机对照研究运用Newcastle-Ottawa Scale(NOS)评价工具进行评分;随机对照研究运用Jadad评价工具进行评分,仍由2名研究者相互独立地对所纳入的研究进行评分,当评分意见不一致时通过讨论或由第3名研究者协助解决。
使用Review Manager 5.1软件进行统计分析。计数资料用相对危险度(RR)为效应指标,生存资料用HR为效应指标,各效应量均给出其95% CI。对所纳入的研究采用I2检验进行异质性检验,如果各研究间存在异质性(I2>50%),首先分析异质性来源,排除异质性来源的研究或进行亚组分析后,若异质性消除则采用固定效应模型进行分析,若仍存在异质性则采用随机效应模型进行分析;如果各研究间不存在异质性(I2≤50%),则使用固定效应模型进行分析。
共检索出文献1 722篇(PubMed 405篇、EMbase 495篇、Cochrane Library 67篇、ClinicalTrials 0篇、ScineceDirect 84篇、中国生物医学文献数据库70篇、中国知网107篇、万方数据库442篇、维普数据库52篇),排除重复文献后剩余文献1 049篇,通过阅读题目和摘要排除不相关文献1 000篇,阅读全文将无可提取数据的文献逐一排除后最终纳入文献19篇[3,4,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23]。
19篇文献的发表时间为2009年至2018年,其中2篇[9,10]为随机对照研究,其余17篇[3,4,7,8,11,12,13,14,15,16,17,18,19,20,21,22,23]均为队列研究。共纳入8 929例患者,治疗组4 133例,对照组4 796例。纳入文献的基本特征见表1。对所纳入研究进行质量评价,其中2篇随机对照研究使用Jadad评价工具进行评分,均为3分;其他17篇队列研究使用NOS评价工具进行评分,评分为6~8分,具体结果见表1。
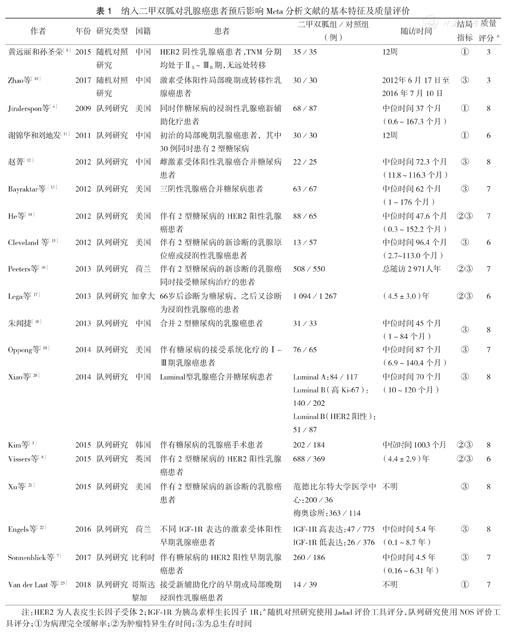
纳入二甲双胍对乳腺癌患者预后影响Meta分析文献的基本特征及质量评价
纳入二甲双胍对乳腺癌患者预后影响Meta分析文献的基本特征及质量评价
| 作者 | 年份 | 研究类型 | 国籍 | 患者 | 二甲双胍组/对照组(例) | 随访时间 | 结局指标 | 质量评分a |
|---|---|---|---|---|---|---|---|---|
| 黄远丽和孙圣荣[9] | 2015 | 随机对照研究 | 中国 | HER2阴性乳腺癌患者,TNM分期均处于ⅡB~ⅢB期,无远处转移 | 35/35 | 12周 | ③ | 3 |
| Zhao等[10] | 2017 | 随机对照研究 | 中国 | 激素受体阳性局部晚期或转移性乳腺癌患者 | 30/30 | 2012年6月17日至2016年7月10日 | ③ | 3 |
| Jiralerspon等[4] | 2009 | 队列研究 | 美国 | 同时伴糖尿病的浸润性乳腺癌新辅助化疗患者 | 68/87 | 中位时间37个月(0.6~167.3个月) | ③ | 8 |
| 谢锦华和刘地发[11] | 2011 | 队列研究 | 中国 | 初治的局部晚期乳腺癌患者,其中30例同时患有2型糖尿病 | 30/30 | 12周 | ③ | 6 |
| 赵菁[12] | 2012 | 队列研究 | 中国 | 雌激素受体阳性乳腺癌合并糖尿病患者 | 22/25 | 中位时间72.3个月(11.8~116.3个月) | ③ | 8 |
| Bayraktar等[13] | 2012 | 队列研究 | 美国 | 三阴性乳腺癌合并糖尿病患者 | 63/67 | 中位时间62个月(1~176个月) | ③ | 7 |
| He等[14] | 2012 | 队列研究 | 美国 | 伴有2型糖尿病的HER2阳性乳腺癌患者 | 88/65 | 中位时间47.6个月(0.3~152.2个月) | ③③ | 7 |
| Cleveland等[15] | 2012 | 队列研究 | 美国 | 伴有2型糖尿病的新诊断的乳腺原位癌或浸润性乳腺癌患者 | 13/57 | 中位时间96.4个月(2.7~113.0个月) | ③ | 6 |
| Peeters等[16] | 2013 | 队列研究 | 荷兰 | 伴有2型糖尿病的新诊断的乳腺癌同时接受糖尿病治疗的患者 | 508/550 | 总随访2 971人年 | ③③ | 7 |
| Lega等[17] | 2013 | 队列研究 | 加拿大 | 66岁后诊断为糖尿病,之后又诊断为浸润性乳腺癌的患者 | 1 094/1 267 | (4.5±3.0)年 | ③③ | 6 |
| 朱闻捷[18] | 2013 | 队列研究 | 中国 | 合并2型糖尿病的乳腺癌患者 | 31/33 | 中位时间45个月(1~84个月) | ③ | 8 |
| Oppong等[19] | 2014 | 队列研究 | 美国 | 伴有糖尿病的接受系统化疗的Ⅰ~Ⅲ期乳腺癌患者 | 76/65 | 中位时间87个月(6.9~140.4个月) | ③ | 7 |
| Xiao等[20] | 2014 | 队列研究 | 中国 | Luminal型乳腺癌合并糖尿病患者 | Luminal A:84/117 | 中位时间70个月(10~120个月) | ③ | 8 |
| Luminal B(高Ki⁃67):140/202 | ||||||||
| Luminal B(HER2阳性):51/87 | ||||||||
| Kim等[3] | 2015 | 队列研究 | 韩国 | 伴有糖尿病的乳腺癌手术患者 | 202/184 | 中位时间100.3个月 | ③③ | 8 |
| Vissers等[8] | 2015 | 队列研究 | 英国 | 伴有2型糖尿病的HER2阳性乳腺癌患者 | 688/369 | (4.4±2.9)年 | ③③ | 6 |
| Xu等[21] | 2015 | 队列研究 | 美国 | 伴有2型糖尿病的新诊断的乳腺癌患者 | 范德比尔特大学医学中心:200/36 | 不明 | ③ | 8 |
| 梅奥诊所:363/114 | ||||||||
| Engels等[22] | 2016 | 队列研究 | 荷兰 | 不同IGF⁃1R表达的激素受体阳性早期乳腺癌患者 | IGF⁃1R高表达:47/775 | 中位时间5.4年(0.1~8.7年) | ③ | 8 |
| IGF⁃1R低表达:26/376 | ||||||||
| Sonnenblick等[7] | 2017 | 队列研究 | 比利时 | 伴有糖尿病的HER2阳性早期乳腺癌患者 | 260/186 | 中位时间4.5年(0.16~6.31年) | ③ | 7 |
| Van der Laat等[23] | 2018 | 队列研究 | 哥斯达黎加 | 接受新辅助化疗的早期或局部晚期浸润性乳腺癌患者 | 14/39 | 不明 | ③ | 7 |
注:HER2为人表皮生长因子受体2;IGF-1R为胰岛素样生长因子1R;a随机对照研究使用Jadad评价工具评分,队列研究使用NOS评价工具评分;①为病理完全缓解率;②为肿瘤特异生存时间;③为总生存时间
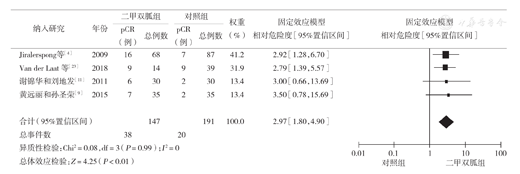
该分析共纳入4项研究[4,5,11,23],分析显示各研究间异质性较低(I2=0),故采用固定效应模型进行分析,结果显示二甲双胍组pCR率高于对照组,两组差异有统计学意义(RR=2.97,95% CI 1.80~4.90,P<0.01)(图1)。

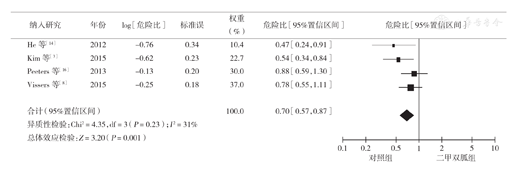
该分析共纳入5项研究[3,8,14,16,17],分析显示各研究间存在异质性(I2=54%),经敏感性分析发现剔除Lega等[17]的研究后,异质性明显降低(I2=31%)。经阅读文献发现该研究所纳入人群与其他研究不同,仅限于年龄>66岁的人群,这可能是异质性的主要来源。因此去掉该研究后用固定效应模型重新进行分析,结果显示二甲双胍组CSS时间长于对照组,两组差异有统计学意义(HR=0.70,95% CI 0.57~0.87,P=0.001)(图2)。

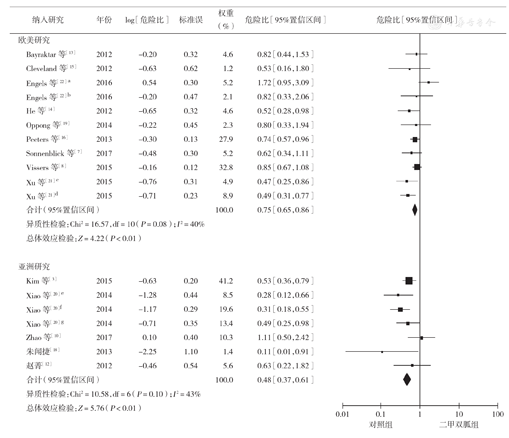
该分析共纳入15项研究[3,7,8,10,12,13,14,15,16,17,18,19,20,21,22],分析显示各研究间存在异质性(I2=72%),同样剔除Lega等[17]的研究后,异质性明显降低(I2=54%),但仍相对较大,因此再根据研究的地域不同,分为欧美研究和亚洲研究进行亚组分析。分组后两个亚组的异质性均进一步降低,分别为欧美研究组I2=40%和亚洲研究组I2=43%。两亚组均使用固定效应模型进行分析,结果显示两亚组中二甲双胍组OS时间均长于对照组,差异均有统计学意义(欧美研究亚组:HR=0.75,95% CI 0.65~0.86,P<0.01;亚洲研究亚组:HR=0.48,95% CI0.37~0.61,P<0.01)(图3)。

注:a胰岛素样生长因子1R高表达;b胰岛素样生长因子1R低表达;c范德比尔特大学医学中心;d梅奥诊所;e Luminal A;f Luminal B(高Ki-67);g Luminal B(人表皮生长因子受体2阳性)
根据OS分析结果绘制倒漏斗图,结果显示各项研究左右分布基本对称,提示发表偏倚相对较低。
本Meta分析所纳入的研究人群既包含乳腺癌合并糖尿病患者,也包含单纯乳腺癌患者[9,10]。结果显示乳腺癌患者在常规放化疗或内分泌治疗的同时服用二甲双胍可以明显延长患者的CSS和OS;对于新辅助化疗的患者,可以改善患者pCR率,提示二甲双胍对于改善乳腺癌患者的预后有益,可能有潜在的抗肿瘤作用。
使用二甲双胍的乳腺癌患者显示出更长的生存期,可能与对照组中部分患者血糖控制不佳导致更多的并发症有关。另外,目前已有许多证据显示,胰岛素、胰岛素抵抗和糖尿病对乳腺癌的预后均有不利影响[24]。葡萄糖是肿瘤细胞的唯一能量来源,长期的高血糖环境可促进肿瘤生长;胰岛素及其类似物也可通过激活胰岛素样生长因子(IGF)来促进肿瘤生长[14]。二甲双胍可以降低血糖和胰岛素水平,增加胰岛素敏感性,从而可能减少胰岛素促进肿瘤生长的作用,可能对多种肿瘤均有抑制作用[25]。另外,二甲双胍可上调单磷酸腺苷活化蛋白激酶的活性,从而影响肿瘤细胞的能量代谢,使其发生紊乱进而死亡[26];二甲双胍可通过抑制PI3K-Akt和mTOR通路[3],抑制肿瘤细胞的增殖;同时该信号通路与雌激素受体和人表皮生长因子受体2(HER2)也有联系,因此对于激素受体阳性和HER2阳性的患者,二甲双胍可能会显示出更明显的抗肿瘤作用[27]。
本Meta分析结果为临床用药提供了一定依据。目前现有的研究证据显示二甲双胍对于乳腺癌患者的预后有益,但由于其说明书适应证的限制,将该药用于乳腺癌非糖尿病患者还有一定的限制,需要更多临床研究进一步证实其有效性。但是对于同时伴有糖尿病的乳腺癌患者,建议首选二甲双胍作为一线降糖药物。另外由于胰岛素及其类似物潜在的促肿瘤生长作用,对于乳腺癌伴2型糖尿病患者,是否应尽量避免首选胰岛素类药物控制血糖是值得思考的问题。
本研究尚存在一定的局限性,首先是所纳入的研究中高质量的随机对照研究较少,其次是所纳入的队列研究中有个别研究基线信息的某些指标存在差异,可能使分析结果发生一定的偏倚,因此,所得结论还需更多高质量、大样本、双盲的随机对照试验加以证实。
综上所述,乳腺癌患者在系统治疗的同时联用二甲双胍可延长CSS和OS时间,可提高新辅助化疗患者的pCR率,改善患者预后,但该结论仍需更多大样本的前瞻性随机对照研究加以验证。
所有作者均声明不存在利益冲突



























