
探讨水飞蓟宾(SB)对葡聚糖硫酸钠(DSS)诱导的结肠炎的作用及其对核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体的调节。
48只8周龄C57BL/6小鼠,随机分为对照组、DSS组和DSS+SB组。对照组小鼠正常饮水,余两组小鼠连续7 d自由饮用2%DSS水溶液诱导结肠炎模型。从造模第1天起,DSS组小鼠予0.5%羧甲基纤维素0.2 ml·只-1·d-1灌胃;DSS+SB组小鼠予水飞蓟宾溶液0.2 ml·只-1·d-1灌胃,比较3组小鼠结肠炎症反应情况、肠道黏膜屏障和NLRP3炎症小体活化情况。
(1)结肠炎症情况:DSS+SB组比DSS组的结肠长度更长[(5.34 ± 0.14)cm比(4.78 ± 0.13)cm,P<0.01],炎症活动指数评分更低(实验第5天,6.73 ± 0.72比8.74 ± 0.45,P = 0.02),肠组织损伤程度更轻。(2)肠道黏膜屏障情况:与DSS组比较,DSS+SB组小鼠血清异硫氰酸荧光素标记的葡聚糖(FITC-D)的浓度明显降低[(2.02 ± 0.22)mg/L比(4.28 ± 0.55)mg/L,P<0.01],紧密连接蛋白claudin-1(0.72 ± 0.15比0.04 ± 0.02,P<0.05)、occludin(0.52 ± 0.04比0.18 ± 0.01,P<0.05)和黏蛋白2(MUC2)(0.36 ± 0.06比0.07 ± 0.03,P<0.05)表达均增高。(3)NLRP3炎症小体活化情况:与DSS组相比较,DSS+SB组结肠F4/80表达减少,IL-1β和IL-6表达降低,NLRP3、凋亡相关点状蛋白(ASC)和半胱氨酸天冬氨酸蛋白酶1(caspase-1)的mRNA及蛋白的表达降低。
水飞蓟宾可抑制NLRP3炎症小体的活化,降低炎性因子的产生,保护肠黏膜屏障功能,对DSS诱导的结肠炎产生保护作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来溃疡性结肠炎(ulcerative colitis,UC)的发病率在全球范围内逐渐上升[1,2]。然而其防治手段有限[3]。水飞蓟宾(silibinin,SB)作为一种植物提取物,具有抗炎抗癌的作用[4],但其对结肠炎的作用及机制尚未阐明。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体可被多种因素激活,使无活性的半胱氨酸天冬氨酸蛋白酶1(cysteine-aspartic acid protease-1,caspase-1)前体活化,促使白细胞介素-1β前体(pro-interleukin-1β,pro-IL-1β)和pro-IL-18等细胞因子前体成熟和释放,在固有免疫应答中起重要作用[5]。本研究以葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的小鼠结肠炎模型为研究对象,探讨SB对DSS诱导的结肠炎的作用及其对NLRP3炎症小体的调节,为开拓防治UC的新方法提供实验依据。
选用8周龄雌性C57BL/6小鼠48只,体质量18 ~ 20 g,由北京动物研究中心提供(动物合格证号:11401300077711)。实验前将48只小鼠适应性喂养1周。小鼠饲养环境为温度20 ~ 23 ℃,湿度40%,光照和黑暗各12 h循环,饲育盒每周更换1次,饮水每周更换1 ~ 2次。饲养过程严格按天津医科大学SPF级实验动物中心操作规程进行。
PowerPacTM Basic电泳仪(美国Bio-Rad公司)、DNA Thermal Cycle 480扩增仪(美国Perkin Elmer Cetus公司)、实时PCR仪(美国ABI公司)、光学显微镜及照相装置(德国Leica公司)。水飞蓟宾纯品(纯度99%,天津天士力集团有限公司,批号:20151106)、葡聚糖硫酸钠(美国MP Biomedicals公司,批号:Q4299)、驴抗山羊IgG H&L(FITC)荧光二抗(英国Abcam公司,批号:ab6881)、Trizol(美国Invitrogen公司,批号:127906)、Fast SYBR Green Master Mix(美国ABI公司,批号:318016)、兔抗小鼠NLRP3多克隆抗体(美国Cell Signaling公司,批号:13158)、兔抗小鼠凋亡相关斑点样蛋白(ASC)多克隆抗体(英国Abcam公司,批号:ab47092)、兔抗小鼠caspase-1抗体(英国Abcam公司,批号:ab108362)及大鼠抗小鼠F4/80单克隆抗体(英国Abcam公司,批号:ab6640)等。
将48只小鼠分为对照组、DSS组和DSS+SB组。其中24只随机分配给3组。由于DSS可能引起小鼠死亡,余下24只随机分配给DSS组和DSS+SB组以保证这两组有足够数量的小鼠。对照组小鼠正常饮水,余2组小鼠连续7 d自由饮用2%DSS水溶液诱导结肠炎模型。从造模第1天起,DSS组小鼠予0.5%羧甲基纤维素0.2 ml·只-1·d-1灌胃;DSS+SB组小鼠予水飞蓟宾溶液0.2 ml·只-1·d-1灌胃,水飞蓟宾的剂量参考预实验结果及既往文献报道[6]。
给药7 d后处死小鼠并分离出完整结肠,测量结肠长度。纵向剖开肠管,留取肠道标本将其剪成均匀小块用以后续实验;其余标本沿纵轴卷起置于10%甲醛中保存,用于HE染色观察肠道炎症反应及免疫荧光染色等实验。
自给药开始,每日称量小鼠体质量,观察生存状态、粪便性状、便血情况及程度,计算DAI评分[7]。
标本经过脱水、透明、浸蜡、包埋、切片及烤片后制作成石蜡切片。将切片脱蜡及水化后,依次进行苏木紫染色、盐酸乙醇分色、淡氨水返蓝和伊红染色,再经过脱水、透明及封片后即可在显微镜下观察并进行组织学评分[8]。
小鼠禁食不禁水处理6 h,FITC-D灌胃。4 h后内眦取血,血样本避光离心,稀释后测浓度,并制作标准曲线。
各组取相同部位的结肠组织标本提取RNA,使用TIANScript RT Kit试剂盒进行逆转录合成cDNA,通过实时荧光定量PCR监测mRNA表达水平,具体引物序列如下:GAPDH:上游5′-ACATCGCTCAGACACCATG-3′,下游5′-TGTAGTTGAGGTCAATGAAGG G-3′;MUC2:上游5′-TCGCCCAAGTCGACACTCA-3′,下游5′-GCAAATAGCCATAGTACAGTTACACAGC-3′;Claudin-1:上游5′-GAATTCTATGACCCCTTGACC C-3′,下游5′-TGGTGTTGGGTAAGAGGTTG-3′;occludin:上游5′-ACTATGCGGAAAGAGTTGACAG-3′,下游5′-GTCATCCACACTCAAGGTCAG-3′;IL-1β:上游5′-AGCTTCGTCAGCAGGCTGGC-3′;下游5′-ACAAAGGACATGGAGAACACC-3′;IL-6:上游5′-CCACTCACCTCTTCAGAACG-3′,下游5′-CATC TTTGGAAGGTTCAGGTTG-3′;NLRP3:上游5′- GC CTACAGTTGGGTGAAATGTAC-3′,下游5′-ACAA GCCTTTGCTCCAGACC-3′;ASC:上游5′-GAAATA CATCCCTACTTGGTG-3′,下游5′-ATGTTTGGTAT ATGTTCTACCAC-3′;caspase-1:上游5′- GAGCTTC AATCAGCTCCATCAG-3′,下游5′-CTTGAGGGTC CCAGTCAGTCC-3′。
石蜡切片经脱蜡及水化后,枸橼酸钠抗原热修复,5%山羊血清封闭,滴加一抗F4/80置于4 ℃过夜,荧光二抗室温避光孵育1 h后用二脒基苯基吲哚(DAPI)浸染细胞核,并用指甲油封片。
提取小鼠结肠组织蛋白,测定浓度后依次进行变性、电泳、湿法转膜,用脱脂牛奶封闭,随后滴加一抗4 ℃过夜,二抗室温孵育1 h,通过化学发光、显影及定影获得蛋白条带,利用Image J软件对蛋白条带的灰度进行分析。
采用SPSS 17.0统计学软件和GraphPad Prism作图统计软件进行统计学分析,计数资料以均数±标准差(Mean±SD)表示,两组间差异应用两独立样本t检验,3组间差异应用单因素方差分析及两两比较的q检验,P<0.05为差异有统计学意义。
2%DSS水溶液造模前3 d,小鼠体质量及活力未见明显异常,未见稀便或便血等异常。造模第4天起体质量有所下降,出现活力降低,稀便或便血等症状。给药结束时DSS组小鼠死亡5只,DSS+SB组小鼠死亡4只,两组生存率差异无统计学意义。
从第4天起DSS+SB组和DSS组的小鼠体质量逐渐下降,第5天DSS组小鼠体质量显著低于DSS+SB组[(17.65 ± 0.16)g比(18.36 ± 0.26)g,P = 0.03]。DSS+SB组的DAI评分在实验第5天(6.73 ± 0.72比8.74 ± 0.45,P = 0.02)、第6天(7.90 ± 0.59比9.39 ± 0.32,P = 0.04)、第7天(8.53 ± 0.56比10.44 ± 0.34,P<0.01)均低于DSS组,见图1A。
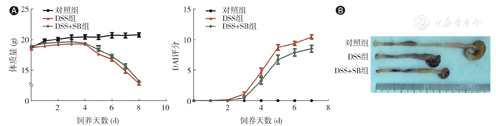

对照组小鼠结肠长度为(7.86 ± 0.12)cm,DSS组小鼠结肠长度为(4.78 ± 0.13)cm,DSS+SB组小鼠结肠长度为(5.34 ± 0.14)cm,任意两组间比较差异均有统计学意义,见图1B。
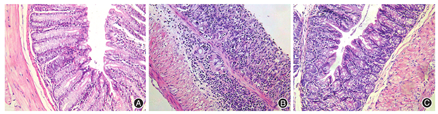
HE染色显示DSS+SB组结肠组织损伤程度明显轻于DSS组,见图2。DSS组的组织学评分高于DSS+SB组[(11.40 ± 0.31)比(7.31 ± 0.50),P<0.01]。

对照组小鼠血清FITC-D浓度为(0.78 ± 0.44)mg/L,DSS组小鼠血清FITC-D浓度为(4.28 ± 0.55)mg/L,DSS+SB组小鼠血清FITC-D浓度为(2.02 ± 0.22)mg/L,差异有统计学意义(P<0.01),提示水飞蓟宾可改善DSS诱导的结肠炎小鼠的肠道通透性。
实时PCR检测小鼠结肠组织中claudin-1、occludin和MUC2的mRNA表达情况,结果提示水飞蓟宾可明显增加claudin-1、occludin和MUC2基因的表达,改善DSS诱导的结肠炎小鼠的肠道黏膜屏障功能,见表1。
3组小鼠结肠组织claudin-1、occludin和MUC2的mRNA相对表达
3组小鼠结肠组织claudin-1、occludin和MUC2的mRNA相对表达
| 组别 | 鼠数(n) | claudin-1 | occludin | MUC2 |
|---|---|---|---|---|
| 对照 | 8 | 1.06 ± 0.14 | 1.00 ± 0.05 | 0.82 ± 0.09 |
| DSS | 15 | 0.04 ± 0.02a | 0.18 ± 0.01a | 0.07 ± 0.03a |
| DSS+SB | 16 | 0.72 ± 0.15bc | 0.52 ± 0.04bc | 0.36 ± 0.06bc |
注:SB:水飞蓟宾;DSS:葡聚糖硫酸钠;DSS组与对照组比较,aP<0.05;DSS+SB组与对照组比较,bP<0.05;DSS+SB组与DSS组比较,cP<0.05
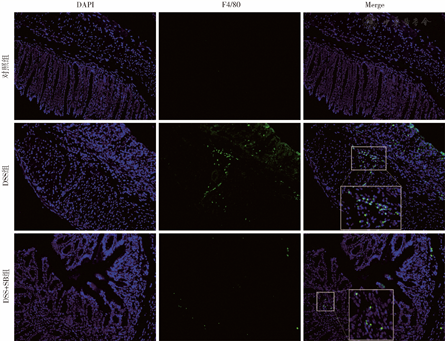
免疫荧光染色检测小鼠结肠组织中总巨噬细胞标记物F4/80的表达情况,结果显示DSS+SB组小鼠结肠组织中F4/80的表达少于DSS组,表明水飞蓟宾可减少小鼠结肠组织中巨噬细胞的浸润,见图3。

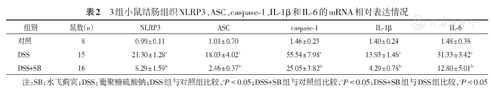
实时PCR检测小鼠结肠组织中NLRP3炎症小体相关基因的表达,结果显示DSS+SB组小鼠结肠组织中NLRP3、ASC和caspase-1基因的表达明显低于DSS组,见表2。
3组小鼠结肠组织NLRP3、ASC、caspase-1、IL-1β和IL-6的mRNA相对表达情况
3组小鼠结肠组织NLRP3、ASC、caspase-1、IL-1β和IL-6的mRNA相对表达情况
| 组别 | 鼠数(n) | NLRP3 | ASC | caspase-1 | IL-1β | IL-6 |
|---|---|---|---|---|---|---|
| 对照 | 8 | 0.99 ± 0.11 | 1.01 ± 0.70 | 1.46 ± 0.23 | 1.40 ± 0.24 | 1.48 ± 0.36 |
| DSS | 15 | 21.30 ± 1.28a | 18.03 ± 4.02a | 55.54 ± 7.98a | 13.93 ± 1.46a | 31.33 ± 3.42a |
| DSS+SB | 16 | 8.29 ± 1.59bc | 2.46 ± 0.37bc | 25.05± 3.82bc | 4.29 ± 0.78bc | 12.80± 5.01bc |
注:SB:水飞蓟宾;DSS:葡聚糖硫酸钠;DSS组与对照组比较,aP<0.05;DSS+SB组与对照组比较,bP<0.05;DSS+SB组与DSS组比较,cP<0.05
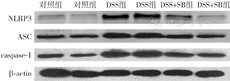
利用Western blot技术检测小鼠结肠组织中NLRP3炎症小体相关蛋白的表达,结果显示DSS+SB组小鼠结肠组织中NLRP3、ASC和caspase-1蛋白的表达明显低于DSS组,见图4。

实时PCR检测小鼠肠道组织中炎症因子mRNA的表达情况,结果显示水飞蓟宾能显著减少IL-1β和IL-6的表达,见表2。
随着经济的发展,城市化进程和生活方式西化导致了抗生素滥用、卫生状况和微生物暴露情况的改变,这些都是UC流行病学改变的可能的危险因素[2,9]。近年研究发现,固有免疫作为机体抵抗病原体的第一道防线,能对多种抗原物质产生生理性排斥反应,而固有免疫被细菌、毒素等侵入肠黏膜的病原体激活后产生的一系列免疫反应在UC的发生发展过程中具有重要的作用[10]。固有免疫反应的激活依赖于对微生物相关分子模式(microbial-associated molecular patterns,MAMPs)的识别。一旦识别了MAMPs,固有免疫受体就会激活核转录因子(nuclear factor-kappa B,NF-κB)等胞内信号通路产生一系列免疫反应[11]。
NLRP3炎症小体在IBD发生发展过程中起重要作用。肠道的固有免疫系统对MAMPs的特异性识别有赖于模式识别受体(pattern recognition receptor,PRRs),而Nod样受体(nod-like receptors,NLRs)家族又是与IBD相关的3个PRRs之一[11]。NLR家族一旦被激活,能够提供支架来组装成多蛋白复合物,即炎症小体[12]。其中,NLRP3炎症小体由ASC、caspase-1共同组成。NLRP3和ASC的热蛋白结构域(pyrin domain,PYD)相互作用使caspase-1活化,活化的caspase-1促进IL-1β和IL-18前体的成熟和分泌[5]。敲除NLRP3或ASC或caspase-1基因的巨噬细胞IL-1β的分泌减少。DSS干预后的NLRP3-/-小鼠表现出较野生型小鼠更轻的结肠炎症反应和较低的炎症因子表达水平,而利用药物抑制正常小鼠的caspase-1能达到与NLRP3缺陷小鼠相似的黏膜保护作用,表明DSS是通过NLRP3炎症小体通路激活caspase-1[13]。
植物提取物可作为药物用于UC的治疗。2015年一项纳入80例UC患者的随机双盲安慰剂对照试验,研究对象在基础治疗的同时分别服用水飞蓟素(140 mg/d)和安慰剂连续6个月,结果显示,水飞蓟素组患者较安慰剂组的血红蛋白水平升高,红细胞沉降率降低,DAI评分降低,对维持UC的持续缓解有较好疗效[14]。动物研究也发现,水飞蓟素在三硝基苯磺酸诱导的大鼠结肠炎模型中可显著降低NF-κB的活性,降低IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、髓过氧化物酶、脂质过氧化和蛋白质羰基的水平,能够有效缓解大鼠的结肠炎症反应,但机制未明[15]。本研究发现水飞蓟宾干预DSS诱导的小鼠结肠炎模型具有较好的疗效,炎症因子水平明显下降,体质量减轻程度、DAI评分和组织损伤评分均有所改善,肠道屏障的损伤减轻,肠道的巨噬细胞浸润减少。此外,本研究结果发现NLRP3、ASC和caspase-1在基因和蛋白水平上均有所降低,提示水飞蓟宾可能通过抑制NLRP3炎症小体缓解结肠炎,这将为UC的临床防治提供新的诊疗思路。
所有作者均声明无利益冲突



























