
甲状腺结节临床上常见,超声已成为诊断和鉴别结节良恶性的最有效影像学方法。因有关超声评估的TI-RADS版本较多,部分分级系统指标复杂,使得临床应用受限。2017年美国放射学会(American College of Radiology,ACR)推出了基于常规二维图像的TI-RADS分级,以期减少对于操作者的依赖性,便于与临床医师沟通。ACR推出TI-RADS目的是对甲状腺结节建立一个危险分层系统,指导临床医生选择治疗方案。本文对ACR TI-RADS分级系统做一解读,主要内容包括ACR TI-RADS发展、概述、特征分类及临床应用体会。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着高分辨率超声检查的应用,甲状腺结节发病率达到68%[1]。因良恶性结节临床处理不同,因此术前良恶性的判断至关重要。目前,细针穿刺技术(fine-needle aspiration,FNA)是确定结节性质最有效、实用的检查方法[2,3],但毕竟是有创检查,且不是所有检测出来的结节都需要FNA和(或)手术。
因此,需要一种能合理判断结节良恶性的可靠的、非侵入性的方法,以此确定哪些结节需要FNA。美国甲状腺学会指南推荐所有手术患者术前常规进行超声检查[4],超声已成为诊断和鉴别甲状腺结节良恶性的最有效影像学检查方法。
TI-RADS分级版本较多,有智利、韩国、法国、中国等分级系统。其中智利学者Horvath等[5]以内部结构、形状、回声强度、纵横比、血供等10项甲状腺结节超声特征作为参考指标提出TI-RADS的概念,系统分为6级,1级:正常甲状腺;2级:良性结节(0%恶性可能);3级:良性结节可能(<5%恶性可能);4级:可疑恶性结节(5%~80%恶性可能),分为4a(5%~10%恶性可能)和4b(10%~80%恶性可能);5级:很可能恶性结节(恶性可能性>80%);6级:已被病理证实的恶性结节。根据分级结果,建议TI-RADS 4级和5级的患者进行FNA,TI-RADS 2级和3级的结节通常只需随访。
美国放射学会(American College of Radiology,ACR)于2012年开始着手制订TI-RADS,委员会就以下内容进行探讨:(1)对偶然发现甲状腺结节提供报告建议;(2)为超声报告制定一套标准术语(词典);(3)在词典的基础上建立TI-RADS。旨在为医生提供以循证为基础的甲状腺结节处理建议,希望通过开发词典,将甲状腺结节的诊断术语标准化。2015年,ACR委员会发表了白皮书,公布了前两项研究结果,介绍了偶发性甲状腺结节的诊断方法,并提出了用于超声报告的词典[6,7]。以该词典的术语为基础,2017年ACR TI-RADS甲状腺结节分类系统正式公布[8]。
ACR最初是把9个范畴列入了研究:结节的结构、回声、囊实成分特征、形态、大小、边缘、晕环、强回声、血流。经过合并和筛选,最后纳入结构、回声、形态、边缘、局灶性强回声5个方面(图1)。其中大小虽然不是鉴别良恶性的指标,但决定着结节的进一步处理方式。


评估结节时,从前4个超声特征类别的每个类别中选择一个特征,从最后一个类别中选择所有特征,然后对这些特征对应得分进行求和。更多的可疑征象将被赋予更多分数,总分数决定了结节的ACR TI-RADS等级,范围从TR 1(良性)至TR 5(高度怀疑恶性肿瘤)。ACR TI-RADS分级风险等级分为良性、无可疑、轻度可疑、中度可疑及高度可疑。而我们应用广泛且得到临床验证的超声弹性成像技术,白皮书认为是一种很有前景的技术[9,10],但许多医疗机构的超声仪器并不具备这项技术,因此未纳入ACR TI-RADS中。
在ACR TI-RADS中,关于FNA或超声随访的建议是基于结节的TR分级及其最大直径。对于TR 3至TR 5的风险等级,直径超过一定阈值才建议FNA或者超声随访,目的是减少可能是良性或无临床意义结节的超声检查重复次数。
我们将详细阐述ACR TI-RADS超声检查5组特征分级、得分多少和等级阈值。ACR鼓励读者参考白皮书词典来详细描述所有类别和特征[6]。此外,应该仔细询问患者既往FNA或消融的病史,因为这些手术可能导致随访超声发现可疑征象[11]。在实际超声检查过程中,我们建议对于有这些既往史的病灶,仅提示FNA或消融术后改变,不进行评分或者定性。
囊性或几乎完全囊性的结节评分为0分(图2A、图2B);海绵状结构与良性高度相关,评分为0分(图2C);"囊实混合性(图2D)"结合了词典的两个特征,实性和囊性成分各占一半,评分为1分。在确定是否需要活检时,实性成分的特征比结节的大小或囊实比例更重要,呈偏心性,如果实性成分同时伴有回声衰减、分叶或点状强回声等征象,则是中度或高度可疑恶性。实性或几乎实性评分为2分(图2E、图2F)。海绵状结节必须以小囊状空间为主(>50%)[4]。在实性结节中存在少量散在的囊性成分不能被定义为海绵状结节(图2F)。结节钙化灶后方出现明显声影,导致无法判断结节内部结构2分,该类结节总分为3分。


回声是指甲状腺结节相对于周边的甲状腺组织回声,而极低回声结节则是与肌层进行比较。无回声(图3A)、等回声(图3B)、低回声(图3C)、极低回声结节(图3D)分别赋予0、1、2、3分。当回声水平无法确定时(如粗钙化声影遮盖)评1分。
包含水平位(图4A)和垂直位(图4B)。垂直位是恶性肿瘤的一个不敏感但高度特异的指标[12],即纵横比。有研究认为横切面与纵切面没有区别,ACR选择在横切面评估,通常采用目测法评估,一般无需测量。
边缘光滑是大部分结节性甲状腺肿的特征(图5A);边缘模糊(图5B),即难以辨认结节与周围甲状腺实质的界限;分叶或不规则指的是结节的边缘呈针刺状、锯齿状或呈锐角突出于周围实质,上述特征分别给予0分、0分、2分。ACR委员会认为声晕的存在对于鉴别甲状腺结节良恶性意义不大,因此忽略声晕的存在,没有给予分值。
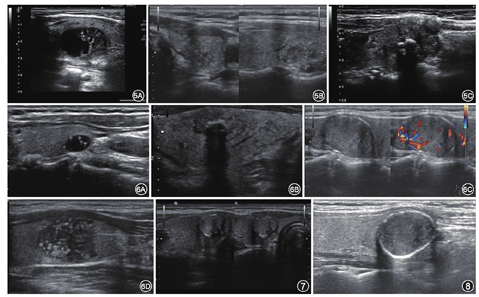

甲状腺外侵犯(extrathyroidal extension,ETE)分为广泛或微小[13](图5C)。广泛ETE的特点是结节广泛侵犯邻近的软组织和(或)血管结构,是一个高度可靠的恶性肿瘤标志。当超声检查发现结节在甲状腺边缘向外凸出或甲状腺被膜回声连续性中断时,高度可疑有ETE[14]。对此种情况,我们的做法是分三种情况描述:结节距前/后被膜的距离、紧邻被膜或被膜连续性中断,以此帮助临床医生选择治疗方案。
大彗星尾征是指局灶性强回声后方伴深度大于1 mm的V形彗星尾(图6A),它们与胶质有关,位于甲状腺结节的囊性成分中时,强烈提示良性,评为0分;粗钙化是伴有声影的粗大强回声(图6B)。文献中有关它们与恶性肿瘤风险增加相关的意见不一,特别是在缺乏其他恶性特征的结节中[15]。鉴于已发表的数据显示其与恶性肿瘤之间存在微弱的正相关关系[16],粗钙化评为1分。
周边/环形钙化是指占据结节部分或全部的边缘的钙化(图6C),文献中他们与恶性肿瘤的相关性是不统一[17],部分学者认为它们比粗钙化与恶性肿瘤更强烈地相关[16],在ACR TI-RADS中,评为2分。ATA指南提示若结节边缘钙化环中断,并于中断处可见软组织,则高度提示为恶性,在病理学可表现为肿瘤呈浸润性生长,破坏了钙化环[18]。
点状强回声较粗大钙化小,且无声影(图6D)。在甲状腺结节的实性成分中,它们可能对应于乳头状癌有关的砂粒体样钙化,因此认为是高度可疑恶性的,特别是与其他可疑征象并存,包括实性成分中伴有小彗星尾的点状强回声。
由于TI-RADS版本较多,不同单位使用的分级系统不统一;通过ACR TI-RADS分级的实际应用,认为此分级还有需要完善的地方,未来可以将彩色多普勒超声、弹性成像等技术纳入分级;对某些指标详尽分类,比如边缘钙化的完整性与不完整的分值(图7,图8);对未分化癌、淋巴瘤、恶性滤泡性肿瘤等有价值的分类;ACR TI-RADS分级评估为恶性结节的活检率高于其他指南,而活检为恶性结节的百分比低于其他指南[19],这可能会导致临床的过度诊断。ACR TI-RADS分级是一种对结节进行评分分级的方法,仅对结节进行分级,远远不能满足临床需求,对结节良恶性的鉴别要综合判断,建议超声医生首先进行分级,然后在此基础上提出可能性诊断。
应用ACR TI-RADS对结节进行分级,比其他已经建立的指南可行性更好[19]。ACR建立了以常规二维超声声像图表现为主的新的TI-RADS分级,分级比较简单,基于常规二维图像,减少了对于操作者的依赖性,便于实际运用,对于基层或甲状腺结节诊断经验不丰富的单位有较好的指导作用,减少甲状腺超声报告仅提示结节的现象,便于推广普及,有利于与临床医师沟通。
所有作者均声明不存在利益冲突
1.美国放射学会甲状腺影像报告和数据系统甲状腺结节分类系统哪年正式公布的?
A 2015年 B 2016年 C 2017年 D 2018年
2.美国放射学会甲状腺影像报告和数据系统甲状腺结节分为几级?
A 0~4 B 0~5 C 1~4 D 1~5
3.甲状腺结节内有微小钙化应赋予多少分?
A 0分 B 1分 C 2分 D 3分
4.对美国放射学会甲状腺影像报告和数据系统评估为4级,直径>1.0 cm的结节,应如何处理?
A 随访 B 穿刺 C 消融 D 手术
5.美国放射学会甲状腺影像报告和数据系统评估分数为5分的结节,应该属于哪一级?
A 2级 B 3级 C 4级 D 5级



























