
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
二尖瓣反流(mitral regurgitation,MR)是最常见的心脏瓣膜疾病[1]。超声心动图目前是MR诊断和评价最重要的影像学方法。随着以MitraClip为代表的MR介入治疗技术的发展[2,3],超声心动图对MR的术前评估、术中监测、术后评价变得尤为重要。虽然国际上已经发布了有关MR超声评价的指导性文献[4,5,6],但其内容甚为复杂,临床使用可行性较低,不符合我国国情,且不是专门针对MR介入治疗技术而编写。目前,我国研发的MR介入治疗器械陆续进入临床试验[7,8],然而,尚未有符合我国国情的MR超声评价指导性文件。为了规范我国MR的超声评价,为今后MR介入治疗技术提供参考,协作组编写了本专家共识。
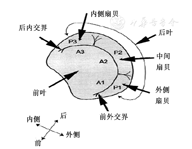
二尖瓣装置由前叶、后叶、腱索、乳头肌、瓣环和左室壁组成。两个瓣叶在前外交界和后内交界处相连接,均有相应的腱索和乳头肌。二尖瓣前叶和后叶分别可分成3个扇区,后叶天然的2个切迹将后叶分成3个部分,从前外交界向后内交界方向,依次为外侧叶P1、中间叶P2、内侧叶P3。前叶与之对应的区域依次为外侧叶A1、中间叶A2、内侧叶A3 (图1)。

MR是最常见的心脏瓣膜疾病。美国的一项研究显示,人群中轻度(+)、中度(2+)、中重度(3+)及重度(4+)MR发病率为19.2%、1.6%、0.3%及0.2%[9]。另一项研究显示,中度以上MR在总体人群发病率为1.7%,并随着年龄而增长,在>75岁人群中可接近10%[1]。在中国,MR的具体发病率尚不清楚,根据目前资料显示,MR为常见心脏疾病[10,11]。超声心动图目前是诊断和评价MR最重要的方法之一[4,5,6]。按照严重程度,MR的临床表现差别较大。轻度MR可以在很长时间内不出现临床症状,预后较好。重度MR可导致肺动脉高压、心房颤动(房颤)、心力衰竭(心衰),甚至死亡。无症状重度MR 5年内全因死亡、心脏性死亡、心血管事件发生率分别为(22±3)%、(14±3)%、(33±3)%[12],而出现严重心力衰竭者[纽约心脏协会(NYHA)心功能分级Ⅲ级以上]每年死亡率达34%[13]。目前,外科瓣膜修复或置换术是MR的标准治疗方法,经导管介入治疗为MR新兴治疗技术。
二尖瓣功能的完整性要求二尖瓣环大小合适,瓣叶结构完整,乳头肌收缩牵拉腱索发挥瓣叶的支撑作用,左心室肌肉收缩产生关闭力量适当,心室形态及功能正常。这些因素中任何一个出现异常都会导致MR。MR的病因可分为原发性瓣膜病变(瓣膜本身结构的病变导致)及继发性瓣膜病变(心脏本身或瓣膜支撑结构病变导致)[4],确定MR的病因非常重要,有助于选择二尖瓣治疗技术以及药物治疗方案,且是患者长期预后的重要独立预测因素。表1显示了MR的病因。随着人口老龄化的加剧,最为常见的原发二尖瓣病变为退行性病变,而在继发性MR中,缺血性MR及心衰后MR为主要因素。
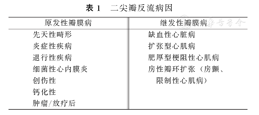
二尖瓣反流病因
二尖瓣反流病因
| 原发性瓣膜病 | 继发性瓣膜病 |
|---|---|
| 先天性畸形 | 缺血性心脏病 |
| 炎症性疾病 | 扩张型心肌病 |
| 退行性疾病 | 肥厚型梗阻性心肌病 |
| 细菌性心内膜炎 | 房性瓣环扩张(房颤、限制性心肌病) |
| 创伤性 | |
| 钙化性 | |
| 肿瘤/放疗后 |
20世纪70年代后期,随着外科领域瓣膜重建技术的发展,人们开始认识到仅仅采用瓣膜反流、狭窄、狭窄合并反流的三分法已经不足以区分瓣膜病变,而试图用详尽的解剖性描述来精确区分瓣膜疾病的方法太繁复且并不实用。二尖瓣修复技术的创始人Carpenter教授提出了规范化的二尖瓣反流"功能分型"[14],从而帮助规范定义及指导后续的外科修复治疗。同样,这类分型方法,对指导介入二尖瓣治疗也极其重要。例如,目前指南推荐的二尖瓣夹合手术患者,主要针对II型MR,而COAPT等[3]研究显示I型患者行MitraClip能明显获益,这类人群也可能是二尖瓣夹合术的适合人群。MR病变"功能分型"主要依赖超声心动图提供的信息,根据瓣叶的活动情况分为三型,包括:
Ⅰ型:瓣叶活动正常而瓣膜功能失调(图2)。在Ⅰ型功能失调中,收缩期和舒张期瓣叶活动幅度正常,反流的原因为瓣叶穿孔或瓣叶对合不良导致(瓣环扩张)。
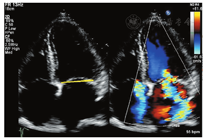

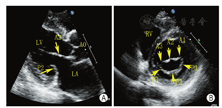
Ⅱ型:瓣叶活动过度的瓣膜功能失调(瓣膜脱垂)(图3)。定义为一个或多个瓣叶活动度增加,瓣叶的游离缘在瓣叶关闭时超过了瓣膜口关闭时的平面,血流动力学结果提示为瓣膜反流,由于腱索断裂或延长,或者乳头肌断裂导致。
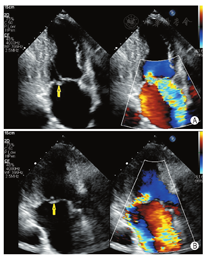

Ⅲ型:瓣叶活动受限的瓣膜功能异常(图4)。在Ⅲ型功能失调中,Ⅲa类指一个或多个瓣膜的运动在瓣叶开放或关闭时受到限制导致不同程度的狭窄或反流(瓣膜及瓣下组织增厚或钙化);Ⅲb类指一个或多个瓣叶的运动在瓣叶关闭时受到限制导致的反流(此类病变多为缺血性导致)。

有经胸二维、三维超声探头及经食管三维超声探头的彩色超声诊断仪。
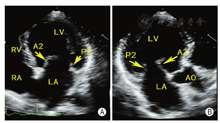
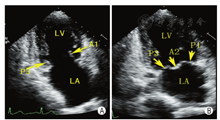
通过采集以下切面显示二尖瓣瓣叶各扇区。①胸骨旁左室长轴切面:显示A2、P2(图5A);②二尖瓣水平短轴切面:显示整个前后叶(图5B);③心尖四腔心切面:显示A2、P2(图6A);④心尖长轴切面:显示A2、P2(图6B);⑤心尖二腔心切面:显示A1、P3(图7A);⑥心尖二尖瓣交界处长轴切面:显示P1、A2、P3(图7B)。



TTE通过上述切面评价MR的机制、程度以及部位,并确定瓣膜运动异常的扇区。
通过采集4个食管中段切面完整显示二尖瓣(图8)。①食管中段的四腔心切面:显示A2、A3和P1;②食管中段的二尖瓣交界处切面:显示A2、P1和P3;③食管中段的二腔心切面:显示A1、A2和P3;④食管中段的长轴切面:显示A2和P2。
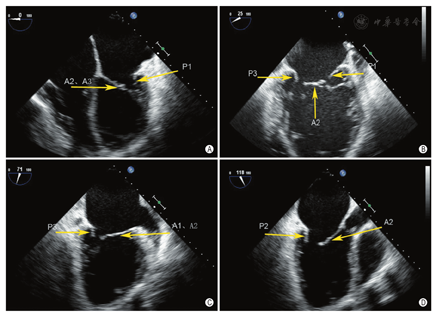

MR介入治疗术前和术中,经常使用三维TEE的X-plane双切面(包括二尖瓣交界处二腔心切面及三腔心切面)来评估二尖瓣解剖:二尖瓣交界处二腔心切面能清晰显示二尖瓣后叶P1及P3、前叶A2,而三腔心切面能清晰显示二尖瓣前叶A2、后叶P2。也可通过二尖瓣的"三维外科视野"立体显示二尖瓣前后叶(图9)。
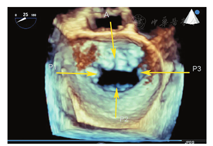

二维、三维TEE通过上述切面评价MR的机制、程度以及部位,并确定瓣膜运动异常的扇区。
关于MR的定量评估,目前各个指南、文件的标准不完全一致,且一般分为轻度、中度、重度[4,5,6]。这种分法较为宽泛,不能很好地反映手术前后的变化及体现手术效果。在MitraClip的系列临床试验中以及之后许多MR介入治疗临床研究中[2,3,15],将MR分为无(0+)、轻度(1+)、中度(2+)、中重度(3+)和重度(4+)。另外,国外指南文件中,关于MR的定量评估标准甚为复杂,需要采集多个复杂的却不很准确的数据,这在临床应用中,特别是在我国临床实践应用的可行性较低。鉴于以上情况,结合我国的国情,反流程度分为无(0+)、轻度(1+)、中度(2+)、中重度(3+)、重度(4+)和极重度(5+),现将MR定量评估参数和方法学作一推荐(见图10)。
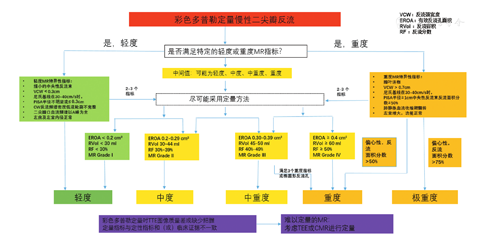

(1) VCW<0.3 cm为轻度反流。
(2) VCW为0.3~0.7 cm:二尖瓣反流程度不确定(轻度、中度、中重度、重度),需要结合下述参数来评估:反流面积分数(RF)、反流容积(RVol)、有效反流口面积(EROA)。①轻度二尖瓣反流:RF<30%,RVol<30 ml,EROA<0.20 cm2;②中度二尖瓣反流:RF 30%~39%,RVol 30~44 ml ,EROA 0.20~0.29 cm2;③中重度二尖瓣反流:RF 40%~49%,RVol 45~59 ml,EROA 0.30~0.39 cm2;④重度二尖瓣反流:RF≥50%,RVol≥60 ml,EROA≥0.4 cm2。
(3) VCW>0.7 cm为重度、极重度反流。
心腔的大小有助于评判MR的程度,左心功能状态会对反流的评估产生影响。对于左室射血分数保留(LVEF≥60%),TTE示反流束冲击房顶部并且折返,定义为重度MR;如果折返的血流束超过左房中段,且RF>75%,RVol>80 ml定义为极重度MR。
VCW:建议TTE胸骨旁左心室长轴切面和TEE食管中段左心室长轴切面,或者反流最多的标准切面测量反流束最窄部位宽度。
RF:建议TTE心尖四腔切面和TEE食管中段四腔切面,或者反流最多的标准切面测量反流面积和相应的左房面积。
RVol和EROA:在无主动脉瓣反流时,建议多普勒连续方程法(SVMV-SVLVOT)测算,条件不符合时考虑近端等速表面积法(PISA)。
一些技术因素可能会影响到左房内反流信号的出现,包括帧频、增益调节及探头频率。调节彩色标尺,可以影响到反流束在左房内分布的范围。彩色标尺调节到适中(50~70 cm/s),可以限制外溢影响,保持相对固定的技术因素,从而减少设备误差。
超声心动图在MR介入治疗中起着极其重要的作用,某些技术的操作可以在单纯超声指导下完成。超声心动图在MR介入治疗中的作用包括术前评估、术中监测指导及术后评价。在术前,超声心动图可以分析MR的病因,定量MR程度,分析二尖瓣解剖情况,判断患者是否适合行介入手术。术后,超声心动图则可评估有无残余MR及程度、跨瓣压差、器械的稳定性、并发症,以及心脏形态及功能变化。
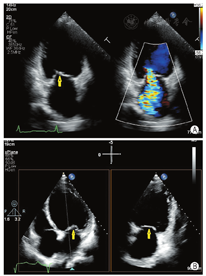
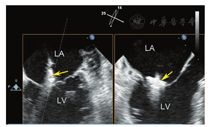
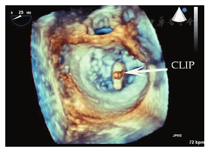
超声心动图在MR介入术中起着不可或缺的作用,下面以目前最为成熟的经导管二尖瓣夹合术MitralClip为例,阐述MR介入术中的超声评价。MitralClip是在TEE实时监测和引导下的操作,所有的导管操作由TEE监测和引导[16]。TEE首先引导房间隔穿刺,使得房间隔穿刺点距二尖瓣瓣环平面的高度3.5~4 cm(图11)。之后,TEE引导输送系统进入左心房并调弯、顶端垂直指向二尖瓣口。接着,TEE引导夹合器在二尖瓣上方定位,夹合器进入左心室,引导夹合器捕获和夹合瓣膜。夹合器捕获瓣膜位置,应该位于彩色多普勒显示反流束最大处。在整个手术过程中,两个超声切面非常重要,为手术的工作切面(X-plane双切面),包括三腔切面(左心室长轴切面)及二尖瓣交界处两腔切面(图12),前者可以显示二尖瓣A2、P2的位置,捕获瓣膜前二尖瓣夹合器应该在这个切面显示为"V"形,此时瓣夹合器臂与二尖瓣开放线垂直,分别位于A2、P2的位置,在该切面通过调整夹合器位置可使得夹合器更靠近前叶或后叶;后者显示P1,A2,P3,捕获瓣膜前二尖瓣夹合器在该平面应该为直线形,在该切面通过调整夹合器位置可使得夹合器更靠近内交界(3)或外交界(1)。另外一个工作切面为三维超声心动图的"二尖瓣外科视野",可以整体观察夹合器的位置、臂指向的方向(图13)。目前有限经验显示,经心尖二尖瓣夹合术(ValveClamp)术中超声指导和MitralClip总体上类似,但仍有部分差异,其超声规范尚在探索中。



执笔专家:潘翠珍(复旦大学附属中山医院),潘文志(复旦大学附属中山医院),周达新(复旦大学附属中山医院)
核心专家组成员(按姓氏拼音排序):葛均波(复旦大学附属中山医院),郭应强(四川大学华西医院),李伟(复旦大学附属中山医院),刘先宝(浙江大学医学院附属第二医院),潘翠珍(复旦大学附属中山医院),潘文志(复旦大学附属中山医院),潘湘斌(中国医学科学院阜外医院),蒲朝霞(浙江大学医学院附属第二医院),舒先红(复旦大学附属中山医院),宋光远(中国医学科学院阜外医院),唐红(四川大学华西医院),王建安(浙江大学医学院附属第二医院),王建德(中国医学科学院阜外医院),魏来(复旦大学附属中山医院),吴永健(中国医学科学院阜外医院),周达新(复旦大学附属中山医院),朱达(四川大学华西医院)
其他专家组成员(按姓氏拼音排序):陈海燕(复旦大学附属中山医院),陈茂(四川大学华西医院),冯沅(四川大学华西医院),管丽华(复旦大学附属中山医院),霍勇(北京大学第一医院),蒋世良(中国医学科学院阜外医院),孔祥清(南京医科大学第一附属医院),李捷(广东省人民医院),陆方林(海军军医大学长海医院),罗建方(广东省人民医院),马为(北京大学第一医院),孟旭(首都医科大学安贞医院),秦永文(第二军医大学附属长海医院),宋治远(第三军医大学西南医院),孙勇(哈尔滨医科大学附属第二医院),陶凌(空军军医大学西京医院),田家玮(哈尔滨医科大学附属第二医院),王广义(解放军总医院),伍广伟(广西壮族自治区人民医院),伍伟峰(广西医科大学第一附属医院),徐仲英(中国医学科学院阜外医院),杨剑(空军军医大学西京医院),杨荣(南京医科大学第一附属医院),于波(哈尔滨医科大学附属第二医院),曾智(四川大学华西医院),张戈军(中国医学科学院阜外医院),张海波(首都医科大学安贞医院),张梅(山东大学齐鲁医院),张伟华(昆明市延安医院),张玉顺(西安交通大学附属第一医院),张智伟(广东省人民医院),赵仙先(海军军医大学长海医院),周玉杰(首都医科大学安贞医院),朱鲜阳(沈阳军区总医院)

























