
探讨负荷剂量氯吡格雷治疗轻型缺血性脑卒中/短暂性脑缺血发作的有效性、安全性及可能的机制。
连续纳入2016年7月至2017年12月于苏州大学附属第一医院神经内科治疗的轻型缺血性脑卒中/TIA患者,入组CYP2C19功能丧失性等位基因(LOF)携带者,采用完全随机化方法随机将患者分为负荷剂量组(首剂300 mg氯吡格雷)和标准剂量组(首剂75 mg氯吡格雷),首剂氯吡格雷给药同时给予阿司匹林100 mg,继以阿司匹林100 mg/d+氯吡格雷75 mg/d维持20 d。以腺苷二磷酸(ADP)作为诱导剂分别检测服药前、服药后3 d的血小板最大聚集率(MAR)水平。应用美国国立卫生研究院卒中量表(NIHSS)评分法评定各组患者治疗前及治疗后7 d NIHSS评分;采用改良Rankin量表(mRS)评估3个月功能结局。
两组基线资料相互比较差异无统计学意义(P>0.05)。早期神经功能改善比例分别是75.0%、54.8%,差异有统计学意义(χ2=4.498,P=0.034);3个月预后良好比例分别是79.5%、61.3%,差异有统计学意义(χ2=4.000,P=0.045)。两组不良事件各1例,差异无统计学意义(2.3%比1.6%,χ2=0.061,P=0.806)。抗血小板治疗3 d后,负荷剂量组MAR降低(11%±8%),标准剂量组MAR降低(9%±4%),差异有统计学意义(P=0.013)。负荷剂量组CYP2C19*2携带者32例(72.7%)和CYP2C19*2+*3携带者42例(95.5%);早期神经功能改善比例分别是93.8%、76.2%,差异有统计学意义(χ2=4.122,P=0.042);3个月预后良好比例分别是96.9%、81.0%,差异有统计学意义(χ2=4.310,P=0.038);CYP2C19*2携带者MAR降低(15%±5%),CYP2C19*2+*3携带者MAR降低(12%±8%),差异有统计学意义(P=0.039)。
负荷剂量氯吡格雷能够改善轻型缺血性脑卒中/TIA患者临床预后,不增加出血风险;负荷剂量氯吡格雷可能通过降低CYP2C19*2携带者血小板聚集率改善轻型缺血性脑卒中/TIA患者临床预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
轻型缺血性脑卒中或短暂性脑缺血发作(transient ischemic attacks,TIA)复发率高,如不积极治疗可出现急性期神经功能恶化或卒中复发[1,2]。2014年中国卒中二级预防指南建议[3]:对于发病24 h内的轻型缺血性脑卒中/TIA患者应尽早给予阿司匹林联合氯吡格雷治疗。而研究发现对于轻型卒中/TIA患者,阿司匹林联合氯吡格雷的优势只体现在CYP2C19LOF(loss-of-function allele,LOF)非携带者[4,5]。
研究证实,携带一个CYP2C19LOF的患者即可表现为氯吡格雷活性代谢产物转化率下降,进而导致血小板抑制功能不足及增加主要血管事件的发生风险[6,7]。所以患者一旦检测发现为CYP2C19LOF携带者,就应考虑对其进行干预,以降低血栓发生的风险,改善患者的预后。关于氯吡格雷疗效不足的治疗,目前临床上可供选择的替代方案有三种:加量,换用新型抗血小板药物,加用另一种抗血小板药物,但具体方案仍在不断探索中,也没有相关指南推荐。由于氯吡格雷生物学效应具有剂量依赖性,可以考虑通过增加氯吡格雷剂量以提高生物效价,从而增强血小板抑制功能,改善患者预后。
本研究以血小板聚集率、神经功能改善情况、不良反应发生率为指标,探索负荷剂量氯吡格雷治疗轻型缺血性脑卒中/TIA CYP2C19*LOF携带者的有效性、安全性及可能的机制。
连续纳入2016年7月至2017年12月在苏州大学附属第一医院神经内科就诊的轻型缺血性脑卒中或TIA的患者106例。纳入标准:(1)轻型缺血性脑卒中/TIA(①轻型缺血性脑卒中定义为:NIHSS评分≤3分,NIHSS评分每一项为0~1分,其中意识评分必须为0分;②TIA定义为:脑或视网膜局灶性缺血所致的、不伴急性梗死的短暂性神经功能障碍,大多数临床症状在1 h内缓解,ABCD2评分≥4分);(2)CYP2C19 LOF携带者;(3)病程:≤ 24 h;(4)年龄:18~85岁。排除标准:(1)近3个月内有显著的头部创伤或卒中;(2)颅内出血史;(3)颅内肿瘤、动静脉畸形、动脉瘤、近期颅内或脊髓内手术;(4)活动性内出血、急性出血倾向;(5)严重的心、肝、肾功能不全;(6)严重疾病的终末期;(7)因各种原因不能完成随访的患者。
采用完全随机化方法,将入选患者随机分为负荷剂量组(n=44)和标准剂量组(n=62)。负荷剂量组首剂给予氯吡格雷联300 mg联合阿司匹林100 mg,标准剂量组首剂给予氯吡格雷75 mg联合阿司匹林100 mg,两组继以氯吡格雷75 mg/d+阿司匹林100 mg/d维持20 d。收集患者年龄、性别、血压、糖尿病、高脂血症、心脏病史、既往卒中病史、血常规、凝血功能、肝功能、肾功能、血脂、同型半胱氨酸、C-反应蛋白、CYP2C19基因多态性等基线资料。参照美国NINDS临床试验的评价标准,将治疗后7 d NIHSS评分下降≥4分或者神经功能缺损完全恢复视为症状明显好转。因本研究入选患者均为基线NIHSS评分≤3分,故我们将患者神经功能缺损完全恢复定义为早期神经功能改善(early neurological improvemen,ENI)。TIA未再发作或发作次数减少,持续时间短,发作症状减轻定义为ENI。将发病后3个月改良的Rankin评分(mRS评分0~2分)的患者定义为远期预后良好。
在用药前、用药后第3天检测患者的血小板最大聚集率水平。PL-11血小板分析仪采用动态聚集技术检测法对聚集前血小板数量、状态及聚集后血小板数量、状态进行持续跟踪检测,从而完成对血样本MAR水平的检测。仪器完成检测血样中原始血小板数据后,检测加入ADP后的血小板数量,MAR即第一次血样中血小板数量与第二次血样中血小板数量的变化及血小板数量下降的幅度。
所有数据均采用SPSS 23.00软件进行统计学分析,连续性变量以 ±s表示,计数资料以频数或百分比表示,组间比较采用χ2检验。两组连续性变量的组间比较,如符合正态分布的数据,组间比较采用独立样本t检验分析。如不符合正态分布的数据则进行轶和检验。以P<0.05差异具有统计学意义。
±s表示,计数资料以频数或百分比表示,组间比较采用χ2检验。两组连续性变量的组间比较,如符合正态分布的数据,组间比较采用独立样本t检验分析。如不符合正态分布的数据则进行轶和检验。以P<0.05差异具有统计学意义。
两组基线资料相互比较差异无统计学意义(P>0.05)(表1)。
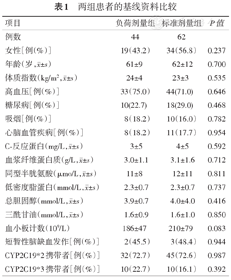
两组患者的基线资料比较
两组患者的基线资料比较
| 项目 | 负荷剂量组 | 标准剂量组 | P值 |
|---|---|---|---|
| 例数 | 44 | 62 | |
| 女性[例(%)] | 19(43.2) | 34(56.8) | 0.237 |
年龄(岁, ±s) ±s) | 61±9 | 62±12 | 0.700 |
体质指数(kg/m2, ±s) ±s) | 24±4 | 23±3 | 0.535 |
| 高血压[例(%)] | 33(75.0) | 44(71.0) | 0.646 |
| 糖尿病[例(%)] | 10(22.7) | 18(29.0) | 0.468 |
| 吸烟[例(%)] | 8(18.2) | 10(16.0) | 0.782 |
| 心脑血管疾病[例(%)] | 8(18.2) | 11(17.7) | 0.954 |
C-反应蛋白(mg/L, ±s) ±s) | 3±5 | 4±5 | 0.592 |
血浆纤维蛋白质(g/L, ±s) ±s) | 3.0±1.1 | 3.1±1.6 | 0.712 |
同型半胱氨酸(μmo/L, ±s) ±s) | 11±8 | 12±11 | 0.811 |
低密度脂蛋白(mmol/L, ±s) ±s) | 2.3±0.7 | 2.3±0.7 | 0.737 |
总胆固醇(mmol/L, ±s) ±s) | 3.9±0.7 | 4.0±4.0 | 0.416 |
三酰甘油(mmol/L, ±s) ±s) | 1.6±0.9 | 1.6±1.0 | 0.850 |
| 血小板计数(109/L) | 186±47 | 210±79 | 0.083 |
| 短暂性脑缺血发作[例(%)] | 2(45.5) | 3(48.4) | 0.944 |
| CYP2C19*2携带者[例(%)] | 32(72.7) | 45(72.6) | 0.987 |
| CYP2C19*3携带者[例(%)] | 10(22.7) | 10(16.1) | 0.392 |
负荷剂量组早期神经功能改善比例75.0%(33/44),标准剂量组早期神经功能改善比例54.8%(34/62),差异有统计学意义(χ2=4.498,P=0.034);负荷剂量组3个月预后良好比例79.5%(35/44),标准剂量组3个月预后良好比例61.3%(38/62),差异有统计学意义(χ2=4.000,P=0.045)。共2例出血事件,其中负荷剂量组组1例(2.3%)(消化道出血:粪隐血阳性),标准剂量组1例(1.6%)(颅内微出血灶)。各组患者3个月不良事件(皮肤黏膜出血、牙龈及鼻出血、消化道出血、颅内出血)发生率比较差异无统计学意义(χ2=0.061,P=0.806)。
负荷剂量组基线MAR(57%±12%),标准剂量组基线MAR(60%±14%),差异无统计学意义(P=0.234);抗血小板治疗3 d后,负荷剂量组MAR降低(11%±8%),标准剂量组MAR降低(9%±4%),差异有统计学意义(P=0.013)。
共入组CYP2C19LOF携带者106例;负荷剂量组CYP2C19*2携带者32例(72.7%),标准剂量组45例(72.6%);负荷剂量组CYP2C19*3携带者10例(22.7%),标准剂量组10例(16.1%),差异无统计学意义(P=0.373)。负荷剂量组44例,CYP2C19*2+*3携带者42例,占95.4%(表2)。
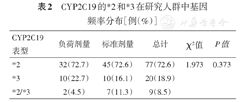
CYP2C19的*2和*3在研究人群中基因频率分布[例(%)]
CYP2C19的*2和*3在研究人群中基因频率分布[例(%)]
| CYP2C19表型 | 负荷剂量 | 标准剂量 | 总计 | χ2值 | P值 |
|---|---|---|---|---|---|
| *2 | 32(72.7) | 45(72.6) | 77(72.6) | 1.973 | 0.373 |
| *3 | 10(22.7) | 10(16.1) | 20(18.9) | ||
| *2/*3 | 2(4.5) | 7(11.3) | 9(8.5) |
负荷剂量组CYP2C19*2携带者早期神经功能改善比例93.8%(30/32),CYP2C19*2+*3携带者早期神经功能改善比例76.2%(32/42),差异有统计学意义(χ2=4.122,P=0.042);CYP2C19*2携带者3个月预后良好比例96.9%(31/32);CYP2C19*2+*3携带者3个月预后良好比例81.0%(35/42),差异有统计学意义(χ2=4.310,P=0.038)。
负荷剂量组CYP2C19*2携带者基线MAR(58%±12%),CYP2C19*2+*3携带者基线MAR(56%±12%),差异无统计学意义(P=0.468);治疗3 d后CYP2C19*2携带者MAR下降(15%±5%),CYP2C19*2+*3携带者MAR下降(12%±8%),差异有统计学意义(P=0.039)。
氯吡格雷为血小板膜蛋白P2Y12受体的抑制剂,通过阻断其与ADP的结合发挥抑制血小板聚集作用,与阿司匹林联合应用已成为治疗轻型缺血性脑卒中/TIA的常规治疗方案[8],但是双联抗血小板方案并不是人人获益的,研究表明[4,5],其与CYP2C19 LOF携带状态有关。因此需要探索积极有效的治疗方案。本研究通过检测患者服药前后血小板聚集率、评估神经功能改善情况、不良反应发生率,发现负荷剂量组患者无论早期神经功能改善,还是3个月时的临床预后、抑制血小板聚集能力,均优于标准剂量组,且不增加出血风险。CYP2C19*2携带者早期神经功能改善、3个月时的临床预后、抑制血小板聚集能力,均优于CYP2C19*3,提示负荷剂量氯吡格雷可能通过降低CYP2C19*2携带者血小板聚集率改善轻型缺血性脑卒中/TIA患者临床预后。
CYP系统,特别是CYP2C19参与两步代谢过程,对氯吡格雷的体内活化至关重要。研究证实[9],携带至少一个CYP2C19 LOF的患者即可表现为氯吡格雷活性代谢产物转化率下降,进而导致血小板抑制功能不足及主要血管事件风险的增加。Jia等[10]检测了259例急性IS患者的CYP2C19基因型,并通过mRS评估卒中预后,结果发现CYP2C19*2*3基因携带者在卒中后3个月的和6个月的临床转归较非携带者差。所以患者一旦检测发现为CYP2C19LOF携带者,就应考虑对其进行干预,以降低血栓发生的风险,改善患者的预后。
在临床实践过程中,如何选择抗血小板治疗方案仍未达成一致的意见,Gurbel等[11]研究比较了标准剂量氯吡格雷和高剂量氯吡格雷的抗血小板作用,结果提示,抗血小板作用呈现剂量依赖性,并且高剂量氯吡格雷较标准剂量氯吡格雷在更短时间内发挥更强的抗血小板作用。研究亦证实负荷剂量氯吡格雷较标准剂量氯吡格雷,可以更快地达到较高水平的血小板抑制作用,且两者安全性相似[12]。
本研究中,负荷剂量氯吡格雷在早期神经功能改善,还是3个月时的临床预后,均优于标准剂量,且未增加出血风险,且负荷剂量氯吡格雷抑制血小板聚集能力强于标准剂量氯吡格雷,这与既往研究结果一致[13]。证实增加氯吡格雷剂量能够改善携带轻型缺血性脑卒中/TIA患者临床预后。
研究发现CYP2C19*2携带者早期神经功能改善、3个月时的临床预后,均优于CYP2C19*3。且CYP2C19*2携带者抑制血小板聚集能力强于CYP2C19*3携带者,提示CYP2C19*2是影响本组患者对氯吡格雷反应的主要因素,与既往研究结果一致[14]。然而,Lee等[15]对450例植入药物洗脱支架的患者进行研究,发现韩国患者中CYP2C19*3是影响对氯吡格雷反应的主要因素,这与CYP2C19等位基因分布具有很大的种族和地区差异有关[16]。
综上,负荷剂量氯吡格雷增强患者氯吡格雷的抗血小板作用,进而改善轻型缺血性脑卒中/TIA的临床预后。且负荷剂量通过降低CYP2C19*2携带者MAR改善预后,而不是CYP2C19*3。因此临床上可以利用基因检查识别CYP2C19LOF携带者,识别轻型卒中/TIA进展及复发风险。通过调整抗血小板药物的剂量,以期改善患者的临床预后。但本研究样本量仍偏小,人群低危,事件率相对较低,今后将进一步加大样本量,更加严格的控制干扰因素。
所有作者均声明不存在利益冲突



























