
泌尿系结石是一常见病,我国成年人泌尿系结石的发病率约为6%,南方地区高达8.85%,其中,99%以上为肾结石及输尿管结石。近年来,对2 cm以下结石已广泛开展软性输尿管镜碎石术(RIRS)处理。RIRS与经皮肾镜碎石术(PNL)相比,结石清除率相近,但是安全性更佳,对于>2 cm的肾结石甚至鹿角形结石也展现出一定的治疗潜力。虽然软性输尿管镜手术创伤小,然而仍有可能发生各种并发症,应引起临床医护的高度重视。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
泌尿系结石是一常见病,占泌尿外科住院病种首位。我国成年人泌尿系结石的发病率约为6%,南方地区高达8.85%,其中,99%以上为肾结石及输尿管结石[1]。近年来,软性输尿管镜技术在我国快速发展,软性输尿管镜碎石术(RIRS)处理2 cm以下结石已广泛开展。RIRS与经皮肾镜碎石术(PNL)相比,结石清除率相近,安全性更佳,对于>2 cm的肾结石甚至鹿角形结石也展现出一定的治疗潜力,RIRS的手术适应证[2],包括:(1)≤2 cm的肾结石或输尿管上段结石;(2)PNL术后残余结石;(3)联合PNL治疗复杂性肾结石;(4)作为>2 cm肾结石的替代治疗,推荐分期手术;(5)对于双肾<1.5 cm结石,可同期双侧手术;(6)特殊病例的应用:①肾盏憩室结石、马蹄肾肾结石、异位肾合并结石、多囊肾合并结石、孤立肾较大的肾结石;②尿流改道术后输尿管结石;③小儿上尿路结石。虽然软性输尿管镜手术创伤小,然而仍有可能发生各种并发症,应引起临床医护人员的高度重视。现就RIRS并发症的分类及预防治疗策略谈如下看法。
术后感染是RIRS最需要关注的并发症,严重感染者会进展为尿源性脓毒血症,甚至感染性休克。软镜术后全身炎症反应综合征(SIRS)发生率在1.7%~8.1%之间[3],尿源性脓毒血症的死亡率高达30%~40%[4],可见十分凶险。尿源性脓毒血症的发生主要与术前尿培养、结石负荷、性别、手术时间、灌注压力、既往手术史、糖尿病、心血管疾病等有关[3,5]。术前近期由结石导致的感染病史与术后感染性并发症高度相关,因此碎石术前控制尿路感染具有十分重要的意义。术前中段尿培养是评估结石患者有无伴发感染的重要指标,尿培养阳性患者术后SIRS的发生率风险明显升高。但是,术前尿培养无法有效预测肾盂或结石内细菌引起的术后感染,仍有2.2%术前尿培养阴性的患者发生术后感染性并发症,术前尿培养结果并非碎石术后感染的独立影响因素。
有效的术中灌注能提供良好的手术视野和操作空间,但是高灌注压下细菌及内毒素经静脉或淋巴管回流入血是引起术后感染的主要原因。而肾盂内灌注压达30 mmHg(1 mmHg=0.133 kPa)即可产生反流,术中人体吸收的灌流液可达100 ml以上。维持术中低灌注压和低流量是预防术后感染的重中之重。
性别与RIRS术后感染的发生率有关,女性常高于男性。糖尿病、心血管疾病等基础疾病常加重、加速SIRS发生,其病情严重程度及控制与否跟RIRS术后感染性并发症的发生密切相关。结石性质和结石负荷决定了手术的难易程度和手术时间,对于质硬或大体积结石,手术时间延长,以及多次手术都是术后感染性并发症的诱因。
(1)术前应常规进行尿培养,阳性患者必须抗感染治疗转阴后手术。(2)软镜碎石术前30 min抗生素的预防性使用能有效预防感染性并发症的发生[6]。(3)术前2周留置双J输尿管支架管(双J管)能有效引流感染性尿液。术后双J管留置能防止输尿管充血水肿引起的肾后性梗阻,预防术后肾盂内压力增高诱发的感染;术后双J管留置2周为宜,时间过长反而有可能增加感染风险。(4)术中输尿管通道鞘(UAS)能确保有效的回流,防止肾盂内压力过高。术中UAS一定要置鞘到位,若遇到输尿管狭窄的患者,应及时结束手术。(5)维持术中低灌注压,若采用注射器手推法,维持术野清晰即可;若采用恒压灌注泵,压力、流量应设定在50 mmHg、30 ml/min以下。(6)手术时间控制在90 min内,若结石过大或质地坚硬,应分期碎石。(7)术中发现尿液浑浊或脓苔,应立即停止手术,放置双J管引流后2期碎石。(8)术后完善血细胞分析、降钙素原、C反应蛋白、乳酸、内毒素、IL-6等指标的检验。
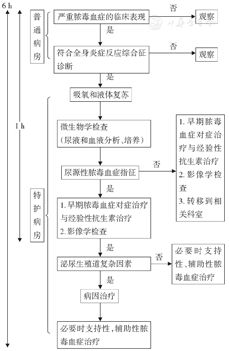
RIRS术后尿源性脓毒血症预后差,发生后应及时处理。术后血白细胞下降是脓毒血症的早期血液学表现,术后2 h内低于2.85×109/L是绝对敏感的警示指标,应立即给予液体复苏及抗生素干预。降钙素原能够预测70%尿源性脓毒血症的发生[7],比C反应蛋白、IL-6、乳酸有更高的特异性和敏感性,但是其升高要在2~6 h后出现;C反应蛋白在感染发生后6~8 h才明显升高,24~48 h达高峰,缺乏特异性。与SIRS相比,序贯性器官衰竭评分(SOFA)更加精确,能够有效地预测重症脓毒血症患者死亡率。呼吸频率≥22次/min、意识状态改变、收缩压≤100 mmHg三个指标共同组成了快速SOFA评分(qSOFA),有利于更加便捷、迅速地评估感染的严重程度及预后[8]。一旦患者出现寒战、高热、呼吸心率加快、低血压等脓毒血症的早期征兆(感染+SOFA≥2),应在1 h内实施抢救,在6 h内解除感染性诱因(图1)。液体复苏是脓毒血症的首要治疗措施,血液动力学不稳定者应在3 h内给予30 ml/kg晶体液;同时应用去甲肾上腺素维持平均动脉血压在65 mmHg以上。及早使用敏感抗生素是改善感染性休克预后的关键,每延迟1 h,存活率就会降低7.6%。

输尿管损伤主要由于术中器械进出输尿管造成,严重者有输尿管穿孔、断裂风险。输尿管损伤分5级:0级,无损伤或仅有黏膜出血点;1级,黏膜撕脱;2级,黏膜和平滑肌损伤,不累及外膜;3级,输尿管穿孔,累及外膜,可见周围脂肪;4级,输尿管断裂。其中0~1级为轻度损伤,2~4级为重度损伤。对于输尿管损伤的预防及治疗,需注意以下几点:(1)术前留置双J管2周扩张输尿管,可提高放置UAS成功率,较术前不置双J管者严重输尿管损伤的发生率减少85%以上。(2)术中放置UAS等操作器械过程中避免暴力操作;对于输尿管解剖异常者及儿童,必须在X线监视下置鞘。(3)术后UAS与软镜一并退出,从而观察输尿管全程,了解和评估输尿管有无损伤。(4)轻度损伤者术后双J管留置1~2周,重度损伤者术后双J管留置时间延长至4周以上。
(1)术中出血:术中出血的主要原因包括:UAS置入过深,损伤肾盏黏膜或肾实质;软镜反复进出肾盂或反复套石,导致肾盂压力反复升降,引起黏膜广泛渗血;器械摩擦或激光烧灼损伤黏膜等。小的黏膜出血一般不会对术野造成明显影响,出血较严重时可留置双J管改行二期手术,不建议用钬激光止血,因为可能引起更大损伤。术中只要保持通畅的回流及适当的灌注压,很少引起肾实质的损伤,而有重度肾积水,肾实质萎缩、偏薄的病人则容易出血,甚至出现肾破裂,术后肾周血肿等并发症。(2)术后出血:RIRS很少发生术后出血,但结石引起的肾盂积水或炎症反应会导致肾实质质地脆弱,较易受到损伤,其发生主要与低体质指数、慢性肾病、术后感染及肾实质较薄有关[9]。术后CT或超声能早期做出诊断。有报道术后20 d发生肾周血肿的案例[10],如术后出现腰痛、血红蛋白下降、伴发热感染应及时考虑到出血的可能。术后肾周血肿少见但往往凶险,发生后应及时干预。非活动性出血患者应绝对卧床;确保有效的抗感染治疗。严重的活动性出血者应紧急行介入血管栓塞治疗。
长期结石梗阻导致黏膜损伤、水肿及炎症反应,原梗阻处术后可能发生狭窄;术中造成输尿管损伤和尿外渗,可致狭窄发生;UAS反复进出输尿管口,则可能发生术后输尿管口狭窄。CT尿路造影则能进一步明确狭窄段的位置和长度,确诊后需留置双J管,或行球囊扩张、冷刀切开甚至输尿管再植等处理。为避免狭窄的发生,术中应避免暴力操作,放置UAS时避免反复进出输尿管口;若结石长期梗阻,碎石时避免进一步损伤输尿管黏膜。
RIRS术后若有结石碎片未排尽,术后仍有可能发生石街。因此碎石过程应尽量仔细,根据结石的质地和大小,灵活选用碎石功率和方法,尽量减小碎片体积,使其尽可能从引流通道排出,确保无较大结石残片。对于>2 mm的结石残片,必须用套石篮取出。若石街形成,需尽快选择体外冲击波碎石术或输尿管镜碎石,否则术后石街梗阻可能诱发感染或肾功能损伤。
患者肾功能降低大多因长期的结石梗阻引起,单纯软镜手术一般不会引起患者肾功能损伤。术后肾功能下降常为一过性,若术后拔除双J管后血肌酐持续升高则需排除结石残片堵塞输尿管以及输尿管狭窄。对于孤立肾患者,RIRS在减少肾功能损伤的同时达到较高的结石清除率,然而对于孤立肾2 cm以上结石,RIRS的疗效并不优于PNL[11]。对于孤立肾铸型结石,软镜联合PNL能避免多个经皮肾穿刺通道,减少肾损伤、出血,缩短手术时间。
总之,RIRS并发症的严重程度、发生率通常较低,然而仍有发生尿源性脓毒血症、肾脏破裂出血等严重并发症可能,从而造成患者身心痛苦,加重医疗费用负担,因此必须得到泌尿外科医护人员的充分认识和高度重视。
所有作者均声明不存在利益冲突



























