
探讨Irisin在抗精神病药源性胰岛素抵抗、腹型肥胖中的可能作用,为预防抗精神病药源性肥胖提供理论依据。
2016年1月至2017年12月郑州大学第一附属医院首发精神分裂症患者55例、健康对照50名。酶联免疫吸附试验(ELISA)测定血清Irisin水平;检测空腹血糖(FBG)、空腹胰岛素(INS)、胰岛素抵抗指数(HOMA-IR),以及三酰甘油(TG)、总胆固醇(TCHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等指标。
(1)病例组治疗前Irisin平均水平[(233±228)mmol/L]高于健康对照组[(124±89)mmol/L](P<0.05);(2)重复测量方差分析示:治疗12周末、24周末体质量、腰围、FBG、INS、TCHO、TG、HDL、LDL、BMI、HOMAIR以及Irisin水平均增加(P<0.05);(3)相关分析示:病例组基线期Irisin与HOMA-IR正相关(r=0.383,P<0.05),治疗12周末Irisin与腰围、HOMA-IR正相关(r=0.360,r=0.475,均P<0.05);多元线性回归分析示:治疗12周末,Irisin的变化与腰围、HOMA-IR的变化均正相关(β=0.453,β=0.420,均P<0.05)。
Irisin可能参与了精神分裂症患者代谢调节过程,是抗精神病药源性胰岛素抵抗、腹型肥胖早期预测指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
精神分裂症是一种病因尚未明完全阐明的重型精神疾病,严重影响患者社会功能及生活质量。非典型抗精神病药物(APPs)的应用,有效缓解和控制了病情,但常常引起机体代谢紊乱,导致肥胖、高血糖、高血脂症等代谢综合征的产生[1]。Boström等[2]首次发现了一种主要产生于肌肉组织,由Ⅲ型纤连蛋白结构域5(FNDC5)基因编码、剪切而成的因子——鸢尾素(Irisin)。其可促进血糖利用,加快脂肪分解、加速能量代谢,改善胰岛素抵抗,在代谢过程中起关键作用,被认为是治疗糖尿病、多囊卵巢综合征[3,4]等代谢性疾病的潜在靶点。然而,目前尚无鸢尾素在抗精神病药源性肥胖作用机制中的相关性研究。本研究通过动态观察首发未用药精神分裂症患者治疗过程中鸢尾素水平变化及其与代谢指标的关系,探讨鸢尾素与抗精神病药源性胰岛素抵抗、腹型肥胖的关系,为改善代谢异常、预防抗精神病药源性肥胖的发生提供新思路。
选取自2016年1月至2017年12月就诊于郑州大学第一附属医院精神科首发未用药精神分裂症患者作为病例组。所有受试者均通过郑州大学第一附属医院伦理委员会审核批准(批准号:2016-LW-18)并签署知情同意书。入选标准:(1)符合美国精神障碍诊断与统计手册第四版DSM-Ⅳ精神分裂症诊断标准,PANSS评分总分≥60;(2)年龄在18~45岁;(3)汉族;(4)首次发病,未使用过任何长效或者短效抗精神病药物。排除标准:(1)有精神活性物质滥用史;(2)有严重内分泌或血液系统疾病者;(3)患有其他精神疾病、神经系统疾病者;(4)妊娠或者哺乳期妇女;(5)超重或者肥胖[体质指数(BMI)≥24 kg/m2][5];(6)不同意参加本研究患者。本研究共入组患者55例,男26例,女29例,年龄18~36(22.4±5.8)岁,健康对照组为同期郑州大学第一附属医院医护人员、在校学生以及前来医院体检的健康成年人50名,其中男22名,女28名,年龄为20~36(23.7±2.6)岁,排除标准与病例组相同。两组受试人群在性别、年龄等方面差异无统计学意义(P>0.05)。
所有符合入组标准的首发精神分裂症患者在入院当天、治疗12周末、24周末,由专业精神科医生详细询问病史,进行体格检查及精神检查。采用PANSS量表评定患者精神症状严重程度,完成一般资料包括腰围,身高、体质量的测量并计算BMI。入组患者均使用单一抗精神病药物"利培酮"治疗,在1周内逐渐加量至"2~6 mg/d"。若伴有严重睡眠问题,可短期于晚间间歇性使用"苯二氮 类"药物。所有受试者均来自河南,汉族人,饮食结构差异不大。
类"药物。所有受试者均来自河南,汉族人,饮食结构差异不大。
所有受试者于入组后第2天、治疗12周末、24周末凌晨6:30—7:30抽取空腹肘静脉血10 ml,置于5 ml 2%EDTA抗凝管中。避免所测因子受生物节律变动影响。取血后立即于4 ℃下3 000 r/min离心10 min后用吸管分离上层血清,平均分为4等份装入2 ml离心管内,统一编号,-80 ℃保存,用于鸢尾素及相关代谢指标的测定。
选用武汉华美生物工程有限公司生产的人鸢尾素酶联免疫试剂盒(产品编号:CSB-EQ027943HU,检测范围:3.12~200 ng/ml,灵敏度:0.78 ng/ml,精密度:批内差CV%<8%,批间差CV%<10%,特异性:特异性检测人鸢尾素,且与其他相关蛋白无交叉反应)。通过酶联免疫吸附(ELISA)法定量测定精神分裂症患者血清鸢尾素水平。
采用标准酶法和自动分析仪(Roche Modular Analyzer, Roche Diagnostics, C8000)方法测定空腹血糖(FBG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、三酰甘油(TG)、总胆固醇(TCHO)等指标。采用电化学发光免疫测定法(Elecsys2010, Roche, Basel, Switzerland)测定INS水平[胰岛素抵抗指数(HOMA-IR)=INS(μU/ml)×FBG(mmol/L)/22.5][6]。
通过采用SPSS 20.0软件分析实验数据。计量资料以 ±s表示,基线水平组间比较时采用独立样本t检验,分类变量采用χ2检验;病例组利培酮治疗前后各指标组内变化采用重复测量方差分析;鸢尾素与代谢指标的关系采用Pearson相关性分析;多元线性回归分析影响鸢尾素水平的独立相关因子。所有统计均为双侧检验,P<0.05为差异有统计学意义。
±s表示,基线水平组间比较时采用独立样本t检验,分类变量采用χ2检验;病例组利培酮治疗前后各指标组内变化采用重复测量方差分析;鸢尾素与代谢指标的关系采用Pearson相关性分析;多元线性回归分析影响鸢尾素水平的独立相关因子。所有统计均为双侧检验,P<0.05为差异有统计学意义。
两组受试者人口统计学分析结果显示病例组基线水平和健康对照组在性别、年龄、BMI等方面差异无统计学意义(P>0.05)。病例组身高为150~183(164±11)cm;体质量为36~72(58±11)kg;腰围为62~80(76±8)cm;PANSS阳性症状得分为13~35(22±6)分,阴性症状得分为12~41(22±7)分,一般病理得分为24~65(40±9)分,PANSS总得分为66~108(84±15)分。
基线期病例组与健康对照组代谢相关指标比较结果显示:FBG、INS、HOMA-IR、TCHO、TG、HDL、LDL、BMI等指标差异无统计学意义(P>0.05),病例组鸢尾素水平高于健康对照组(t=3.17, P<0.05)(表1)。
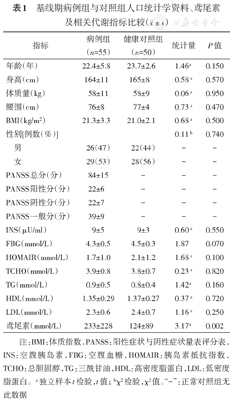
基线期病例组与对照组人口统计学资料、鸢尾素及相关代谢指标比较( ±s)
±s)
基线期病例组与对照组人口统计学资料、鸢尾素及相关代谢指标比较( ±s)
±s)
| 指标 | 病例组(n=55) | 健康对照组(n=50) | 统计量 | P值 | |
|---|---|---|---|---|---|
| 年龄(年) | 22.4±5.8 | 23.7±2.6 | 1.46a | 0.150 | |
| 身高(cm) | 164±11 | 165±8 | 0.58 a | 0.570 | |
| 体质量(kg) | 58±11 | 58±9 | 0.06 a | 0.950 | |
| 腰围(cm) | 76±8 | 77±4 | 0.73 a | 0.470 | |
| BMI(kg/m2) | 21.3±3.3 | 21.0±2.1 | 0.68 a | 0.500 | |
| 性别[例数(%)] | 0.11 b | 0.740 | |||
| 男 | 26(47) | 22(44) | - | - | |
| 女 | 29(53) | 28(56) | - | - | |
| PANSS总分(分) | 84±15 | - | - | - | |
| PANSS阳性分(分) | 22±6 | - | - | - | |
| PANSS阴性分(分) | 22±7 | - | - | - | |
| PANSS一般分(分) | 39±9 | - | - | - | |
| INS(μU/ml) | 9±5 | 9±3 | 0.60 a | 0.550 | |
| FBG(mmol/L) | 4.3±0.5 | 4.5±0.3 | 1.87 | 0.070 | |
| HOMAIR(mmol/L) | 1.7±1.0 | 2.1±1.2 | 1.68 a | 0.100 | |
| TCHO(mmol/L) | 3.9±0.8 | 3.8±0.7 | 0.23 a | 0.820 | |
| TG(mmol/L) | 0.9±0.5 | 0.8±0.4 | 1.42a | 0.160 | |
| HDL(mmol/L) | 1.35±0.29 | 1.37±0.27 | 0.37 a | 0.720 | |
| LDL(mmol/L) | 2.3±0.6 | 2.4±0.7 | 1.16 a | 0.250 | |
| 鸢尾素(mmol/L) | 233±228 | 124±89 | 3.17a | 0.002 | |
注:BMI:体质指数,PANSS:阳性症状与阴性症状量表评分表,INS:空腹胰岛素,FBG:空腹血糖,HOMAIR:胰岛素抵抗指数,TCHO:总胆固醇,TG:三酰甘油,HDL:高密度脂蛋白,LDL:低密度脂蛋白。a独立样本t检验,t值;bχ2检验,χ2值。"-":正常对照组无此数据
采用重复测量方差分析病例组利培酮治疗前、12周末、24周末各指标变化,结果显示:体质量、腰围、TCHO、TG、HDL、LDL、鸢尾素、BMI、FBG、INS、HOMA-IR水平均增加(P<0.05)(表2)。
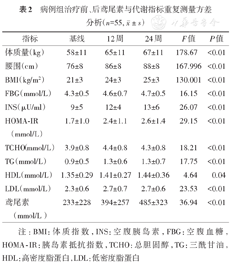
病例组治疗前、后鸢尾素与代谢指标重复测量方差分析(n=55,  ±s)
±s)
病例组治疗前、后鸢尾素与代谢指标重复测量方差分析(n=55,  ±s)
±s)
| 指标 | 基线 | 12周 | 24周 | F值 | P值 |
|---|---|---|---|---|---|
| 体质量(kg) | 58±11 | 65±11 | 67±11 | 178.67 | <0.01 |
| 腰围(cm) | 76±8 | 86±8 | 88±8 | 167.996 | <0.01 |
| BMI(kg/m2) | 21±3 | 24±3 | 25±3 | 130.001 | <0.01 |
| FBG(mmol/L) | 4.3±0.5 | 4.6±0.7 | 4.7±0.5 | 16.15 | <0.01 |
| INS(μU/ml) | 9±5 | 12±4 | 13±6 | 26.07 | <0.01 |
| HOMA-IR (mmol/L) | 1.7±1.0 | 2.4±1.1 | 2.6±1.4 | 29.15 | <0.01 |
| TCHO(mmol/L) | 3.9±0.8 | 4.4±0.8 | 4.3±0.8 | 18.21 | <0.01 |
| TG(mmol/L) | 0.9±0.5 | 1.3±0.6 | 1.3±0.7 | 17.75 | <0.01 |
| HDL(mmol/L) | 1.35±0.29 | 1.41±0.27 | 1.44±0.36 | 4.64 | 0.04 |
| LDL(mmol/L) | 2.3±0.6 | 2.7±0.7 | 2.7±0.6 | 23.53 | <0.01 |
| 鸢尾素(mmol/L) | 233±228 | 394±257 | 485±323 | 36.94 | <0.01 |
注:BMI:体质指数,INS:空腹胰岛素,FBG:空腹血糖,HOMA-IR:胰岛素抵抗指数,TCHO:总胆固醇,TG:三酰甘油,HDL:高密度脂蛋白,LDL:低密度脂蛋白
采用Pearson相关分析结果显示:治疗前鸢尾素与INS、HOMA-IR正相关(r=0.392,r=0.383,均P<0.05),与腰围、BMI、TCHO、TG、LDL、HDL等均不相关(均P>0.05);治疗12周末鸢尾素与腰围、INS、HOMA-IR正相关(r=0.360,r=0.501,r=0.475,均P<0.05),与TCHO、TG、HDL、LDL、BMI、FBG等均不相关(均P>0.05);治疗24周末鸢尾素与INS正相关(r=0.271,P<0.05),与TCHO、TG、HDL、LDL、BMI、FBG、HOMA-IR等均不相关(均P>0.05)(表3)。
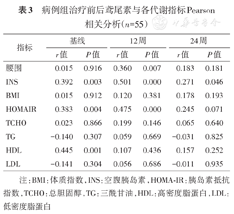
病例组治疗前后鸢尾素与各代谢指标Pearson相关分析(n=55)
病例组治疗前后鸢尾素与各代谢指标Pearson相关分析(n=55)
| 指标 | 基线 | 12周 | 24周 | |||
|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | |
| 腰围 | 0.015 | 0.916 | 0.360 | 0.007 | 0.183 | 0.181 |
| INS | 0.392 | 0.003 | 0.501 | 0.000 | 0.271 | 0.046 |
| BMI | 0.015 | 0.912 | 0.120 | 0.381 | 0.178 | 0.193 |
| HOMAIR | 0.383 | 0.004 | 0.475 | 0.000 | 0.245 | 0.071 |
| TCHO | 0.023 | 0.866 | 0.199 | 0.146 | 0.065 | 0.640 |
| TG | -0.140 | 0.307 | 0.059 | 0.669 | -0.031 | 0.825 |
| HDL | 0.445 | 0.001 | 0.107 | 0.436 | 0.157 | 0.252 |
| LDL | -0.141 | 0.304 | 0.056 | 0.686 | -0.011 | 0.935 |
注:BMI:体质指数,INS:空腹胰岛素,HOMA-IR:胰岛素抵抗指数,TCHO:总胆固醇,TG:三酰甘油,HDL:高密度脂蛋白,LDL:低密度脂蛋白
病例组治疗12周末、24周末与基线期比较,控制年龄、性别、吸烟、家族史等因素后,多元线性回归分析结果显示:治疗12周末,鸢尾素的变化与腰围和HOMA-IR的变化均正相关(β=0.453,β=0.420,均P<0.05);治疗第24周末,未能建立相关模型,无相关发现。
目前鸢尾素与代谢性疾病的关系已经成为研究的热点之一。为探讨鸢尾素与抗精神病药源性胰岛素抵抗、腹型肥胖之间的关系,本研究通过测定首发未用药精神分裂症患者利培酮治疗前后血清鸢尾素水平以及腰围、FBG、INS等代谢相关指标的变化,并计算HOMA-IR,结果发现鸢尾素与HOMA-IR、腰围具有相关性。说明鸢尾素可能通过参与调节糖脂代谢过程,改善抗精神病药源性肥胖。
鸢尾素是FNDC5剪切断裂形成的蛋白因子,依赖由骨骼肌通过运动诱导产生的过氧化物酶体增殖活化受体γ共激活因子1α(PGC-1α),可通过作用于肌肉、脂肪组织以及胰岛β细胞等参与代谢调节,被认为在改善肥胖、胰岛素抵抗过程中发挥积极作用[2]。本研究发现,首发未用药精神分裂症患者基线期鸢尾素水平高于对照组,与Lunetta等[7]研究结果一致,考虑可能与疾病本身有关。研究发现非肥胖首发未用药精神分裂症患者,2 h血糖含量升高而其他代谢指标正常,提示首发未用药精神分裂症患者存在糖耐量异常[8]。糖耐量是反映早期糖代谢较为敏感的指标,鸢尾素可通过激活AMP蛋白依赖激酶(AMPK)使葡萄糖转运蛋白移位,促进血糖进入细胞加快血糖利用[9]。本研究基线期鸢尾素水平升高可能通过参与调节首发未用药精神分裂症糖耐量异常,维持机体糖代谢内稳态。
随着治疗的进行,血清鸢尾素与各代谢指标水平均增加,说明精神分裂症患者利培酮治疗后发生代谢异常,具有较高罹患代谢性疾病的风险,与国内外大多数研究结果一致[1,10]。本研究在排除年龄、性别等混杂因素后发现,基线期、治疗12周末鸢尾素与HOMA-IR均正相关,说明鸢尾素可通过生理性代偿机制改善胰岛素抵抗,与Park等[11]研究结果一致。胰岛素抵抗是指各种原因引起的胰岛素利用和摄取葡糖糖的能力下降。鸢尾素可通过AMPK途径使过氧化物酶体增殖活化受体α(PPARα)激活并诱导PPARα表达。PPARα与其反应元件结合后调控编码相关代谢基因如葡萄糖激酶、β氧化酶以及生酮基因,进而促进血糖利用,同时也可调节肿瘤坏死因子-α(TNF-α)、瘦素等基因的表达,通过促进脂肪酸的氧化进程加速血脂分解利用,进而改善胰岛素抵抗[8,12]。利培酮治疗后精神分裂症患者血清鸢尾素升高,激活PPARα受体,通过部分依赖PPARα途径改善胰岛素抵抗。同时Crujeiras等[13]通过对肥胖患者饮食调节研究发现,鸢尾素在早期可通过代偿性增加改善胰岛素抵抗,但后期鸢尾素水平增加与胰岛素抵抗无关。本研究与其结果一致,推测鸢尾素可在早期参与调节胰岛素抵抗,但在改善胰岛素抵抗过程中,胰岛素长期处于高水平引起鸢尾素调节失代偿,导致鸢尾素抵抗。
本研究还发现治疗12周末鸢尾素与腰围正相关,说明腰围是鸢尾素的影响因素,与Elizondo- Montemayor等[14]研究结果一致。腰围是反映腹型肥胖较为灵敏的指标。腹型肥胖时腹部脂肪堆积,成年人脂肪组织主要分为两种:白色脂肪组织(储存脂肪)和棕色脂肪组织(解偶联途径氧化脂肪)。鸢尾素可与脂肪细胞表面特异性受体结合,激活p38丝裂原活化蛋白激酶(p38MAPK)及细胞外信号调节激酶(ERK)活性,使UCP1基因特异性表达能力增强,使白色脂肪棕色化,通过线粒体呼吸链氧化、分解脂肪,改善腹型肥胖[15]。但鸢尾素发挥代偿性作用是在一定范围内的,超过限度则会发生鸢尾素抵抗,此时鸢尾素浓度水平不能代表鸢尾素活性水平,仅表现为一种效应波动[16]。这或许是本研究治疗24周末未发现鸢尾素与腰围相关的原因。
肥胖尤其是腹型肥胖是导致胰岛素抵抗的主要原因之一,其作用机制之一为PPAR受体家族活性降低,使小脂肪细胞分化能力下降、游离脂肪酸产生增加、胰岛素受体数量下降[17]。鸢尾素可通过AMPK途径激活PPAR受体改善由腹型肥胖引起的胰岛素抵抗。因此,本研究推测在精神分裂症治疗早期,代谢相关指标发生异常,鸢尾素代偿性增加,一方面通过脂肪棕色化途径改善腹型肥胖,另一方面通过激活PPAR受体途径改善胰岛素抵抗,调节机体代谢使其处于相对稳定状态,具体机制有待进一步验证。
综上所述,本研究发现首发精神分裂症患者利培酮治疗前血清鸢尾素水平已出现异常,治疗后代谢水平增加,鸢尾素代偿性增加,可能在早期参与了精神分裂症代谢调节过程,是抗精神病药源性胰岛素抵抗、腹型肥胖的早期预测指标。本研究仍有不足之处,由于随访困难,未能对对照组进行随访,未从生物学角度验证鸢尾素在抗精神病药源性胰岛素抵抗、腹型肥胖中的作用。未来进一步扩大样本量,延长随访时间,并进行动物实验进一步验证鸢尾素在抗精神病药源性胰岛素抵抗、腹型肥胖发生过程中的作用机制,为预防抗精神病药源性肥胖的辅助治疗提供理论依据。
所有作者均声明不存在利益冲突



























