
研究获得性肺炎老年患者铜绿假单胞菌分离株的毒力基因和耐药基因的携带状况。
收集2016年1月至2017年12月在山东省日照市中心医院收治的60岁以上获得性肺炎患者痰液中分离的36株铜绿假单胞菌,采用Vitek法对9种抗菌药物进行敏感性试验,采用聚合酶链反应及序列分析法分析9种毒力基因及23种耐药基因(17种β-内酰胺酶类和6种氨基糖苷类耐药基因),阳性基因测序后直接作BLAST比对。
所有菌株对碳青霉烯类药物均敏感,对三代头孢菌素类、氨基糖苷类和喹诺酮类药物耐药率分别为27.78%、47.22%和30.56%;每株均检出5~8种毒力基因,其中plcH、aprA、algD、exoS、exoT、exoY和toxA检出率极高,高达97.22%~100.00%;检出6种耐药基因,分别为blaCARB、blaDHA、aac(6′)-Ⅰb、aac(6′)-Ⅱ、ant(3″)-Ⅰ和ant(2″)-Ⅰ,分离率为8.33%~27.78%;部分基因的PCR产物测序图已比对确认。
铜绿假单胞菌毒力基因的高携带率与老年人的获得性肺炎关系密切;铜绿假单胞菌未携带blaIMP、blaVIM和blaNDM碳青霉烯类β-内酰胺酶基因与对碳青霉烯类药物敏感密切相关;毒力基因和耐药基因的联合检测能更好的分析老年患者感染病原菌的致病机理。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
铜绿假单胞菌在医院获得性肺炎病原菌分析中仍占主要地位[1],其临床分离株对抗菌药物的耐药率仍居高位[2],尤其是老年患者[3],由于自身基础疾病多、免疫力低下和长期使用抗菌药物等更易感染并产生耐药性。多年来,对于铜绿假单胞菌的耐药基因研究较多[4],尤其是β-内酰胺酶类耐药基因,而对其毒力基因仅有胞外酶的研究[5]。对铜绿假单胞菌临床分离株的毒力基因和耐药基因联合观察国内研究较少见,针对60岁以上的老年患者的研究更少。因此,该研究收集医院感染的铜绿假单胞菌老年患者分离株进行了9种毒力基因及23种耐药基因检测,以了解毒力基因和耐药基因的携带状况。现报告如下。
36株铜绿假单胞菌分离自2016年1月至2017年12月在山东省日照市中心医院36例60岁以上的医院内肺炎老年住院患者痰液标本,患者年龄为61~92岁,平均年龄为72岁。按照《内科学》第9版呼吸系统章节中的标准诊断医院内肺炎[6],是指患者住院期间未接受有创机械通气,未处于病原感染的潜伏期,且入院≥48 h后在医院内新发生的肺炎,胸部X线或CT显示新出现或进展性的浸润影、实变影、磨玻璃影,加上下列3个临床症状中的2个或以上,可建立临床诊断:(1)发热,体温>38℃;(2)脓性气道分泌物;(3)外周血白细胞计数>10×109/L或<4×109/L。
经Vitek 2细菌鉴定药敏分析仪鉴定所有菌株;按照美国2018年美国临床实验室标准化协会(CLSI)M100标准[7],采用纸片扩散法对9种抗菌药物进行敏感性试验,包括头孢他啶、头孢噻肟、头孢吡肟、哌拉西林/他唑巴坦、亚胺培南、美罗培南、庆大霉素、阿米卡星和左氧氟沙星。Vitek 2细菌鉴定药敏分析仪(法国生物公司),PCR仪(美国PE公司),全自动测序仪(美国ABI公司),药敏纸片(英国Oxoid公司)。质控菌株为大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853,由山东省临检中心提供。
采用蛋白酶K处理法制备菌株DNA[8]。36株铜绿假单胞菌均作9种毒力基因(plcH、aprA、algD、exoS、exoT、exoU、exoY、toxA、pyo)及23种耐药基因[blaTEM、blaSHV、blaCTX-M-1群、blaCTX-M-2群、blaCTX-M-8群、blaCTX-M-9群、blaCTX-M-25群、blaPER、blaGES、blaVEB、blaCARB、blaIMP、blaVIM、blaNDM、blaDHA群、blaPDC、blaOXA-10群、aac(6′)-Ⅰb、aac(6′)-Ⅱ、ant(3″)-Ⅰ、ant(2″)-Ⅰ、rmtA、rmtB]检测,均采用PCR法。毒力基因PCR引物序列委托无锡新吴区新克隆数据分析工作室设计(见表1),其引物合成委托上海铂尚生物技术有限公司完成。耐药基因的PCR引物序列见参考文献[9]。实验所需9种毒力基因及23种耐药基因阳性参照DNA由无锡市克隆遗传技术研究所提供。

36株铜绿假单胞菌毒力基因的PCR引物序列
36株铜绿假单胞菌毒力基因的PCR引物序列
| 毒力基因 | 引物序列(5′→3′) | 产物长度(bp) |
|---|---|---|
| plcH | P1:ATGACCGAAAACTGGAAATTCCGC | 359 |
| P2:TGGTTCTGCGAACTCACCCAC | ||
| aprA | P1:ATGTCCAGCAATTCTCTTGCATTG | 288 |
| P2:GGCGCTGAACTTGCCCAGCGA | ||
| algD | P1:ATGCGAATCAGCATCTTTGGTTTG | 291 |
| P2:GCCCAGGTCCAGGTCGCCGT | ||
| exoS | P1:TCAGCAGAGTCCGTCTTTCGCC | 407 |
| P2:GCCAGGCGGGAGTGCTCCCGG | ||
| exoT | P1:TCAGCAGAACCCGTCTTTCGT | 407 |
| P2:GCCAGGCGCGTGTGATCCTTC | ||
| exoU | P1:CCGTCGCAGGCAGCGCATAAGTCC | 420 |
| P2:GAACGCCGCCGGGCTCATACCTGA | ||
| exoY | P1:ACCATGCGTATCGACGGTCATC | 281 |
| P2:TTGCTGAGATGCTGGTCGACAC | ||
| toxA | P1:GGCTGCTCCAGGCGCACCGCC | 438 |
| P2:GCCGATCAGCCGTTCGACCTC | ||
| pyo | P1:TGCCGGTACGACTCACGAGTG | 231 |
| P2:GTTCTGGCTTCCTGGAGGGGT |
DNA测序委托上海铂尚生物技术有限公司进行。DNA测序结果自行用Chromas软件联网比对(www.ncbi.nlm.nih.gov/BLASTn)。
采用Excel软件对数据进行分析。
所有菌株对亚胺培南和美罗培南等碳青霉烯类药物均敏感,对头孢吡肟和哌拉西林/他唑巴坦耐药率均为8.33%,对三代头孢菌素类(头孢他啶、头孢噻肟)、氨基糖苷类(庆大霉素、阿米卡星)和喹诺酮类(左氧氟沙星)药物耐药率分别为27.78%、47.22%和30.56%。
36株铜绿假单胞菌抗菌药物药敏试验结果
36株铜绿假单胞菌抗菌药物药敏试验结果
| 抗菌药物 | 耐药株数 | 耐药率(%) |
|---|---|---|
| 头孢他啶 | 10 | 27.78 |
| 头孢噻肟 | 10 | 27.78 |
| 头孢吡肟 | 3 | 8.33 |
| 哌拉西林/他唑巴坦 | 3 | 8.33 |
| 亚胺培南 | 0 | 0 |
| 美罗培南 | 0 | 0 |
| 庆大霉素 | 17 | 47.22 |
| 阿米卡星 | 17 | 47.22 |
| 左氧氟沙星 | 11 | 30.56 |
对36株铜绿假单胞菌进行9种毒力基因和23种耐药基因检测。毒力基因结果显示,36株铜绿假单胞菌均检出exoS、exoT和exoY,plcH、aprA、algD和toxA均检出35株,检出率均为97.22%,pyo检出16株,检出率为44.44%,exoU未检出。耐药基因共检测出6种,其中ant(2″)-Ⅰ检出10株(27.78%)、blaCARB检出9株(25.00%)、aac(6′)-Ⅱ检出9株(25.00%)、aac(6′)-Ⅰb检出8株(22.22%)、blaDHA检出3株(8.33%)、ant(3″)-Ⅰ检出3株(8.33%),其余未检出。见表3。plcH、aprA、algD、blaCARB和ant(2″)-ⅠPCR产物测序图基因已比对确认(图1,图2,图3,图4,图5)。
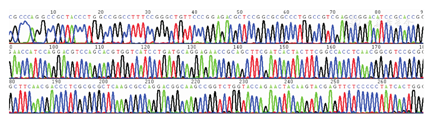

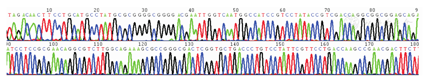

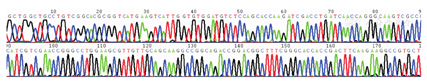



36株铜绿假单胞菌基因检测结果
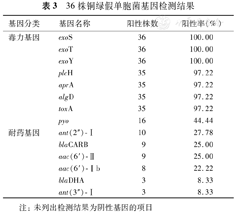
36株铜绿假单胞菌基因检测结果
| 基因分类 | 基因名称 | 阳性株数 | 阳性率(%) |
|---|---|---|---|
| 毒力基因 | exoS | 36 | 100.00 |
| exoT | 36 | 100.00 | |
| exoY | 36 | 100.00 | |
| plcH | 35 | 97.22 | |
| aprA | 35 | 97.22 | |
| algD | 35 | 97.22 | |
| toxA | 35 | 97.22 | |
| pyo | 16 | 44.44 | |
| 耐药基因 | ant(2″)-Ⅰ | 10 | 27.78 |
| blaCARB | 9 | 25.00 | |
| aac(6′)-Ⅱ | 9 | 25.00 | |
| aac(6′)-Ⅰb | 8 | 22.22 | |
| blaDHA | 3 | 8.33 | |
| ant(3″)-Ⅰ | 3 | 8.33 |
注:未列出检测结果为阴性基因的项目
36株铜绿假单胞菌中,有15株(41.67%)只携带毒力基因,其中7株(19.44%)携带8种毒力基因,7株(19.44%)携带7种毒力基因,1株(2.78%)携带5种毒力基因;其余21株(58.33%)铜绿假单胞菌除携带6~8种毒力基因外,分别还携带1~4种耐药基因,见表4。

36株铜绿假单胞菌毒力基因及耐药基因检出阳性模式分布及构成比[株(%)]
36株铜绿假单胞菌毒力基因及耐药基因检出阳性模式分布及构成比[株(%)]
| 毒力基因 | 耐药基因 | 株数 |
|---|---|---|
| plcH aprA algD exoS exoT exoY toxA pyo | 无 | 7(19.44) |
| plcH aprA algD exoS exoT exoY toxA pyo | DHA | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA | aac6′-Ⅱ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA | 无 | 7(19.44) |
| plcH aprA algD exoS exoT exoY toxA pyo | aac6′-Ⅱ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA pyo | aac6′-Ⅱ ant(2″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA pyp | ant(3″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA pyo | blaCARB ant(3″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA pyo | aac6′-Ⅰ ant(2″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA | aac6′-Ⅰ | 2( 5.56) |
| plcH aprA algD exoS exoT exoY toxA | aac6′-Ⅰ ant(2″)-Ⅰ | 4(11.11) |
| plcH aprA algD exoS exoT exoY | blaCARB | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA | blaCARB aac6′-Ⅱ ant(2″)-Ⅰ | 2( 5.56) |
| plcH aprA algD exoS exoT exoY toxA | blaCARB aac6′-Ⅱ ant(3″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA | blaCARB aac6′-Ⅱ | 2( 5.56) |
| plcH aprA algD exoS exoT exoY toxA pyo | blaCARB blaDHA aac6′-Ⅰ ant(2″)-Ⅰ | 1( 2.78) |
| plcH aprA algD exoS exoT exoY toxA pyo | blaCARB blaDHA aac6′-Ⅱ ant(2″)-Ⅰ | 1( 2.78) |
| exoS exoT exoY toxA pyo | 无 | 1( 2.78) |
铜绿假单胞菌在自然界呈广泛分布,常定植于人类的呼吸道黏膜,一般情况下,并不导致人体组织炎症。但当人体受到意外严重创伤或医疗操作后(如:机械通气、保留导尿管和手术)以及长期卧床的老年人,尤其是有糖尿病、肺部慢性疾病、血液病或化疗的免疫力低下的老年患者,更易导致菌群失调,使铜绿假单胞菌快速增殖引起呼吸道感染。据世界卫生组织(WHO)报道,临床上50%以上的老年人肺部感染的发病率和病死率与年龄成正比[10]。铜绿假单胞菌药物敏感性试验显示,氨基糖苷类药物耐药率最高,为47.22%,其次为喹诺酮类药物(30.56%)、第三代头孢菌素类(27.78%)、第四代头孢菌素(8.33%)、β-内酰胺类与酶抑制剂的复合制剂(8.33%),所有菌株均对碳青霉烯类药物敏感。
该实验菌株的耐药率不高,可能与老年患者处于铜绿假单胞菌的肺炎感染早期,未大量应用抗菌药物有关。
9种毒力基因研究中,除exoU外,其余8种基因均被检出。其中exoS、exoT、exoY的检出率高达100.00%,其次plcH、aprA、algD、toxA检出率均高达97.22%,pyo检出率亦达44.44%。exoS、exoT、exoU、exoY基因均表达胞外酶,这些胞外酶由铜绿假单胞菌Ⅲ型分泌系统转运到宿主细胞的细胞质中,最终抑制宿主免疫功能、干扰宿主细胞信号传导,引起感染发病[5];plcH基因表达溶血磷脂酶C,对宿主细胞的细胞膜有破坏作用[11];aprA基因表达碱性蛋白酶,对宿主具有灭活细胞因子、破坏免疫球蛋白及补体[12],起免疫抑制作用;algD基因表达胞外多糖,起抗吞噬作用[13];toxA基因表达外毒素抑制宿主细胞蛋白质合成;pyo基因表达铜绿假单胞菌螯铁蛋白,与宿主细胞竞争铁离子。铜绿假单胞菌中毒力基因的存在,使老年人呼吸系统生理组织结构发生改变,抑制了机体的免疫功能,进而加重了感染的进程。所以该研究铜绿假单胞菌毒力基因的高携带率与老年人的获得性肺炎关系密切。
23种抗菌药物耐药基因研究中,共检测出6种耐药基因,包括2种头孢菌素类耐药基因(blaCARB、blaDHA)和4种氨基糖苷类耐药基因[aac(6′)-Ⅰb、aac(6′)-Ⅱ、ant(3″)-Ⅰ、ant(2″)-Ⅰ],其中ant(2″)-Ⅰ的分离率最高,为27.78%,其次为blaCARB(25.00%)、aac(6′)-Ⅱ(25.00%)、aac(6′)-Ⅰb(22.22%)、blaDHA(8.33%)和ant(3″)-Ⅰ(8.33%)。氨基糖苷类耐药基因的分离率高于头孢菌素类,这与药敏试验中氨基糖苷类耐药率高于头孢菌素类呈正相关。所有菌株未携带blaIMP、blaVIM和blaNDM碳青霉烯类β-内酰胺酶基因,与对碳青霉烯类药物均敏感呈正相关。说明抗菌药物耐药情况与耐药基因的携带状况密切相关。
32种基因的携带状况研究显示,每株铜绿假单胞菌均携带5~8种毒力基因和0~4种耐药基因。其中15株只携带毒力基因,其余21株除携带6~8种毒力基因外,分别还携带1~4种耐药基因。本研究中毒力基因的携带率远高于耐药基因,所以推测出毒力基因是促使老年患者出现发热、咳嗽、影像学检查有炎症的主要原因。
铜绿假单胞菌临床分离株的耐药性发展迅猛,国内一直有耐碳青霉烯类菌株发现[2]。而国外则有学者报道从铜绿假单胞菌耐药株中发现新颖β-内酰胺酶基因(PME、FIM、NDM)[14,15]或发现β-内酰胺酶基因新亚型(TEM-116、GES-18、IMP-51、OXA-198、OXA-205)[16,17,18,19,20],并有报道铜绿假单胞菌亦可产原本为肺炎克雷伯菌特有的KPC型β-内酰胺酶[21]或可同时携带多种重要的耐药酶导致耐药程度加剧[22],甚至产NDM型β-内酰胺酶的铜绿假单胞菌对粘菌素也不敏感[23]。
对铜绿假单胞菌老年患者分离株进行9种毒力基因及23种耐药基因检测,能更好的分析老年患者感染病原菌的致病机理,本研究结果表明菌株携带的plcH等8种毒力基因是促使老年患者出现获得性肺炎的主要原因。该研究检测基因型有限以及实验地点和对象较为单一,后续将进一步扩大菌株数进行更为深入的研究。
所有作者均声明不存在利益冲突



























