
无论对于个体患者还是人群,癌症治疗的有效性都需要一种系统的、可重复的疗效评价方法。为满足这一需求,学界制定了一些评估疗效的指导原则,主要从解剖和代谢方面来量化治疗后的变化。过去几年针对特定的肿瘤组织制定了相应的疾病疗效分类标准。迄今为止,恶性淋巴瘤可能是疾病疗效分类应用最普遍的肿瘤类型。该文对现有的淋巴瘤疗效评价标准进行概述,重点介绍这些评价标准各自的方法及其适用性。针对阻碍疗效评价标准化发展的问题,该文也对其中许多标准的技术复杂度和主观阈值判定的内容进行了评述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴瘤是由淋巴组织增生而形成的异质性肿瘤,具有不同的临床表现和反应类型。通常分为霍奇金淋巴瘤(Hodgkin lymphoma, HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL),后者占绝大多数。HL侵袭性较弱,5年生存率较高,为85.3%[1]。2015年,在美国确诊为HL的患者有9 050例,其中1 150例最终死亡[2];相比之下,约有71 850例新诊断为NHL(包括几十个具有不同病因和预后的亚型)患者,其中19 790例死亡[2],5年生存率约为69.3%[1]。WHO指南根据细胞谱系将NHL分为成熟B细胞淋巴瘤、成熟T细胞淋巴瘤和NK细胞淋巴瘤[3]。弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是最常见的病理类型,其属于成熟B细胞淋巴瘤,约占所有NHL的40%[4]。
早在1661年就有医学文献提及淋巴瘤的结节性肿大[5],但"淋巴结和脾肿大、恶病质和最终致死"的关键特征是由Thomas Hodgkin在1832年首次提出的[6]。现代治疗的发生发展则在百年之后。在第二次世界大战时,Louis S. Goodman和Alfred Gilman发现士兵在接触芥子气后发生了明显的淋巴、骨髓抑制,这促使他们开始研究相关的复合物——氮芥对淋巴瘤和其他血液病患者的影响[7]。
即使对于早期的化疗药物,也需要一种客观的方法来评估其在人体内的有效性。最初是通过人工测量治疗前后的肿瘤大小来达到标准化目的。但随着解剖医学成像技术的发展,尤其是CT的出现,一系列新的疗效评价指南被陆续提出;而PET的功能信息经过整合可以补充CT的解剖学信息。目前,有许多单独依据CT和PET的标准及少数结合了这些成像模态的标准被用于评估实体瘤和血液恶性肿瘤的治疗效应(补充材料表1;所有补充材料见http://jnm.snm journals.org)。尽管最近对疗效评价标准进行了改进,但临床医师和研究者们在使用这些不同标准时仍有分歧。本文概述了现有的一些标准,尤其是标准之间的差别,并进一步呼吁大家用更统一的方法来进行疗效评价。

实体瘤疗效评价标准(RECIST)肿瘤疗效分类(2000年)
实体瘤疗效评价标准(RECIST)肿瘤疗效分类(2000年)
| 分类 | 标准 |
|---|---|
| 完全缓解 | 所有肿瘤消失≥4周 |
| 部分缓解 | 肿瘤缩小≥30%,持续时间>4周 |
| 疾病稳定 | 肿瘤缩小<30%或增大<20% |
| 疾病进展 | 肿瘤增大≥20% |
从第一代化疗药物出现的20世纪40年代到现代成像技术出现的20世纪70年代,治疗效应的客观、系统评价主要依赖于体格检查[8]。但触诊用于评价疗效不够精准,Moertel和Hanley[9]在1976年的研究中提到,16名肿瘤学家用"不同的临床方法"触诊并测量出了12个模拟肿瘤包块,若将"有疗效反应"定义为触诊肿瘤时在垂直径上减少25%和50%,则各有19%~25%和6.8%~7.8%的假阳性结果出现。
为实现"癌症疗效评价报告的标准化",WHO于1977年至1979年间举行了一系列会议,一本概述疗效评价标准手册的出现将会议推向了高潮,随后这一标准被广泛宣传并得到迅速应用[10,11]。该标准要求在治疗前后测量肿瘤二维大小,并通过多个病变位点的二维测量值计算并统计出1个单一参数来评估疗效。根据这些参数随时间的变化将患者分为4个反应组:完全缓解、部分缓解、疾病稳定和疾病进展(补充材料表2)。

实体瘤的PET疗效评价标准(PERCIST)肿瘤疗效分类(2009年)
实体瘤的PET疗效评价标准(PERCIST)肿瘤疗效分类(2009年)
| 分类 | 标准 |
|---|---|
| 完全缓解 | 可测量病灶的代谢活性下降到低于肝脏平均活性,与背景血池活性相当 |
| 部分缓解 | 可测量病灶的瘦体质量(SUL)峰值下降≥30%及下降0.8个SUL单位 |
| 疾病稳定 | 可测量病灶的SUL峰值下降或增加<30% |
| 疾病进展 | 可测量病灶的SUL峰值增加≥30%及增加0.8个SUL单位 |
尽管这些准则推动了疗效评价的标准化,但没有明确指出需要测量的肿瘤数量及可测量的最小尺寸等关键因素[12]。由于这些歧义以及影像学检查(如CT)的出现和应用,WHO标准被各研究机构和临床团队重新解读,以进一步促进并提高其标准化。
为了解决疗效评价逐渐分化的问题,美国国家癌症研究所和欧洲癌症研究与治疗组织(European Organization for Research and Treatment of Cancer, EORTC)在20世纪90年代重新审视WHO标准,目的是制定新准则来重新标准化疗效评价。1999年,EORTC从预显像患者的准备、图像采集和分析、肿瘤取样及疗效分类提出了方案[13]。这是第1个使用功能显像技术(即PET显像)作为疗效评价方法的指南(补充材料表3)。PET放射性显像剂18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)用于测定代谢活性和肿瘤侵袭性,可显示代谢活跃的肿瘤边界,便于深入了解个体的肿瘤生物学。这些对疗效的代谢分类方法为随后几年基于18F-FDG的相关标准奠定了基础。

国际工作组标准(IWC)肿瘤疗效评估分类(1999年)
国际工作组标准(IWC)肿瘤疗效评估分类(1999年)
| 分类 | 标准 |
|---|---|
| 完全缓解 | 所有临床和放射影像评估的病灶证据及疾病症状均消失 |
| 淋巴结结节的最大横截直径恢复到正常大小(治疗前>1.5 cm的,现≤1.5 cm;治疗前1.1~1.5 cm,现≤1 cm) | |
| 脾脏恢复正常大小,体格检查时不能触及 | |
| 先前阳性部位重复骨髓穿刺活组织检查结果阴性 | |
| 未证实完全缓解 | 符合完全缓解的标准,除了:存在>1.5 cm的残余淋巴结,其2个最大垂直径乘积之和(SPD)减少>75%骨髓穿刺结果不确定 |
| 部分缓解 | 6个最大淋巴结SPD减少≥50% |
| 其他淋巴结及肝、脾未增大 | |
| 肝、脾结节的SPD减少≥50% | |
| 没有新病灶出现 | |
| 疾病稳定 | 结果不符合部分缓解或疾病进展评价标准者 |
| 疾病进展 | 淋巴转移病灶SPD增加≥50% |
| 出现任何新病灶 |
治疗后发现的残留肿块通常源于炎性病变、坏死组织和纤维组织,而并非残余肿瘤,PET显像的引入有助于解决这一问题[14,15,16]。由于先前的标准只依靠解剖成像,所以PET显像对淋巴瘤的疗效评价显得尤为重要。大约40%的NHL患者和20%的HL患者在接受治疗后,CT图像上仍有残余的纵隔或腹部肿块[17,18]。通过手术证实,80%~95%的残余肿块在病理学上并非恶性[17,19]。此外,影像学发现残余肿块与疾病复发或存活时间并无关联[18]。因此,PET显像通过显示肿块代谢特征评估残余病变活性,弥补了CT对淋巴瘤疗效评价标准的局限性[20]。
2000年,EORTC制定了基于PET显像的疗效评价标准后不久,美国国家癌症研究所和EORTC合作,制定了一套基于CT显像的新标准,称为实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)[21]。不同于早期的解剖标准[11,22],RECIST是根据肿瘤最长径的CT一维测量值来评估肿瘤治疗效应,重复性好,更适合临床应用。RECIST还规定了各团队在使用WHO标准时产生分歧的参数:最大被测病灶数目设定为10个,每个器官最多有5个,病灶被测量的最小尺寸为1 cm。最后,RECIST重新定义了WHO标准的疗效分类(表1)。这些分类相对于WHO标准更严谨,其减少了"疾病进展"这一类别中患者的数量[21,23,24]。
然而,RECIST并非没有缺点。人们普遍认为,RECIST不适用于某些特定的肿瘤,例如间皮瘤和儿科肿瘤[23,25,26]。此外,RECIST中提出的需要测量的肿瘤数量和相对狭义的"疾病进展"概念是争论的焦点[27]。同时RECIST的临床应用将大大增加放射科医师的工作量[28]。
为解决上述问题,RECIST工作组开始修订标准,于2009年出版了"RECIST 1.1"[29]。为了进一步简化和阐明标准,同时也使其能更好地应用于其他癌症,工作组对先前标准进行了重大调整。首先,最大被测病灶数目减少至5个,每个器官最多2个。这一修正是因为有数据显示这样的减少不会导致重要信息的丢失[30]。第二,对"疾病进展"的定义进行了修正,要求被测量的肿瘤直径的总和最少增加5 mm,从而避免了个体微小病灶变化导致的不必要的分类进展。第三,为评估淋巴结受累制定了明确的指导原则,规定在短轴上至少跨越15 mm的结节作为可评估的靶病灶,淋巴结缩窄到低于10 mm则视为正常。最后,该标准为从功能显像技术(如PET)中获取信息铺平了道路。
同年(2009年),Wahl等[12]发表了一篇文章,概述了实体瘤的PET疗效评价标准(PET response criteria in solid tumors, PERCIST)。该标准遵循几个早期使用PET显像评估疗效的指南,包括EORTC[13]在1999年、Hicks等[31]在2001年、Juweid等[32,33]在2005年和2007年提出的指南。PERCIST使用了和RECIST相似的标准,但是将代谢信息与解剖信息相结合。Wahl等[12]认为CT本身只有"较弱的预测能力",因为通过这种模式检测到的瘢痕组织常被误认为是活动性肿瘤。基于PET的疗效评价标准,PERCIST旨在促进药物开发试验,但如果足够可靠的话,可用于个体患者。
在PERCIST报告中,Wahl等[12]定义了一组基于PET显像的疗效评价标准参数,其中包括18F-FDG高摄取的最多5个病灶、每个器官最多2个病灶用于治疗前后的比较。PERCIST建议患者在接受早期化疗至少10 d后再进行18F-FDG PET显像,以便最大限度地提高显像的预后预测价值,并减少放、化疗引起的炎性病变所致18F-FDG摄取升高的干扰。此外,还要求用瘦体质量(lean body mass, SUL)来校正PET显像得出的标准摄取值(standardized uptake value, SUV),同时设立对照,如肝脏或背景血池[12]。PERCIST保留了与RECIST相同的疗效四分类法,但改进了其具体参数(表2)。尽管尚未完全得到证实,但PERCIST越来越多地被应用于评价癌症疗效的临床试验中[34]。这些数据可能有助于其更为广泛地应用于临床。
虽然包括WHO标准、RECIST和PERCIST在内的指南适用于一系列广泛的癌症,但针对一些血液系统的恶性肿瘤有专门的标准。早在20世纪80年代末,随着针对慢性淋巴细胞白血病[35]、HL[36]和急性骨髓性白血病[37]的疗效评价标准的制定,有人呼吁对NHL也制定类似的标准[38]。然而,在随后的10年中,各单位只是根据已有的标准对NHL制定自己的疗效评价标准,这阻碍了不同单位间进行数据比较。
在1998年2月和5月由美国国家癌症研究所主办的会议上,一个由美国专家和欧洲专家组成的国际工作组对NHL的疗效评价标准达成了共识[39]。由此产生的国际工作组标准(International Working Criteria, IWC)定义了由临床或放射学检查获得的解剖参数,用于将患者分组到"完全缓解、部分缓解、疾病稳定和疾病进展"的传统分类及"未证实完全缓解"的新分类中(表3)。为了支持这些基于解剖学的标准,IWC根据先前的几个研究,将正常淋巴结短轴的上限限定为1 cm[40,41,42]。在此后的几年中,IWC也被应用于HL[43]。
2005年,Juweid等[32]综合了基于CT的IWC和18F-FDG PET显像创建了IWC+PET标准,最初是针对NHL制定并被验证的,后被证实也适用于HL[44]。研究人员利用普遍存在的治疗后残余肿块和PET独特的显像能力,准确地预测肿瘤的活性,试图建立一种结合CT解剖学信息和PET功能信息的标准化方法。IWC+PET标准保留了IWC的分类方法,又增加了PET显像结果(补充材料表4)。Juweid等[32]发现对于NHL患者,IWC+PET标准较IWC能更好地预测无进展生存期。
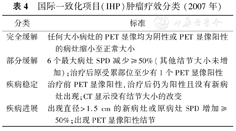
国际一致化项目(IHP)肿瘤疗效分类(2007年)
国际一致化项目(IHP)肿瘤疗效分类(2007年)
| 分类 | 标准 |
|---|---|
| 完全缓解 | 任何大小病灶的PET显像均为阴性或PET显像阳性的病灶缩小至正常大小 |
| 部分缓解 | 6个最大病灶SPD减少≥50%(其他结节大小未增加);治疗后原受累部位至少有1个PET显像阳性 |
| 疾病稳定 | 治疗前PET显像阳性,治疗后仍为阳性且没有新病灶出现;CT显示没有结节大小的改变 |
| 疾病进展 | 出现直径>1.5 cm的新病灶或原病灶SPD增加≥50%;出现PET显像阳性结节 |
2007年,由Cheson等[45]和Juweid等[33]修订了IWC+PET标准,并建议将其作为HL和NHL临床应用中的国际一致化项目(International Harmonization Project, IHP)。治疗引起的炎性反应可持续到化疗后2周和放疗后3个月,为了避免这种炎性反应所引起的假阳性,2份报告均建议至少在化疗后3周(6~8周更好)、放疗后8~12周再行PET显像。Cheson等[45]报道因"胸腺增生、感染、炎性病变、结节病和棕色脂肪"以及"(空间)分辨率,技术"和"各组织对18F-FDG亲和力的不同"而导致PET显像出现假阳性。为了评估最大垂直径大于2 cm剩余肿块的生存能力,推荐参考纵隔血池活性。而对于小于2 cm的剩余肿块,推荐参考背景活性。对于CT上发现的超过1.5 cm的肝脾病变,若其代谢活动高于正常肝脾,则视为阳性。此修正方案建议去除"未证实的完全缓解"类别,将分类方法回到典型的"完全缓解、部分缓解、疾病稳定和疾病进展"(表4)。
2009年在法国多维尔举行的第一次国际研讨会对HL和NHL提出了新的标准,这标志着多方面的重大变化[46,47,48,49]。与之前提出的以定量指标为主的指南相比,Deauville 5点评分系统(Deauville 5-point scoring system, D5PS)对治疗反应进行定性评估。具体来说,D5PS是将18F-FDG摄取强度与纵隔血池和肝脏活性相比较(表5)[50]。这种分类系统简便,促进了其在临床上的广泛应用。此外,D5PS成了治疗期间评估疗效趋势的标准,便于及时调整治疗方案,提高其预后。

Deauville 5点评分系统(D5PS)的肿瘤疗效评估分类(2009年)
Deauville 5点评分系统(D5PS)的肿瘤疗效评估分类(2009年)
| 分类 | 标准 |
|---|---|
| 1 | 无摄取>背景活性 |
| 2 | 摄取≤纵隔血池活性 |
| 3 | 摄取在纵隔血池活性和肝活性之间 |
| 4 | 中等度摄取>肝活性 |
| 5 | 显著摄取>肝活性 |
在2011年第11届恶性淋巴瘤国际会议上关于D5PS提出了一套综合建议,并最终于2012年在法国芒通召开的第4届淋巴瘤PET显像国际研讨会和2013年在瑞士卢加诺召开的第12届恶性淋巴瘤国际会议上进行了修改[51,52]。对分期标准和2007年IHP标准的一致修订使得卢加诺分类标准得到了发展。卢加诺分类标准分别针对PET和CT成像提出了不同的反应标准,前者一般更适用于对18F-FDG高亲和性淋巴瘤。以PET显像为基础的标准在D5PS基础上增加了新发或复发性淋巴结累及、骨髓侵犯以及脏器肿大(表6)[53]。而单独基于CT的标准尽管对18F-FDG高亲和的淋巴瘤的解剖学疗效评价有一定局限性,但当PET/CT显像不可用或当淋巴瘤对FDG亲和力低或不定时,也可使用解剖学疗效评价。

卢加诺标准的肿瘤疗效评估分类(2014年)
卢加诺标准的肿瘤疗效评估分类(2014年)
| 分类 | 基于PET/CT的标准 | 基于CT的标准 |
|---|---|---|
| 完全缓解 | D5PS评分1、2或3分无新病灶无骨髓浸润 | 最大横截直径>1.5 cm肿大的器官缩小到正常大小无新病灶无骨髓浸润 |
| 部分缓解 | D5PS评分4或5分与基线相比,摄取减低无新病灶与基线相比,骨髓残留并摄取减低 | 与基线相比,最多6个淋巴结的垂直径之和缩小>50%肿大的脾脏较基线缩小>50%无新病灶 |
| 病情稳定 | D5PS评分4或5分与基线相比,病灶摄取无变化无新病灶骨髓受累无变化 | 与基线相比,最多6个淋巴结的垂直直径之和缩小<50%无新病灶 |
| 病情进展 | D5PS评分4或5分与基线相比,病灶摄取增加淋巴结和骨髓新发或复发高FDG摄取病灶 | 淋巴结垂直径增长>50%淋巴结直径增长(淋巴结<2 cm时增长0.5 cm;如果>2 cm,则增长1.0 cm)新发或复发脾脏重大淋巴结或骨髓新发或复发 |
注:D5PS为Deauville 5点评分系统
文中讨论的各种疗效评价标准应用不同的方法来进行显像。RECIST和1999年IWC标准主要应用了CT;EORTC和PERCIST应用了PET;2007年IHP和卢加诺分类这2种模式均有应用,但对于PET图像的解释,前者使用了IHP标准,后者则采用D5PS标准。这些标准对反应分类的不同定义如表7所示,包括4组分类:完全缓解、部分缓解、疾病稳定和疾病进展。尽管在各种标准之间存在着可识别的变化趋势,但即使使用相同模式,每组反应分类的阈值也有较大变化。如"疾病进展"的定义,RECIST为肿瘤大小增加至少20%,WHO标准为25%,IHP则为50%。

多个疗效评估标准的简化分类比较
多个疗效评估标准的简化分类比较
| 标准 | 分类 | |||
|---|---|---|---|---|
| 完全缓解(CR) | 部分缓解(PR) | 疾病稳定(SD) | 疾病进展(PD) | |
| WHO | 肿瘤消失 | 肿瘤大小缩小≥50% | 肿瘤大小缩小≥25%且≤50% | 肿瘤大小增加≥25% |
| EORTC | 18F-FDG摄取减小至背景水平 | 18F-FDG摄取减小≥15% | 18F-FDG摄取减小≤15%且增加≤25% | 18F-FDG摄取增加≥25% |
| RECIST | 肿瘤消失 | 肿瘤大小缩小≥30% | 肿瘤大小缩小≤30%且增加≤20% | 肿瘤大小增加≥20% |
| PERCIST | 18F-FDG摄取减小至背景血池水平 | SUL峰减小≥30% | SUL峰减小或增加≤30% | SUL峰增加≥20% |
| IWC | 病灶缩小至正常大小 | 6个最大病灶缩小≥50% | 病灶缩小或扩大≤50% | 病灶扩大≥50% |
| IWC+PET | IWC的CR + PET显像阴性 | IWC的CR/PR+PET显像阳性 | IWC的SD + PET显像阳性 | IWC的PD+ PET显像阳性 |
| IHP | PET显像阴性病灶或PET显像阳性的正常大小病灶 | 6个最大病灶缩小≥50% | 新出现PET显像阳性病灶 | PET显像示新病灶≥1.5 cm或原病灶扩大≥50% |
| D5PS | 18F-FDG摄取减小至背景水平 | 18F-FDG摄取≤纵隔血池/肝脏活性 | 纵隔血池活性≤18F-FDG摄取≤肝活性 | 18F-FDG摄取>肝活性 |
| Lugano | ||||
| PET/CT | 18F-FDG摄取正常(D5PS 1~3分) | 18F-FDG摄取减小(D5PS 4~5分) | 18F-FDG摄取不变(D5PS 4~5分) | 18F-FDG摄取增加(D5PS 4~5分)+出现新病灶 |
| CT | 病灶或组织缩小至正常大小 | 最多6个病灶(脾)缩小≥50% | 最多6个病灶缩小<50% | 病灶扩大≥50%+出现新病灶 |
注:D5PS中的5分与4分类中CR、PR、SD、PD的对应关系(1分=CR, 2分=PR, 3分=SD, 4/5分=PD);EORTC为欧洲癌症研究与治疗组织,FDG为脱氧葡萄糖,IHP为国际一致化项目,IWC为国际工作组标准,Lugano为卢加诺,PERCIST为实体瘤的PET疗效评价标准,RECIST为实体瘤疗效评价标准,SUL为瘦体质量
近年来,相对简便的D5PS标准和卢加诺分类逐渐被应用于临床。相对而言,之前的定量标准因其技术要求和复杂性阻碍了其在临床的广泛应用。然而,关于简化定性标准的可重复性问题仍然存在。既往研究将D5PS和其他使用功能显像进行疗效评价的指南进行了比较。2010年Horning等[54]对DLBCL患者进行了研究,比较了分别基于D5PS标准和IHP标准的东方合作肿瘤学组织标准的观察者间一致性,其κ值分别为0.502和0.445。但该研究仅限于一小部分研究人群。另一项关于DLBCL的研究中,Itti等[55]发现,D5PS(κ=0.66)与其相对应的基于最大标准摄取值(maximum standardized uptake value, SUVmax)的半定量标准(κ=0.83)相比一致性较低。Barrington等[56]、Furth等[57]和Gallamini等[58]应用D5PS标准对HL进行了大样本的标准化研究,得出的κ值分别为0.79~0.85、0.748和0.69~0.84,证明了D5PS标准的优越性。这些研究结果对卢加诺分类的可重复性和临床适用性的影响还有待大样本的前瞻性研究确定。
最近出现并被采用的D5PS标准和卢加诺分类向标准化迈进了一步,带来了相对更客观的评价体系。然而这种定性疗效评价系统也应与量化标准进行对照,以确保其在患者管理中的相对有效性。在早期研究中,Lin等[59]就简单性和可重复性间的平衡进行研究,比较了PET显像定性和定量指标对DLBCL患者的预后能力。视觉分析预测无事件生存率的准确性为65.2%,而基于SUVmax的分析准确性为76.1%。治疗进行PET显像时SUVmax减少65.7%是区分治疗有效和无效的最佳阈值。早期结果表明,如果对临床应用进行优化,使用定量方法对PET进行标准化更适用于肿瘤疗效评价。然而,以往研究的回顾性设计中存在各种偏差和不够理想的技术方法,所以很难得出明确结论。此外,在未来研究中,多种因素(包括仪器误差、扫描仪校准和人体生物学因素)使得在医疗中心获得可靠的PET测量数据变得复杂[34]。因此,可重复性最强的、最准确的PET定量方法尚有待确定。随着自动分割和定量化技术的不断改进,这些进展可能更容易在临床环境中实现,并促进定量疗效评价的使用。
过去的60年里,用于癌症疗效评价的技术在精确性和复杂性上都得到了稳步提升,从粗略的手工测量到更复杂的结构和功能数据采集,许多更先进的技术正逐步发展起来,如异质性检测、参数映射、动态采集。特别是CT和PET相结合,大大增强评估对疾病进展、及时调整治疗方案及准确判断预后的能力。然而各种指南层出不穷,每个都有自己的标准和阈值,这引发了大家对统一标准的呼吁。
特别是在淋巴瘤方面,最近基于PET/CT的标准已经在标准化方面取得了显著进展,而简化的定性指导标准改善了之前定量标准在临床应用中遇到的技术复杂性和时间强度问题。然而,它们在某些情况下是否适用还有待证实,如对18F-FDG亲和力低或亲和力可变的淋巴瘤、接受免疫化疗或生物治疗的患者。此外,技术的进步简化了量化标准,为避免疗效评价再次出现分化,保持其统一性十分必要。



























