
长QT间期综合征(long QT syndrome,LQTS)是一种罕见且致死性较高、具有遗传性质的离子通道型疾病,病因为编码离子通道或亚单位的基因突变,特点为QTc间期延长及频发恶性心律失常。因为一些胎儿LQTS可能导致胎死宫内或新生儿时期死亡,所以产前怀疑或诊治及管理胎儿LQTS,不仅可能降低患胎生命危险,而且可能改善患儿出生后的生存质量及预后,现就胎儿期LQTS的诊治及管理进展进行讨论。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
长QT间期综合征(long QT syndrome,LQTS)是一种致死性较高且具有遗传性质的离子通道型疾病,可呈家族性发病[1,2,3,4,5,6,7]。诊断LQTS的标准主要包括QT间期延长(QTc>450 ms)及基因检测。本病在青少年或青年表现为心律失常、晕厥、心脏骤停或猝死[8,9,10,11]。在胎儿和新生儿期诊断胎儿LQTS并不常见,其在白种活产儿中的发病率为12 500~12 000,我国活产儿发病率并未统计[5,8,12,13,14]。罹患LQTS的胎儿,可能因出现尖端扭转型室性心动过速(torsades de pointes,Tdp)和/或无法解释的Ⅱ度房室传导阻滞(atrioventricular heart block Ⅱ,AVBⅡ)等特征性心律,导致胎儿脐血流和体循环速度下降,胎儿脏器灌注不足,引起心力衰竭、胎儿水肿或围生期死亡的风险[3,4,12,15,16,17],而在宫内诊断的患胎出生6个月的病死率可高达50%[9,12,18,19,20]。据文献报道,LQTS患儿与婴儿猝死综合征(sudden infant death syndrome,SIDS)有密切联系[12,16,18,21,22,23],占SIDS病因构成比为9%~10%[2,9,21]。现就胎儿LQTS的病理生理、临床表现、产前诊治等方面进行总结,希望能为目前胎儿的产前诊治及管理提供参考。
LQTS的病理生理基础是心肌细胞的离子通道异常,如控制钠、钾或钙离子通道和或亚单位的基因发生突变而引起钠通道失活延迟或钾离子外流延缓,引起心肌细胞复极时间延长,产生早期后除极和复极离散程度增加,从而导致Tdp等严重心律失常的发生[3,5,10,12,23,24,25,26]。随着分子遗传学的发展,大部分遗传性LQTS的突变基因被逐渐阐明,且基因型与表型之间的关系也逐渐明确。从1995年首次发现与LQTS亚型中LQTS1型、LQTS2型、LQTS3型关系密切的KCNQ1、KCNH2、SCN5A基因之后,与LQTS4~LQTS13型关系密切的基因也相继被研究发现。其中,LQTS1~3型所占比例较大,且表现为SCN5A和KCNH2基因型的患胎在出生后病情较重[1,4,27]。其他亚型比例较少,多数在成年期发作。先天性LQTS分型见表1。
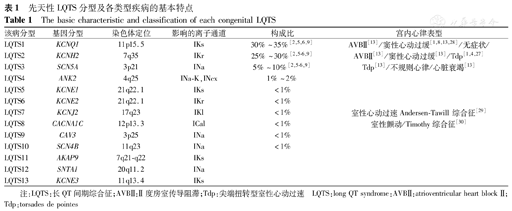
先天性LQTS分型及各类型疾病的基本特点
The basic characteristic and classification of each congenital LQTS
先天性LQTS分型及各类型疾病的基本特点
The basic characteristic and classification of each congenital LQTS
| 该病分型 | 基因分型 | 染色体定位 | 影响的离子通道 | 构成比 | 宫内心律表型 |
|---|---|---|---|---|---|
| LQTS1 | KCNQ1 | 11p15.5 | IKs | 30%~35%[2,5,6,9] | AVBⅡ[13]/窦性心动过缓[1,8,13,28]/无症状/ |
| LQTS2 | KCNH2 | 7q35 | IKr | 25%~30%[2,5,6,9] | AVBⅡ[13]/窦性心动过缓[13]/Tdp[1,4,27] |
| LQTS3 | SCN5A | 3p21 | INa | 5%~10%[2,5,6,9] | Tdp[13]/不规则心律/心脏衰竭[13] |
| LQTS4 | ANK2 | 4q25 | INa-K,INcx | 1%~2% | |
| LQTS5 | KCNE1 | 21q22.1 | IKs | <1% | |
| LQTS6 | KCNE2 | 21q22.1 | IKr | <1% | |
| LQTS7 | KCNJ2 | 17q23 | IKl | <1% | 室性心动过速Andersen-Tawill综合征[29] |
| LQTS8 | CACNA1C | 12p13.3 | ICal | <1% | 室性颤动/Timothy综合征[30] |
| LQTS9 | CAV3 | 3p25 | INa | <1% | |
| LQTS10 | SCN4B | 11q23 | INa | <1% | |
| LQTS11 | AKAP9 | 7q21-q22 | IKs | ||
| LQTS12 | SNTA1 | 20q11.2 | INa | ||
| LQTS13 | KCNE3 | 11q13.4 | IKs |
注:LQTS:长QT间期综合征;AVBⅡ:Ⅱ度房室传导阻滞;Tdp:尖端扭转型室性心动过速 LQTS:long QT syndrome:AVBⅡ:atrioventricular heart block Ⅱ;Tdp:torsades de pointes
胎儿LQTS的实验室检查方法包括胎儿心电图(fetal electrocardiogram,fECG)、胎儿超声心动图(fetal echocardiography,fUCG)和胎儿心磁图(fetal magnetocardiogram,fMCG)等。fECG可直接准确地反映胎儿心脏电活动,但由于经孕母腹壁外监测常会被母亲心电活动影响,并且还受母亲腹壁脂肪、子宫壁、羊水等信号干扰,因此在LQTS胎儿中,诊断效果并不理想。fUCG是评估胎儿是否发生心律失常的首要诊断工具,但并不是LQTS产前诊断的最佳工具。fUCG不能直接测量QT间期,但其可通过M型超声、彩色多普勒等发现二尖瓣流出道早期速度下降,通过等容收缩期(ICT)和或等容舒张期时间(IRT)的变化评估胎儿心脏节律是否有异常[12,31],并且可以用fUCG进行Tei指数和心血管评分系统(cardial vascular points-scoring system,CVPS)对胎儿进行功能评价和预后评估[32]。fMCG作为一种新型的无侵入检查手段,在孕中期至足月通过记录胎儿和母亲心脏电流产生的电磁场,不受母亲腹壁脂肪和羊水等信号的干扰,从而输出精确的电生理数据,包括心动周期变化、QRS间期、PR间期、RR间期和QT间期等,并且可以评价去极化和复极化异常[4,22]。Cuneo等[33]发现通过fMCG评价矫正QTc间期,T波形态,复极特征等,可以发现不同严重程度的胎儿LQTS及基因类型,而且可以根据节律表型差异和QTc间期长短规划不同的胎儿管理,以及在预测患胎发生Tdp方面有不可替代的价值。另外,fMCG可以监测宫内药物治疗LQTS胎儿的疗效,评价是否恢复至窦性节律[16]。唯一不足的是,该诊断技术不仅需要在具有磁场性质的隔离房间中进行操作,而且噪音很大、价格昂贵,所以该技术仅用于研究或仅在较少地区使用,尚未广泛普及[7]。
提示胎儿LQTS的征象包括胸腔积液、水肿、母亲自身免疫性抗体阴性且心脏结构正常的房室传导阻滞、TdP、心动过缓等[1,2,12,16,18,23,24]。当胎儿出现以上征象时,在仔细询问家族史之外,可通过fUCG初步评估胎儿心脏功能,检查心律有无异常,后可借助fMCG进行诊断及预后研究。据Cuneo等[33]报道,当fMCG测量胎儿QTc>490 ms时,可进行宫内LQTS筛查;QTc≥620 ms时,胎儿易发生Tdp等严重心律失常。
在胎儿无LQTS家族史的背景下,怀疑胎儿可能罹患LQTS主要基于一些非特异临床症状,如频繁发生心动过缓及心动过速[2,8,12,27],但仅极少数胎儿可能表现出不规则心律,如Tdp和/或AVBⅡ[13,24],大部分患儿仅表现为心动过缓或无症状[4,7,10,12,24,27,28],此时诊断胎儿LQTS是最困难的。有研究通过分析患胎的胎心率(fetal heart rate,FHR),发现相比于产科心动过缓的标准(FHR≤110次/min)[2,4,7,8,28],使用FHR小于或等于同胎龄FHR的第3百分位(FHR≤3rd%)标准时,诊断胎儿LQTS的准确率从15%提高到了85%[8]。研究表明,仅有小部分患胎FHR符合产科心动过缓的标准,大部分患胎FHR≤3rd%。因此,当孕母进行常规孕期检查时,若发现FHR≤110次/min或FHR≤3rd%时,应进行针对胎儿的超声心动图检查,以免漏诊胎儿心脏疾病[8,28]。
对于因发生AVBⅡ而怀疑LQTS的胎儿来说,首先需要筛查母亲血清中是否存在抗干燥综合征A抗原(SSA/Ro)抗体、抗干燥综合征B抗原(SSB/La)抗体、抗核糖体蛋白抗体(抗RNP)、抗核抗体(ANA)或抗双链-DNA抗体(抗Sm抗体)等[12,31,34]。约85%的AVB患儿与母亲自身免疫性疾病有关[35]。有文献表明,孕妇若患自身结缔组织病、系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(Sjogren′s syndrome,SjS)等,其血清中的抗SSA/Ro、抗SSB/La抗体可通过胎盘而沉积在胎儿心肌组织中,发生炎性反应,以传导系统表现最为明显[18]。当胎儿发生与免疫相关的缓慢型心律失常时,可通过测量矫正QT间期而明确胎儿是否发生LQTS,然后进行综合评估治疗。若胎儿出现间断性AVB和窦性心动过缓,而母亲经检查自身免疫性抗体为阴性且心脏结构正常,此时要考虑怀疑胎儿LQTS的诊断[36]。
胎儿室性心动过速较罕见,占产前心律失常的比例不足1%,在发现有房室分离且有较快的室性心率时,有助于诊断室性心动过速[4,18,26,31,37]。如胎儿发生室性心动过速,特别是Tdp或多形性室性心动过速,经胎儿超声心动图检查并未发现原发性心肌疾病或心脏肿瘤等心脏器质性疾病时,即使无LQTS家族史,仍要怀疑胎儿LQTS的诊断[36],并且要密切观察孕母,适时进行治疗,防止胎儿出现水肿、心力衰竭等危害胎儿生命的征象[12,24]。在胎儿LQTS中,Tdp易继发于QRS波电交替,T波电交替(T-wave alternans,TWA),而这些复极异常形态常与严重的胎儿LQTS表型相关[33]。
目前临床监测发现,怀疑胎儿LQTS的产前高危因素主要有:(1)FHR≤3rd%;(2)胎儿出现AVBⅡ,窦性心动过缓等缓慢型心律失常;(3)胎儿出现Tdp或多形性室速等快速型心律失常;(4)有LQTS或晕厥、猝死家族史;(5)fQTc>490 ms且fMCG出现QRS波电交替,TWA,T波峰值延迟出现,T波驼峰等复极形态异常。若胎儿出现以上危险因素可能会增加胎儿LQTS的可能性。
诊断胎儿LQTS极具挑战性,目前仅有不足1/3的患胎可在宫内确诊为LQTS[27]。但随着对LQTS疾病的逐步认识和诊断技术的快速发展,可以运用抗心律失常药物对宫内患胎进行干预,从而延缓胎儿LQTS的发展。
(1)如果胎儿在无心力衰竭征象的前提下,发生FHR≤3rd%或AVBⅡ(孕母血清抗SSA/Ro、抗SSB/La抗体阴性)或一过性室性心动过速,那么孕母仅需要门诊定期随访,密切观察胎儿,防止Tdp等恶性心律失常的发生[12,18,20]。
(2)对于胎龄≤36周的胎儿,若心室率>200次/min,或出现水肿等心血管失代偿现象时,应紧急控制心动过速,一线治疗推荐孕母短期静脉注射镁剂,其他治疗包括静脉注射利多卡因,孕母口服美西律、普萘洛尔等[31,37],以降低早产风险,并有助于减少在早产儿中装置除颤仪(implantable automatic defibrillator,ICD)或起搏器(permanent pacemaker implantation,PMI),降低患胎出生后病死率[16]。
(3)对于严重的心律失常患胎,如果胎儿已有足够的肺成熟度,应提前分娩并在出生后治疗心动过速[38]。
(4)对于产前确定基因型的患胎,如LQTS1型和LQTS2型,经胎盘转运使用β受体阻滞剂是首选方案。对于LQTS3型,应首选美西律和利多卡因等钠离子通道阻滞剂、镁剂[1,15]。如果LQTS3型患胎发生间断性Tdp,且无心力衰竭,可以考虑使用β受体阻滞剂治疗[3,4,23],然而β受体阻滞剂治疗患胎的疗效较低,有效率为25%~30%[39],因此需要权衡利弊后使用。
(5)如果患胎出生后在抗心律失常药物治疗下仍发生AVBⅡ和/或心动过缓,则在权衡利弊之后应该安装PMI[1],若频发顽固性室性心动过速,则应考虑安装ICD[1,17]。
(6)推荐有LQTS家族史的孕母常规监测胎儿心律,孕母血清镁、维生素D、钙浓度应维持在保持窦性节律水平。禁止使用延长QT间期的药物,如胺碘酮、氟卡尼、索他洛尔、红霉素、昂丹司琼、催产素等。建议在拥有经验丰富的心脏电生理专家和儿科心脏专家的心脏中心接生,并在产后进行ECG和LQTS突变基因的相关检查[4,27],以便于更为准确地针对治疗,提高治疗效果[4]。
通过基因手段确诊LQTS基因型是最可靠的方法,根据不同基因型个体化治疗患胎,以及依照基因型-表型进行风险分层确定治疗手段是目前研究的重点,对评估胎儿LQTS的诊断、治疗和管理方面,起到越来越重要的作用[5]。
虽然LQTS疾病通过基因测定获得诊断已经相对比较成熟,但基因诊断不明确的仍占25%~30%[5,12,25]。而且使用羊水穿刺或经皮脐动脉穿刺获得胎儿细胞进行LQTS患儿的基因诊断,不但风险高、价格昂贵,且并未大范围开展,因此并不作为胎儿常规检查[4]。但是随着现代医学高端技术的发展及基因研究的深化,遗传性LQTS的基因诊断和基因治疗可能会成为一种趋势,而在未来得以推广和使用。
所有作者均声明不存在利益冲突



























