
免疫性血小板减少症(ITP)为一种获得性自身免疫性出血性疾病,该病以患者对自身抗原的免疫失耐受导致免疫介导的血小板破坏增多与生成不足为特征。近年来,研究发现调节性T细胞(Treg)、调节性B细胞(Breg)等免疫抑制性细胞亚群数量和(或)功能的异常,在ITP的发生、发展中发挥重要作用。阐明Treg、Breg与ITP发病的关系,有望为ITP的治疗提供新思路。因此,笔者拟就Treg与Breg的免疫调节机制,及其在ITP发病机制中的作用的研究进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫性血小板减少症(immune thrombocytopenia,ITP)是由体液免疫与细胞免疫介导的血小板过度破坏与生成受抑制,导致血小板数量减少,伴或者不伴皮肤黏膜出血的一类获得性自身免疫性出血性疾病。传统观点认为,ITP患者血小板减少是由于机体体液免疫异常,B细胞产生大量血小板抗体,介导血小板被单核吞噬细胞系统破坏所致[1]。近年来,相关研究发现,细胞免疫异常亦参与了ITP的发病,特别是免疫抑制性细胞调节性T细胞(regulatory T cell,Treg)与调节性B细胞(regulatory B cell,Breg)数量和(或)功能的异常,在ITP发病的免疫调节机制中具有重要作用[1,2]。阐明Treg、Breg与ITP发病的关系有望为ITP治疗提供新思路,因此笔者拟就近年国内、外关于Treg与Breg的免疫调节机制,及其二者在ITP发病机制中的作用的研究进展进行综述如下。
1995年,Sakaguchi等[3]发现,在健康个体与小鼠的外周血与脾组织中,5%~10%的CD4+ T细胞持续高表达CD25,被称为CD4+ CD25+ Treg。Treg为一类具有免疫负向调节功能的CD4+ T细胞亚群,主要分为以下6种亚型,包括天然型调节性T细胞(natural regulatory T cell,nTreg),诱导型调节性T细胞(induced regulatory T cell,iTreg),外周衍生的调节性T细胞(peripherally-derived regulatory T cell,pTreg),1型调节性T细胞(type 1 regulatory T cell,Tr1),3型辅助性T细胞(type 3 helper T cell,Th3)及CD8+ Treg[4]。其中,目前研究最多的是来源于胸腺的nTreg与由外周幼稚T细胞诱导分化而成的iTreg。
目前,Treg发挥免疫抑制作用的机制尚未完全阐明,迄今为止学者已经提出了以下4种不同机制[5,6]。①通过分泌转化生长因子(transforming growth factor,TGF)-β,白细胞介素(interleukin,IL)-10,以及IL-35等免疫抑制性细胞因子发挥作用;②通过分泌穿孔素与颗粒酶A,对活化的效应T细胞发挥直接细胞毒性作用;③通过细胞表面免疫抑制分子,如细胞毒性T淋巴细胞抗原(cytotoxic T lymphocyte-associated protein,CTLA)4与Fas配体,使效应T细胞失活;④Treg与效应CD4+ T细胞,抗原呈递细胞(antigen presenting cell,APC)之间的相互作用抑制免疫应答。Treg对维持外周免疫耐受至关重要,其数量或者功能缺陷在自身免疫性疾病的发生、发展中发挥重要作用。
神经纤毛蛋白(neuropilin,NRP)-1为表达于多种免疫细胞表面的跨膜蛋白,参与血管和神经元的发育。有研究者认为,NRP-1表达于CD4+ CD25+ Treg,是较细胞内转录因子叉头框蛋白(folkhead box protein,Foxp)3特异性更强的CD4+ CD25+ Treg的表面标志物[7]。但是亦有学者认为NRP-1并非Foxp3+ Treg的特异性标志物[8]。NRP-1选择性表达于小鼠胸腺来源的Treg表面,并且被鉴定为小鼠Treg的特异性标志物,能够增强免疫抑制功能,该蛋白在小鼠体内的Treg表面表达水平显著上调,但是在其他T细胞亚群中其表达水平则下调[7]。Milpied等[8]发现,人类FoxP3+ Treg无特异性NRP-1表达,在人类次级淋巴器官中能够检测到Foxp3- NRP1+ T细胞亚群,并且在体外采用CD3/CD28抗体活化能够诱导外周血T细胞表达NRP1。Battaglia等[9]研究发现,NRP1+ Treg数量的增加与淋巴结中Treg表面CD25表达水平增加相关。与外周血Treg相比,从次级淋巴组织分离的Treg表面NRP1的高表达及其与活化标志物CD25的共表达,可能与T细胞活化程度的增加相关[9]。但是,向体外培养的NRP1+ Treg中加入NRP-1单克隆抗体并未显著影响NRP1+ Treg的免疫抑制活性[9]。然而,在小鼠实验中,NRP-1单克隆抗体可以显著减弱了Treg的免疫抑制功能[7]。上述研究结果再次强调了小鼠与人类NRP-1功能的不同。目前,关于NRP1是否可以作为人类Treg的特异性标志物尚存在争议。NRP-1对于维持外周免疫耐受至关重要,其缺失可导致自身免疫性疾病的发生,然而NRP-1在自身免疫免疫性疾病中的作用机制,以及与Treg的关系仍不清楚,值得进一步深入研究。目前,国内、外尚未见关于NRP1在ITP患者中作用的研究报道。
ITP为器官特异性自身免疫性疾病,近年越来越多的研究发现Treg在ITP的发病中发挥重要作用。Aboul-Fotoh等[10]研究发现,30例ITP患者Treg数量减少程度与ITP的疾病严重程度相关;与健康对照组(n=15)比较,ITP急性期患者的Treg数量显著减少,完全缓解(complete remission,CR)期患者显著增多,并且差异均有统计学意义(P<0.000 1)。这提示,Treg数量的减少可能是导致ITP患者免疫调节功能失调的机制之一。此外,有研究发现,免疫抑制剂治疗可以使非缓解期ITP患者Treg数量增加,但是接受治疗后ITP患者发生耐药的风险高,这提示存在导致ITP耐药的其他因素[11]。文瑞婷等[12]研究结果显示,34例ITP患者外周血中Treg(CD4+ CD25+ FoxP3+ T细胞)的比例较健康个体显著减少,并且差异有统计学意义(P<0.01)。上述研究结果的差异可能是由于不同的研究对Treg免疫表型的定义不同所致。Yu等[13]将CD4+ CD25high FoxP3+细胞定义为Treg,研究结果发现,慢性ITP患者的Treg数量与健康个体比较,差异无统计学意义(P>0.05);但是体外实验结果发现,ITP患者Treg的免疫抑制活性减低为健康个体的50%。Stasi等[14]采用CD4+ FoxP3+作为Treg的免疫标志物,结果发现慢性ITP患者的Treg数量较健康个体明显减少,并且伴有免疫抑制活性受损,经利妥昔单抗(1种人鼠嵌合抗CD20单克隆抗体,与B细胞表面的CD20结合,引发B细胞溶解的免疫反应)治疗后Treg数量与免疫调节功能恢复。有研究发现,与健康个体相比,ITP患者Treg分泌IL-10的水平明显降低,IL-10体外处理能够增强Treg对效应T细胞的抑制作用,而抗IL-10处理能够促进效应T细胞与辅助性T细胞(helper T cell,Th)17的增殖[15]。这表明,Treg对效应T细胞的抑制作用主要用过IL-10发挥作用,IL-10的分泌不足损害了ITP患者Treg对效应T细胞的抑制能力。
Th17/Treg失衡亦参与ITP的发病。有研究报道,ITP患者存在CD16+单核细胞数量增多,并且其与CD4+ γ干扰素+ T细胞数量呈正相关关系,与Treg及Th17数量呈负相关关系;此外,CD16+单核细胞与T细胞体外共培养实验结果证实,ITP患者CD16+单核细胞可以刺激Th1扩增,同时抑制Treg与Th17的增殖[16]。这提示,恢复Th17/Treg平衡可能为ITP治疗的潜在靶点之一。
Breg为一类具有免疫抑制功能的B细胞亚群,主要通过产生IL-10、-35,TGF-β等免疫调节因子介导机体免疫耐受,发挥免疫调节作用[17]。近年来,随着相关研究的开展,研究者已经鉴定出多种Breg亚型。但是无论是在动物还是在人类中,均尚未发现明确的Breg特异性标志物及特异性转录因子。目前在小鼠中,Breg的亚型主要包括过渡2期-边缘区前体B细胞(transitional 2-marginal zone precursor,T2-MZP),边缘区B细胞(marginal zone B cell,MZ B细胞),B10细胞,CD138+浆细胞,浆母细胞,T细胞免疫球蛋白黏蛋白分子(T-cell immunoglobulin mucin domain,TIM)-1+ B细胞,CD5+ CD178+杀伤性B细胞及程序性死亡受体-配体(programmed death receptor-ligand,PD-L)1high B细胞等[15,16]。在人类中,Breg亚型主要包括未成熟B细胞,B10细胞,1型调节性B细胞(type 1 regulatory B cell,Br1),颗粒酶B+ B细胞及浆母细胞等[17,18](表1)。不同的Breg亚型具有不同的免疫学表型,并且其发挥免疫抑制作用的机制亦不同,因此在疾病的发生、发展中发挥了不同的作用。深入了解其作用机制,有望为基于Breg为靶点的疾病治疗提供新思路。
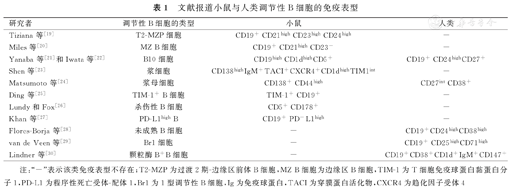
文献报道小鼠与人类调节性B细胞的免疫表型
文献报道小鼠与人类调节性B细胞的免疫表型
| 研究者 | 调节性B细胞的类型 | 小鼠 | 人类 |
|---|---|---|---|
| Tiziana等[19] | T2-MZP细胞 | CD19+ CD21high CD23high CD24high | - |
| Miles等[20] | MZ B细胞 | CD19+ CD21high CD23- | - |
| Yanaba等[21]和Iwata等[22] | B10细胞 | CD19high CD1dhighCD5+ | CD19+ CD24highCD27+ |
| Shen等[23] | 浆细胞 | CD138highIgM+TACI+CXCR4+CD1dhighTIM1int | - |
| Matsumoto等[24] | 浆母细胞 | CD138+ CD44high | CD27int CD38+ |
| Ding等[25] | TIM-1+ B细胞 | TIM-1+ CD19+ | - |
| Lundy和Fox[26] | 杀伤性B细胞 | CD5+ CD178+ | - |
| Khan等[27] | PD-L1high B | CD19+ PD-L1high | - |
| Flores-Borja等[28] | 未成熟B细胞 | - | CD19+CD24highCD38high |
| van de Veen等[29] | Br1细胞 | - | CD19+ CD25highCD71high |
| Lindner等[30] | 颗粒酶B+B细胞 | - | CD19+CD38+CD1d+IgM+CD147+ |
注:"-"表示该类免疫表型不存在;T2-MZP为过渡2期-边缘区前体B细胞,MZ B细胞为边缘区B细胞,TIM-1为T细胞免疫球蛋白黏蛋白分子1,PD-L1为程序性死亡受体-配体1,Br1为1型调节性B细胞,Ig为免疫球蛋白,TACI为穿膜蛋白活化物,CXCR4为趋化因子受体4
目前,IL-10被认为是Breg发挥免疫抑制作用的主要细胞因子,在介导Breg免疫抑制功能中发挥关键作用,因此被作为鉴定Breg的特异性标志物。有研究结果表明,CD19+ CD24high CD38high B细胞通过分泌IL-10抑制初始T细胞向Th1与Th17分化,并且促进CD4+ CD25- T细胞转化为Treg[28]。此外,慢性乙型肝炎患者Breg与CD4+ CD25- T细胞共培养可以抑制T细胞分泌的γ干扰素与IL-17的分泌,但是促进CD4+ CD25- T细胞转化为Treg与IL-10+ T细胞的产生,Breg的这种作用部分依赖于IL-10的释放[31]。IL-35是最新鉴定出的由Breg产生的另一种重要的免疫负向调节因子[23]。IL-35能够在体内诱导Breg产生并促进其转变为分泌IL-35的Breg亚群(IL-35+ Breg)。动物实验结果表明,体外生成的Breg通过抑制Th17/Th1与促进Treg的扩增,从而抑制葡萄膜炎的进展[32]。因此,体外诱导产生的Breg有望成为自身免疫性疾病的潜在治疗策略。
越来越多的研究发现,Breg亦可以通过与效应T细胞,自然杀伤T细胞(natural killer T cell,NKT),Treg,树突状细胞(dendritic cell,DC)及巨噬细胞等免疫细胞相互作用参与免疫调节[33]。Kessel等[34]研究发现,人Breg通过细胞与细胞接触抑制了CD4+ T细胞的增殖,并且促进Treg中Foxp3与CTLA-4的表达。除了直接作用于T细胞外,Breg亦可以通过DC发挥作用,与B10细胞共培养的DC诱导T细胞增殖的能力显著降低[35]。除分泌免疫抑制性细胞因子及与其靶细胞相互作用外,Breg可以通过产生自身抗体增强其对凋亡细胞的清除,刺激DC与巨噬细胞产生TGF-β,放大免疫调节反应,亦可以通过产生免疫球蛋白(immunoglobulin, Ig)G等抗体,中和免疫应答与损伤组织中有害的可溶性分子,从而减轻机体炎症反应[36]。目前,关于Breg的免疫调控机制仍是较为复杂的网络,阐明其免疫调控机制有望为以Breg为靶点的ITP治疗策略提供有力的理论依据。
最近,有研究发现,ITP患者存在CD19+ CD24high CD38high Breg数量减少与功能缺失,促血小板生成素治疗可以纠正Breg数量的减少,这表明Breg数量减少与功能缺失在ITP发病的免疫调节机制中发挥了一定作用[37]。Li等[38]亦发现,ITP患者存在CD19+ CD24high CD38high Breg数量,以及IL-10 mRNA表达水平下降,二者经地塞米松治疗后随着血小板数量的上升而升高。Aslam等[39]将Breg分为CD19+ CD24+ CD38+ Breg与CD19+ CD24+ FoxP3+ Breg这2种亚群,检测了9例ITP患者与8例外伤患者脾中这2种Breg亚群的比例,结果发现ITP患者脾中CD19+ CD24+ CD38+ Breg的比例与外伤患者脾中的Breg比例相比,差异无统计学意义(P>0.05);但是CD19+ CD24+ FoxP3+ Breg比例较外伤患者升高,并且差异有统计学意义(P=0.009)。Hua等[40]纳入35例ITP患者与25例健康个体对照进行研究的结果显示,ITP患者外周血中B10细胞(CD19+ IL-10+ B细胞)的比例较健康个体升高,并且差异有统计学意义(P<0.001);经一线方案治疗后获得CR或者部分缓解(partial remission,PR)的ITP患者的B10细胞比例仍保持在较高水平,但是在未获得任何反应的患者中则减少,二者比较,差异亦有统计学意义(P=0.025);而且ITP患者治疗前、后的B10细胞比例与Treg均存在正相关关系。此外,该研究亦发现,ITP患者存在Treg/Th17降低,并且与B10细胞数量相关。这表明,ITP患者B10细胞数量的增加,以及Treg/Th17失衡,可能提示在ITP患者中B10细胞调节功能性T细胞亚群的能力可能受到损害,但是仍需进一步研究证实。
近年来,越来越多的研究证据表明,ITP为一种异质性疾病,其发病机制不仅包括B细胞介导的体液免疫紊乱,亦包括T细胞介导的细胞免疫失调。此外,Treg及Breg等免疫抑制性细胞亚群在ITP的发病中亦发挥了重要作用。Treg的产生不足或者功能缺陷可能导致了ITP患者自身免疫耐受的破坏,增加Treg的数量或者恢复其功能有望成为ITP免疫治疗的新策略。目前,关于Breg的免疫表型尚未有明确定义,其在ITP中的研究比较匮乏且研究结果存在矛盾,仍需大量研究以明确Breg在ITP发病中的变化及其作用机制。
所有作者均声明不存在利益冲突



























