
探讨Holmes震颤(HT)患者的临床特点及短期预后。
回顾性分析2014年1月至2018年1月在5家医院神经内科住院的HT患者的临床及影像资料,并利用Fahn-Tolosa-Marin震颤评定量表(TRS)比较不同的病变类型组间(孤立病变组与多发病变组;中脑受累组与非中脑受累组)临床症状严重程度及短期预后的差异。
(1)本研究共纳入23例患者,HT出现距原发疾病的时间为2 d至20个月(中位时间29 d),最常见的病因是脑血管病(18例,78.3%)。(2)影像上原发病损部位依次为中脑(65.2%)、丘脑(47.8%)及小脑(30.4%)。表现为孤立病变12例(52.2%)、多发病变11例(47.8%);中脑受累15例(65.2%)、非中脑受累8例(34.8%)。研究显示孤立病变组与多发病变组TRS总分比较差异无统计学意义(P=0.57),而中脑受累组的TRS总分较非中脑受累组显著升高(P=0.00)。(3)深部脑电刺激术有效治疗1例;单纯药物治疗22例,其中以左旋多巴联合氯硝西泮(7/12)与左旋多巴单药(9/20)较有效。(4)出院3个月随访时,手术治疗者预后良好,而药物治疗者中良好结局者仅8例(36.4%)。孤立病变组与多发病变组预后不良者占比差异无统计学意义(P=0.40),而中脑受累组预后不良者占比显著高于非中脑受累组(P=0.02)。
HT最常见的病因是脑血管病,常见的原发病损部位为中脑、丘脑及小脑。单纯药物治疗的HT仅部分有效且短期预后不佳,原发中脑受累者震颤程度更重且预后更差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Holmes震颤(Holmes′ tremor,HT)是一种临床少见的多动型运动障碍综合征,可表现为肢体静止性、姿势性或动作性震颤,频率<4.5 Hz[1,2]。该病多为中脑、丘脑或小脑病变所致的症状性震颤[3],其病因包括脑卒中、脑肿瘤、脑血管畸形、脑外伤、多发性硬化及中枢感染等[3,4],其确切发病机制尚不明确,多认为与小脑-丘脑-皮质通路、黑质-纹状体通路及齿状核-红核-橄榄核通路中的某两个通路受损有关[3,4,5]。目前关于该病的流行病学资料有限,据悉国外最大宗报告为29例的单中心、回顾性研究[3],而国内仅检索到数例个案,这可能与大多数临床医生对该病的认识不足有关。因此,本研究回顾性分析了过去4年间国内5所大型医院神经内科住院确诊的HT患者的临床及影像资料,以提高临床医生对该综合征的熟知度,进而指导临床实践。
对2014年1月至2018年1月间在中日友好医院、西安交通大学医学院附属西安市中心医院、航天中心医院、温州医科大学附属第一医院及湖北医药学院附属太和医院神经内科住院确诊的全部HT患者(n=30)进行回顾性研究,HT的诊断标准采用《国际运动障碍协会的震颤专家共识》[2]",即:(1)表现为静止性、意向性的不规则震颤,亦可为姿势性震颤;(2)低频,通常<4.5 Hz;(3)迟发性起病,通常在原发病变后4周至2年起病。经剔除了失访或临床资料不完善的病例(n=7),最终纳入23例HT患者。
回顾上述5家医院的电子病例数据库及影像数据库,对入组病例的临床及影像资料进行采集,包括:年龄、性别、震颤出现距原发疾病的时间、震颤的临床特点、病因学、影像学表现及住院期间的治疗方法与疗效。
根据患者的临床资料由两位有经验的神经科专科医师按Fahn-Tolosa-Marin震颤评定量表(Fahn-Tolosa-Marin tremor rating scale,TRS)[6]对入组患者的震颤严重程度进行评分(0~144分),分值越高,震颤程度越重。
药物疗效评价标准参照了TRS中受试者前后对比评分部分的定义[6]。药物治疗方案分为单药治疗和联合用药(单药无效后添加其他药物定义为联合用药)。单药治疗有效指用药后TRS总分下降50%;联合用药有效指添加新药后较添加前TRS总分下降50%。
出院后3个月时对全部患者进行了治疗后随访。随访评估采取复诊时门诊病历记载、治疗后视频及电话随访相结合的方式。3个月时功能预后评定参照TRS总体评价的患者自评部分(TRS-GAP)进行分级[6]:由轻到重分为0~4级。本研究将TRS-GAP>1级定义为预后不良;TRS-GAP≤1级定义为预后良好。
将患者分别按照孤立病变组(单个病灶)和多发病变组(≥2个病灶);中脑受累组(同时存在中脑以外病变亦判定为中脑受累)和非中脑受累组进行分组比较,临床严重程度的比较采用TRS总分,预后比较采用TRS-GAP等级评分。
统计学分析在SPSS 19.0软件包中进行。计数资料采用率或构成比,计量资料采用 ±s表示。计数资料的组间比较采用χ2检验或Fisher′s确切概率法,计量资料的组间比较采用t检验。P<0.05为差异有统计学意义。
±s表示。计数资料的组间比较采用χ2检验或Fisher′s确切概率法,计量资料的组间比较采用t检验。P<0.05为差异有统计学意义。
23例HT患者,男女比例8∶15,年龄(56±14)(18~85)岁。震颤出现距离原发疾病的时间为2 d至20个月(中位时间29 d)。震颤累及的部位:单侧肢体14例(60.9%),双侧肢体8例(34.8%),四肢及头部1例(4.3%)。HT在肢体近端及远端均可出现,17例(73.9%)远端重于近端,3例(13.0%)近端重于远端,3例(13.0%)近远端一致。
常见的病因是脑血管疾病(18例,78.3%),以出血性脑血管病居多(14例,60.9%),包括原发性脑出血(10例,43.5%)、海绵状血管瘤(3例,13.0%)和动静脉畸形(1例,4.3%);缺血性脑血管病相对少见(4例,17.4%),其中大动脉粥样硬化性(2例,8.7%)、心源性栓塞(1例,4.3%)及动脉夹层(1例,4.3%);其他少见的病因包括脑外伤(2例,8.7%)、多发性硬化(1例,4.3%)、神经白塞病(1例,4.3%)和弓形虫感染(1例,4.3%)等。
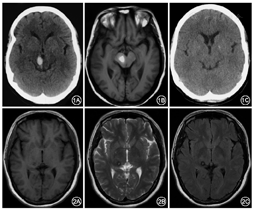
所有患者均存在颅内器质性病变,中脑(15例)、丘脑(11例)及小脑(7例)依次为常见的病变部位(注:多发病变者部位有重叠,故病变总数>23)。分组显示:孤立病变组12例(52.2%)、多发病变组11例(47.8%);中脑受累组15例(65.2%)、非中脑受累组8例(34.8%)。孤立病变组与多发病变组TRS总分比较差异无统计学意义[(47±17)分比(50±14)分,P=0.57];而中脑受累组与非中脑受累组TRS总分比较差异有统计学意义[(58±14)分比(38±11)分,P=0.00]。典型病例:例1中脑右侧出血(图1),震颤却波及四肢及头部(TRS总分84分);例2右侧丘脑海绵状血管瘤(图2),震颤仅局限于左侧肢体(TRS总分42分)。

住院期间单纯药物治疗者22例,有效18例(78.3%),有效占比(有效患者/总治疗患者)依次为:左旋多巴联合氯硝西泮:7/12;左旋多巴:9/20;盐酸苯海索:2/7。其中1例药物治疗无效者在1年后接受了深部脑电刺激术(deep brain stimulation,DBS)治疗,电极植入刺激靶点为对侧丘脑腹中间核,术后症状明显改善(TRS总分下降74.1%)。
3个月随访结果显示:DBS手术治疗患者预后良好,而药物治疗的22例患者中,预后良好仅8例(36.4%)、预后不良14例(63.6%)。进一步分析显示:孤立病变组与多发病变组预后不良者占比差异无统计学意义(26.1%比34.8%,P=0.40),而中脑受累组预后不良者占比显著高于非中脑受累组(52.2%比8.7%,P=0.02),见表1。
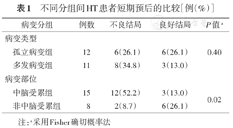
不同分组间HT患者短期预后的比较[例(%)]
不同分组间HT患者短期预后的比较[例(%)]
| 病变分组 | 例数 | 不良结局 | 良好结局 | P值a | |
|---|---|---|---|---|---|
| 病变类型 | |||||
| 孤立病变组 | 12 | 6(26.1) | 6(26.1) | 0.40 | |
| 多发病变组 | 11 | 8(34.8) | 3(13.0) | ||
| 病变部位 | |||||
| 中脑受累组 | 15 | 12(52.2) | 3(13.0) | 0.02 | |
| 非中脑受累组 | 8 | 2(8.7) | 6(26.1) | ||
注:a采用Fisher确切概率法
HT曾被称为红核震颤、中脑震颤或丘脑震颤[2],是一种罕见的临床多动型运动障碍综合征。最早在1904年由Gordon Holmes命名并描述[7],目前诊断标准源于1998年国际运动障碍疾病协会的共识[2]。由于典型病例除红核外也可见于颅内其他部位的病变[3],而实验性红核损伤并不总能引起持续性震颤[8],因此,其确切的发病机制尚未完全阐明。本组患者发病年龄(56±14)岁,较既往国外报道年龄偏大[3]。从原发病变到出现震颤的中位时间为29 d(2 d至20个月),而既往研究也提示HT可发生在原发病变出现后数天至数年[3],更有报道原发病变后23年才出现HT[9],可见,关于原发病之后出现HT的时间间隔变异性很大。
本研究显示HT的震颤既可为单侧(14例,60.9%),亦可双侧(8例,34.8%),其中例1中脑右侧出血导致四肢及头部震颤,且病灶同侧肢体震颤更重,既往文献未见类似的报道,其确切机制不详。HT的发病机制非常复杂,目前认为黑质-纹状体多巴胺能系统、小脑-丘脑-皮质环路以及齿状核-红核-橄榄核环路均可能参与其中[5,10],结合该患者既往有左侧小脑出血病史,根据Brittain等[11]报道小脑梗死患者所出现的同侧的HT,推测该病例可能与新发中脑病变导致小脑齿状核-红核-橄榄核环路的失交联有关。
病因学方面,本组最常见的是脑血管病,其中以原发性脑出血最为常见(43.5%),这与Raina等[3]报道基本一致。第二位病因为外伤性(8.7%),明显低于国外报道的20%[12]。另外,既往报道的少见病因还包括海绵状血管瘤、多发性硬化、肿瘤转移,脑脓肿、弓形虫感染等[3,4]。本病例组中也有相似的病因学发现。总体而言,HT的病因学是多样化的,提示该病并非一个独立的疾病实体,而是一种综合征。
既往报道导致HT的病变部位包括中脑、桥脑、延髓、丘脑、小脑等[3,4,5,11],目前最大宗的病例报告发现易受累部位依次为中脑、丘脑与小脑,占全部受累部位的82.7%[3]。本研究亦显示中脑、丘脑及小脑是常见的原发受累部位。有关HT原发病变的影像学特征与临床症状之间的关系目前尚无定论。Raina等[3]的观察性研究提示震颤的临床严重程度与病灶的数目和范围无明显关联。本研究对孤立病变组和多发病变组的震颤严重程度进行比较后发现二者并无显著差异,进一步支持了上述观点。而本研究发现中脑受累患者的震颤明显重于非中脑受累者,提示中脑核团损害在HT的发病中起到重要作用,如病例1示因中脑出血继发了广泛而严重的震颤。总之,本研究首次考察了病变解剖部位与临床严重程度的关系,初步提示中脑受累或与HT症状的严重程度有一定关联,但仍需功能影像学研究证实并阐明其机制。
HT的药物治疗效果存在很大的变异性,目前认为左旋多巴是较为有效的药物[3,13],但也有患者对左旋多巴无效或反应不佳[14]。Gajos等[4]采用多巴转运体显像研究显示,对左旋多巴不敏感的HT,双侧纹状体区并不存在多巴摄取不对称的现象,提示此类患者的黑质-纹状体多巴胺能通路未明显受损,故对多巴替代治疗不敏感。本组病例显示左旋多巴单药治疗有效者仅占9/20,可能与上述机制相关。目前,文献报道对HT有效的药物还包括苯海索、普拉克索、吡贝地尔、氯硝西泮、丙戊酸钠、左乙拉西坦、托吡酯等[1,15],但均为个案报道,其疗效需进一步研究及临床临践。关于DBS在HT中的应用,近年来有很多个案的尝试,均取得了不错的疗效。新近由Mendonҫa等[16]发表的系统评价证实了DBS治疗HT的有效性,在继发于脑卒中或外伤的HT中,震颤改善率(TRS总分下降)分别达到77.5%和71.4%,且纳入的大部分研究(63.6%)采用丘脑腹中间核作为刺激靶点。本组唯一接受了DBS手术的患者,同样采用此核作为刺激靶点,也取得了很好的疗效和短期预后,但鉴于目前的研究多为单中心个案报告,研究的同质性较差,亟待一个设计合理的前瞻性研究证实其有效性。
目前未检索到有关单纯药物治疗HT的预后的文献报道,本研究首次观察了HT的短期预后,发现采取单纯药物治疗的患者预后不佳,主要归咎于震颤对生活质量的影响。进一步的分析发现中脑受累与不良预后相关,可能的原因为中脑内的红核、黑质等结构损毁后切断了小脑-丘脑-皮质通路和黑质-纹状体多巴胺能通路之间的纤维联系[5,11,17],而其却在HT的症状发生中起着重要作用。另外,关于影响预后的因素目前并不明确,从DBS治疗HT的研究结果显示[16],继发于脑卒中者在DBS术后预后好于其他病因,而进一步的分析并未发现卒中后HT患者在年龄、病程、震颤发病年龄、治疗靶点、随访时间等方面与其他组有显著差异,因此,笔者认为有必要对HT患者进行长期的登记研究,进一步阐明其自然病程及影响预后的因素。
本研究是目前国内有关HT样本量最大的临床病例研究,尽管为回顾性研究,但作为一个多中心病例分析,具有一定的临床价值。主要局限性在于:(1)由于客观上国内医生对该病的认识不足,疾病诊断可能存在偏倚;(2)在预后评价时,采用了患者自测评分,可能对结果会有一定影响,故本研究结果有待进一步前瞻性注册研究来证实。
综上所述,HT是一种相对罕见的症状性震颤,多继发于中脑、丘脑及小脑等部位的血管性疾病,尤以脑出血较为常见,且原发中脑受累者震颤程度更重。HT对包括左旋多巴及苯海索在内的单药治疗或左旋多巴联合氯硝西泮等药物治疗方案仅部分有效。随访研究提示药物治疗HT患者短期预后不良,且原发中脑受累者预后更差,DBS手术治疗可能是未来治疗的选择和研究的重点。
所有作者均声明不存在利益冲突



























