
探讨皮肤及软组织感染病灶分离细菌的多样性及耐药性,为临床合理使用抗菌药物提供科学依据。
收集2012年1月至2017年12月北京大学临床医学院皮肤科皮肤及软组织感染病灶标本,包括脓液、分泌物、组织、尿液、咽拭子或肺泡灌洗液等,应用VITEK2 Compact全自动微生物分析系统及BD-Bruker MALDI Biotyper微生物质谱快速鉴定系统进行细菌鉴定,K-B法进行药敏试验,结果按CLSI标准判读,并结合患者病例资料进行回顾性分析。
327例患者标本中分离获得392株细菌,分别归属于21个属,56个种;其中革兰阳性球菌225株(占57.40%),革兰阴性杆菌114株(占29.08%),革兰阳性杆菌46株(占11.73%),革兰阴性球菌7株(占1.79%)。细菌检出前3位的依次是金黄色葡萄球菌(91株,占23.21%),表皮葡萄球菌(42株,占10.71%),铜绿假单胞菌(24株,占6.12%)。分离到的葡萄球菌对青霉素、红霉素有较高耐药率(>50%);革兰阴性杆菌则对氨苄西林耐药率高(86.1%),对二代和部分三代头孢也部分耐药性(约50%)。此外,耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林敏感金黄色葡萄球菌(MSSA)仅在四环素耐药性方面差异有统计学意义(P<0.05)。
自皮肤及软组织感染病灶分离的细菌种属多样性丰富,且较普遍存在对抗生素耐药问题,后者可能是导致难治性皮肤软组织感染的重要因素,提示临床应根据药敏试验结果合理选用抗菌药物进行治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
皮肤及软组织感染(SSTI)是一种由病原微生物侵犯表皮、真皮和皮下组织引起的炎症性疾病[1],其在临床上十分常见,引起SSTI的病原体种类繁多,以细菌最为常见。随着抗生素的广泛使用,细菌耐药的问题日益突出,菌种变迁和耐药性变化给临床治疗SSTI带来巨大挑战。本研究对近6年北京大学第三临床医学院皮肤科收集到的SSTI患者感染的病原菌分布情况和耐药性进行分析,以期为临床制定抗感染治疗方案提供初步依据。
选择2012年1月至2017年12月期间,北京大学第三临床医学院皮肤科576例临床拟诊为皮肤细菌感染或继发细菌感染的患者,共计1 047份送检细菌培养的受染皮肤或软组织标本(部分有系统播散的患者采用血液标本);其中327例患者的730份样本细菌培养呈阳性,阳性检出率为69.72%(730/1 047);327例确诊患者中男167例患者,女160例,年龄11个月龄~90岁,平均(43±20)岁。
细菌分离培养基用中国蓝平板、血琼脂平板、细菌药敏试验用Mueller-Hinton琼脂培养基(英国OXOID公司产品)。抗生素头孢哌酮-舒巴坦、厄他培南、替加环素、阿奇霉素、氨苄西林、米诺环素、替考拉宁购自英国OXOID公司。
大肠埃希氏菌ATCC25922,铜绿假单胞菌ATCC27853,金黄色葡萄球菌ATCC25923。标准菌株由中国药品生物制品检定所提供。
从皮肤科软组织感染患者的脓液、分泌物、组织、皮屑、尿液、咽拭子或肺泡灌洗液等部位采集样本,样本在0.5 h内送往细菌室接种于中国蓝平板、血琼脂平板,于5%CO2培养箱培养后观察结果。
细菌鉴定采用VITEK2 Compact全自动微生物分析系统(法国梅里埃公司产品)及BD-Bruker MALDI Biotyper微生物质谱快速鉴定系统(德国布鲁克公司产品)进行。
机器法药敏:采用VITEK2 Compact全自动微生物分析系统检测常用抗菌药物的最低抑菌浓度(MIC),敏感性判断依据美国临床实验室标准化研究所(CLSI)文件定为敏感(S)、中介耐药(I)和耐药(R)。纸片法药敏:敏感性判断依据美国临床实验室标准化研究所(CLSI)文件定为敏感(S)、中介耐药(I)和耐药(R)。头孢哌酮-舒巴坦药敏试验判定折点参照头孢哌酮的折点。替加环素药敏判定折点参照美国FDA标准:替加环素MIC值≤2 μg/ml为敏感,=4 μg/ml为中介耐药,而>4 μg/ml为耐药。耐甲氧西林金黄色葡萄球菌(MRSA)和甲氧西林敏感金黄色葡萄球菌(MSSA)按照苯唑西林耐药性区分。
数据统计分析使用SPSS 18.0。试验结果中同一例患者在5 d内分离鉴定得到相同菌种定义为重复培养,细菌培养结果在数据库中只计数1次。细菌药物敏感性结果分析,同一患者相同菌株以首次分离株药敏结果进行。MRSA和MSSA两组间耐药率比较采用χ2检验,以P<0.05为差异有统计学意义。
327例皮肤感染患者标本中检出730株不同种属的病原细菌,剔除重复结果后为392株,分别分布于21属56种。细菌检出前5位的依次是金黄色葡萄球菌、表皮葡萄球菌、铜绿假单胞菌、凝固酶阴性葡萄球菌及芽胞杆菌属菌种,病原菌具体分布见表1。
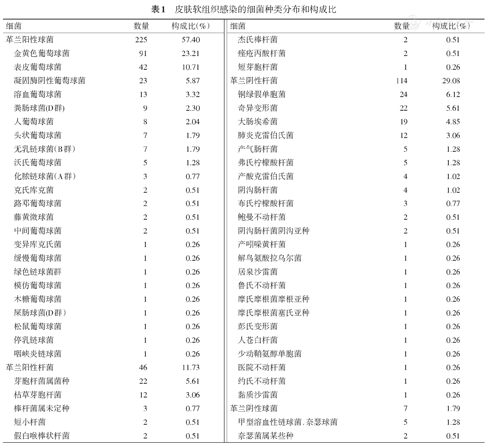
皮肤软组织感染的细菌种类分布和构成比
皮肤软组织感染的细菌种类分布和构成比
| 细菌 | 数量 | 构成比(%) | 细菌 | 数量 | 构成比(%) | ||
|---|---|---|---|---|---|---|---|
| 革兰阳性球菌 | 225 | 57.40 | 杰氏棒杆菌 | 2 | 0.51 | ||
| 金黄色葡萄球菌 | 91 | 23.21 | 痤疮丙酸杆菌 | 2 | 0.51 | ||
| 表皮葡萄球菌 | 42 | 10.71 | 短芽胞杆菌 | 1 | 0.26 | ||
| 凝固酶阴性葡萄球菌 | 23 | 5.87 | 革兰阴性杆菌 | 114 | 29.08 | ||
| 溶血葡萄球菌 | 13 | 3.32 | 铜绿假单胞菌 | 24 | 6.12 | ||
| 粪肠球菌(D群) | 9 | 2.30 | 奇异变形菌 | 22 | 5.61 | ||
| 人葡萄球菌 | 8 | 2.04 | 大肠埃希菌 | 19 | 4.85 | ||
| 头状葡萄球菌 | 7 | 1.79 | 肺炎克雷伯氏菌 | 12 | 3.06 | ||
| 无乳链球菌(B群) | 7 | 1.79 | 产气肠杆菌 | 5 | 1.28 | ||
| 沃氏葡萄球菌 | 5 | 1.28 | 弗氏柠檬酸杆菌 | 5 | 1.28 | ||
| 化脓链球菌(A群) | 3 | 0.77 | 产酸克雷伯氏菌 | 4 | 1.02 | ||
| 克氏库克菌 | 2 | 0.51 | 阴沟肠杆菌 | 4 | 1.02 | ||
| 路邓葡萄球菌 | 2 | 0.51 | 布氏柠檬酸杆菌 | 3 | 0.77 | ||
| 藤黄微球菌 | 2 | 0.51 | 鲍曼不动杆菌 | 2 | 0.51 | ||
| 中间葡萄球菌 | 2 | 0.51 | 阴沟肠杆菌阴沟亚种 | 2 | 0.51 | ||
| 变异库克氏菌 | 1 | 0.26 | 产吲哚黄杆菌 | 1 | 0.26 | ||
| 缓慢葡萄球菌 | 1 | 0.26 | 解鸟氨酸拉乌尔菌 | 1 | 0.26 | ||
| 绿色链球菌群 | 1 | 0.26 | 居泉沙雷菌 | 1 | 0.26 | ||
| 模仿葡萄球菌 | 1 | 0.26 | 鲁氏不动杆菌 | 1 | 0.26 | ||
| 木糖葡萄球菌 | 1 | 0.26 | 摩氏摩根菌摩根亚种 | 1 | 0.26 | ||
| 屎肠球菌(D群) | 1 | 0.26 | 摩氏摩根菌塞氏亚种 | 1 | 0.26 | ||
| 松鼠葡萄球菌 | 1 | 0.26 | 彭氏变形菌 | 1 | 0.26 | ||
| 停乳链球菌 | 1 | 0.26 | 人苍白杆菌 | 1 | 0.26 | ||
| 咽峡炎链球菌 | 1 | 0.26 | 少动鞘氨醇单胞菌 | 1 | 0.26 | ||
| 革兰阳性杆菌 | 46 | 11.73 | 医院不动杆菌 | 1 | 0.26 | ||
| 芽胞杆菌属菌种 | 22 | 5.61 | 约氏不动杆菌 | 1 | 0.26 | ||
| 枯草芽胞杆菌 | 12 | 3.06 | 黏质沙雷菌 | 1 | 0.26 | ||
| 棒杆菌属未定种 | 3 | 0.77 | 革兰阴性球菌 | 7 | 1.79 | ||
| 短小杆菌 | 2 | 0.51 | 甲型溶血性链球菌.奈瑟球菌 | 5 | 1.28 | ||
| 假白喉棒状杆菌 | 2 | 0.51 | 奈瑟菌属某些种 | 2 | 0.51 | ||
金黄色葡萄球菌对青霉素G耐药率为95.1%(77/81),对红霉素耐药率为59.3%(48/81),对氯洁霉素耐药率为56.8%(46/81);对四环素、苯唑西林、复方新诺明、庆大霉素、环丙沙星、莫西沙星耐药率分别为22.2%、19.8%、16.0%、11.1%、6.2%、1.4%;未发现耐呋喃妥因、奎宁霉素、利福平的金黄色葡萄球菌。表皮葡萄球菌和溶血葡萄球菌对青霉素G耐药率达100%,两者对苯唑西林、红霉素及氯洁霉素耐药率均>50%,其中表皮葡萄球菌对苯唑西林、红霉素、氯洁霉素的耐药率分别为54.1%(20/37)、83.8%(31/37)、73%(27/37),溶血葡萄球菌对苯唑西林、红霉素、氯洁霉素的耐药率分别为72.7%(8/11)、75%(9/12)、66.7%(8/12)。两者对复方新诺明耐药率分别为35.1%(13/37)和8.3%(1/12),对环丙沙星耐药率分别为29.7%(11/37)和50.0%(6/12),对四环素耐药率分别为27.0%(10/37)和33.3%(4/12)。3种主要革兰阳性球菌对利奈唑胺、替加环素、万古霉素耐药率均为0%。MRSA与MSSA的耐药率比较结果显示,MRSA相比于MSSA,二者对苯唑西林、四环素两种药物的耐药率差异有统计学意义(P<0.05),详见表2。
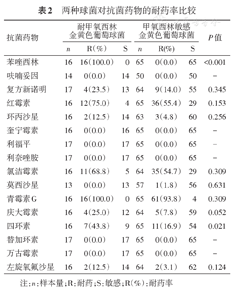
两种球菌对抗菌药物的耐药率比较
两种球菌对抗菌药物的耐药率比较
| 抗菌药物 | 耐甲氧西林金黄色葡萄球菌 | 甲氧西林敏感金黄色葡萄球菌 | P值 | ||||
|---|---|---|---|---|---|---|---|
| n | R(%) | S | n | R(%) | S | ||
| 苯唑西林 | 16 | 16(100.0) | 0 | 65 | 0(0.0) | 65 | <0.001 |
| 呋喃妥因 | 14 | 0(0.0) | 14 | 50 | 0(0.0) | 50 | - |
| 复方新诺明 | 17 | 4(23.5) | 13 | 64 | 9(14.0) | 55 | 0.345 |
| 红霉素 | 16 | 12(75.0) | 4 | 65 | 36(55.4) | 29 | 0.153 |
| 环丙沙星 | 16 | 2(12.5) | 14 | 63 | 3(4.8) | 60 | 0.256 |
| 奎宁霉素 | 16 | 0(0.0) | 16 | 65 | 0(0.0) | 65 | - |
| 利福平 | 17 | 0(0.0) | 17 | 65 | 0(0.0) | 65 | - |
| 利奈唑胺 | 17 | 0(0.0) | 17 | 65 | 0(0.0) | 65 | - |
| 氯洁霉素 | 16 | 11(68.8) | 5 | 64 | 35(54.7) | 29 | 0.309 |
| 莫西沙星 | 13 | 0(0.0) | 13 | 57 | 1(1.8) | 56 | 0.631 |
| 青霉素G | 16 | 16(100.0) | 0 | 65 | 61(93.8) | 4 | 0.309 |
| 庆大霉素 | 16 | 4(25.0) | 12 | 64 | 5(7.8) | 59 | 0.052 |
| 四环素 | 16 | 7(43.8) | 9 | 65 | 11(16.9) | 54 | 0.021 |
| 替加环素 | 17 | 0(0.0) | 17 | 65 | 0(0.0) | 65 | - |
| 万古霉素 | 17 | 0(0.0) | 17 | 65 | 0(0.0) | 65 | - |
| 左旋氧氟沙星 | 16 | 2(12.5) | 14 | 64 | 2(3.1) | 62 | 0.124 |
注:n:样本量;R:耐药;S:敏感;R(%):耐药率
用于进行药敏试验的革兰阴性杆菌构成见表3。药敏分析结果表明,革兰阴性杆菌对下列抗菌药物耐药强弱顺序是:氨苄西林、头孢唑林、头孢呋辛酯、头孢呋辛、呋喃妥因、复方新诺明、氨苄西林/舒巴坦,见表4。

用于进行药敏试验的革兰阴性杆菌构成(株)
用于进行药敏试验的革兰阴性杆菌构成(株)
| 细菌 | 样本量 | 细菌 | 样本量 |
|---|---|---|---|
| 铜绿假单胞菌 | 24 | 鲍曼不动杆菌 | 3 |
| 奇异变形菌 | 20 | 摩氏摩根菌摩根亚种 | 2 |
| 大肠埃希菌 | 16 | 解鸟氨酸拉乌尔菌 | 1 |
| 肺炎克雷伯氏菌 | 13 | 居泉沙雷菌 | 1 |
| 产气肠杆菌 | 5 | 鲁氏不动杆菌 | 1 |
| 弗氏柠檬酸杆菌 | 5 | 产吲哚黄杆菌 | 1 |
| 阴沟肠杆菌阴沟亚种 | 4 | 彭氏变形菌 | 1 |
| 产酸克雷伯氏菌 | 4 | 黏质沙雷菌 | 1 |
| 布氏柠檬酸杆菌 | 3 | 约氏不动杆菌 | 1 |
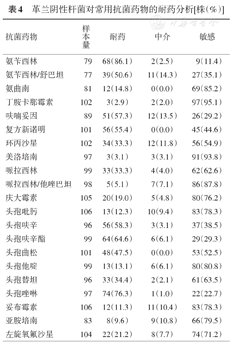
革兰阴性杆菌对常用抗菌药物的耐药分析[株(%)]
革兰阴性杆菌对常用抗菌药物的耐药分析[株(%)]
| 抗菌药物 | 样本量 | 耐药 | 中介 | 敏感 |
|---|---|---|---|---|
| 氨苄西林 | 79 | 68(86.1) | 2(2.5) | 9(11.4) |
| 氨苄西林/舒巴坦 | 77 | 39(50.6) | 11(14.3) | 27(35.1) |
| 氨曲南 | 81 | 12(14.8) | 0(0.0) | 69(85.2) |
| 丁胺卡那霉素 | 102 | 3(2.9) | 2(2.0) | 97(95.1) |
| 呋喃妥因 | 89 | 51(57.3) | 12(13.5) | 26(29.2) |
| 复方新诺明 | 101 | 56(55.4) | 0(0.0) | 45(44.6) |
| 环丙沙星 | 102 | 34(33.3) | 12(11.8) | 56(54.9) |
| 美洛培南 | 97 | 3(3.1) | 3(3.1) | 91(93.8) |
| 哌拉西林 | 99 | 33(33.3) | 4(4.0) | 62(62.6) |
| 哌拉西林/他唑巴坦 | 98 | 5(5.1) | 7(7.1) | 86(87.8) |
| 庆大霉素 | 105 | 20(19.0) | 5(4.8) | 80(76.2) |
| 头孢吡肟 | 106 | 13(12.3) | 10(9.4) | 83(78.3) |
| 头孢呋辛 | 96 | 56(58.3) | 3(3.1) | 37(38.5) |
| 头孢呋辛酯 | 99 | 64(64.6) | 6(6.1) | 29(29.3) |
| 头孢曲松 | 101 | 48(47.5) | 0(0.0) | 53(52.5) |
| 头孢他啶 | 99 | 13(13.1) | 6(6.1) | 80(80.8) |
| 头孢替坦 | 96 | 33(34.4) | 2(2.1) | 61(63.5) |
| 头孢唑啉 | 97 | 74(76.3) | 1(1.0) | 22(22.7) |
| 妥布霉素 | 106 | 12(11.3) | 11(10.4) | 83(78.3) |
| 亚胺培南 | 83 | 8(9.6) | 9(10.8) | 66(79.5) |
| 左旋氧氟沙星 | 104 | 22(21.2) | 8(7.7) | 74(71.2) |
皮肤及软组织感染的发病率较高,急性或重症SSTI患者病情进展迅速,往往缺乏足够时间进行样本采集培养和鉴定,大多数病例多根据经验,如通过患者的临床表现等选择抗菌药物进行治疗。然而,引起SSTI的细菌种类繁多,细菌耐药现象越来越普遍,导致了临床治疗的难度不断增加。我们先前的初期工作表明,病原微生物的多样性随时间推移而不断更新[2]。本研究则为之提供了更加充分的证据,因此,临床上应对引起皮肤及软组织感染的细菌种类的分布及其耐药性以特别关注。
本研究从327例皮肤感染患者的标本中检出392株细菌,分布于21个属,56个种。其中检出前5位的依次是金黄色葡萄球菌(23.21%)、表皮葡萄球菌(10.71%)、铜绿假单胞菌(6.12%)、凝固酶阴性葡萄球菌(5.87%)及芽孢杆菌属菌种(5.61%)。细菌分布情况是,皮肤及软组织感染的细菌主要为革兰阳性球菌,其次是革兰阴性杆菌。此外,约氏不动杆菌、短芽孢杆菌等罕见细菌也从感染病灶中检出。这对临床医生进一步认识皮肤感染的细菌类病原谱具有良好的意义。
本结果表明,主要革兰阳性球菌对青霉素的耐药率均超过95%,对红霉素、氯洁霉素耐药率高于50%,而表皮葡萄球菌和溶血葡萄球菌对青霉素G耐药率达100%。但三者对呋喃妥因、奎宁霉素、利福平、利奈唑胺、替加环素、万古霉素等药物均有较高的敏感性,与2016年中国CHINET细菌耐药性监测数据相似。这提示在皮肤感染的临床治疗经验性用药时,应慎用青霉素、红霉素、氯洁霉素等耐药率较高的抗生素。
MRSA可引起包括SSTI在内的多种感染性疾病,对几乎所有β-内酰胺类抗生素产生耐药性,由于甲氧西林已经不再生产,现在的抗生素敏感性测试通常用苯唑西林或头孢西丁取代之[3]。自1961年以来,全球MRSA的感染率逐年升高[4],我国是MRSA感染的流行强度较高地区,防治形势十分严峻。研究显示,2016年我国30所医院金葡菌中MRSA的平均检出率为38.4%[5]。一项队列研究表明,由于合并症和基础病,MRSA感染往往比MSSA感染具有更高的死亡率和复发感染风险[6]。一般认为,MRSA对绝大多数测试药的耐药率显著高于MSSA[5],但本研究显示,MRSA仅在对四环素的耐药性方面显著高于MSSA,提示二者耐药性相差不大,相比MSSA,MRSA未表现出显著的耐药性增强。因此,临床上常用药米诺环素治疗时,表现出较对SSTI有较好的疗效可能也与MRSA和MSSA对部分抗生素同样敏感有关。此外,20世纪60年代初以来,万古霉素一直是治疗住院患者中侵入性MRSA感染的首选药物;值得注意的是,近年来部分临床MRSA菌株也出现了对万古霉素的耐药性。幸运的是,近年来国内大部分医院未发现葡萄球菌属中万古霉素耐药的菌株[7],而本研究中利奈唑胺、替加环素和万古霉素在3种常见葡萄球菌的药敏试验中亦未发现耐药现象。我们和其他已报道的研究结果表明,替加环素、奎宁霉素和利奈唑胺可作为万古霉素的替代治疗药物,但临床上对于MRSA的治疗用药仍应慎重考虑。
本研究显示,革兰阴性杆菌对常用的抗菌药物青霉素出现耐药,其对氨苄西林的耐药率达86.1%,合用舒巴坦后耐药率仍然高达50.6%;对哌拉西林也有33.3%的耐药率,但合用他唑巴坦后耐药率显著降低至5.1%。目前常用于抗革兰阴性菌的头孢类抗生素也出现耐药情况,尤其是第一、二代头孢,耐药率均已接近或超过60%;对于第一代至第四代头孢,阴性杆菌的耐药率呈现逐渐降低的趋势,但都超过10%。此外,阴性杆菌对呋喃妥因和复方新诺明的耐药率超过50%。环丙沙星作为常用药,本研究中阴性杆菌对其的耐药率为33.3%。临床严重感染或复杂感染常常由于耐药株感染而致,如作者所在研究小组曾报道了大肠埃希菌所致坏死性筋膜炎,由于初期多种药物治疗无效,最后发展致多脏器衰竭,皮肤坏死,而按照药敏结果调整治疗方案后患者最终痊愈[7,8,9]。鲍曼不动杆菌易出现多重耐药,并可侵犯动脉壁而致皮肤溃疡,发生在面部则可毁容。因此,早期发现病原菌,及时了解其药敏特性对于严重或慢性迁延性感染的治疗具有非常重要的意义[7,8,9]。
本研究不但发现皮肤感染病原菌具有高度的多样性,细菌耐药谱和耐药性的变化具有重要临床意义。曾经对革兰阳性球菌效果较好的青霉素、红霉素等,已经产生显著耐药,这意味着常规应用这些药物很可能无效。原来认为氨苄西林和前两代头孢以及呋喃妥因、复方新诺明对革兰阴性杆菌有效[10],但结果提示对于这些常用药,革兰阴性杆菌耐药率普遍超过50%。可见细菌对于过去常用的抗生素普遍耐受,由此导致临床上这些药物的抗菌效果降低甚至无效,耐药菌感染引起的皮肤病易被误认为是非细菌感染性疾病,影响临床诊断和治疗。目前,皮肤感染具体的相关治疗可以参考2009年中国医师协会皮肤科分会发表的"皮肤及软组织感染诊断和治疗共识"(以下简称"共识")。该共识指出,皮肤感染的治疗应注意分级、分类,外用和系统用药结合[1],关注病原菌分布与耐药性的变动,选取合适、广谱、高效的抗菌药物是减少细菌耐药产生和提高疗效的关键。
所有作者均声明不存在利益冲突



























