
分析红细胞输注前、中、后早产儿脑组织氧饱和度(CrSO2)和氧摄取分数(CFOE)的变化,探讨红细胞输注对早产儿脑组织氧合的影响。
选取2017年9月至2018年3月复旦大学附属儿科医院新生儿科收治的出生胎龄<37周并输注红细胞治疗的早产儿,利用近红外光谱监测仪(NIRS)持续监测患儿红细胞输注前2 h、输注过程中至输注后24 h的脑组织CrSO2,利用多功能心电监护仪同步测量患儿经皮动脉氧饱和度(TcSaO2)、心率(HR)和血压(BP)。根据监测的TcSaO2计算患儿CFOE。
共纳入患儿71例,其中男39例,女32例;中位出生胎龄29(24~37)周;中位出生体质量2 195(710~3 950) g;中度贫血组17例,重度贫血组54例。与红细胞输注前2 h比较,所有患儿红细胞输注过程中CrSO2升高(t=9.536,P<0.001),CFOE降低(t=-8.688,P<0.001)。中度贫血组输血前2 h,输血过程中,输血后2、6、12、24 h的CrSO2值分别为0.579±0.037、0.591±0.032、0.599±0.035、0.596±0.035、0.595±0.027、0.585±0.022;重度贫血组分别为0.571±0.038、0.592±0.039、0.605±0.038、0.603±0.035、0.596±0.032、0.596±0.032。中度贫血组输血前2 h,输血过程中,输血后2、6、12、24 h的CFOE值分别为0.40±0.04、0.38±0.03、0.37±0.04、0.38±0.04、0.38±0.03、0.38±0.03;重度贫血组分别为0.42±0.04、0.39±0.04、0.38±0.04、0.38±0.04、0.39±0.03、0.39±0.03。中度贫血组患儿红细胞输注过程后2 h的CrSO2升高(t=3.874,P<0.05),CFOE降低(t=-4.091,P<0.05);重度贫血组患儿红细胞输注过程中CrSO2明显升高(t=9.221,P<0.001),CFOE显著降低(t=-8.583,P<0.001),此作用一直持续至红细胞输注后2 h(t=5.926、-5.556,P<0.001)。与红细胞输注前2 h的CrSO2比较,重度贫血组患儿红细胞输注后24 h的CrSO2明显升高(t=6.894,P<0.001),而CFOE显著降低(t=-8.536,P<0.001);但中度贫血组患儿红细胞输注后24 h的CrSO2和FTOE与红细胞输注前2 h的差异无统计学意义。
红细胞输注可改善早产儿脑组织氧合,重度贫血早产儿更受益于红细胞输注。NIRS监测仪脑氧合监测为早产儿红细胞输注的临床管理提供了新的思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
贫血是早产儿出生后常见的临床现象,早产儿贫血原因复杂,医源性失血和血液系统发育不成熟是早产儿贫血的重要原因[1,2]。红细胞输注是治疗早产儿贫血的主要方法[3]。目前红细胞输注的治疗策略分为限制性输血策略和开放性输血策略,虽然近年已开展多项关于2种输血策略的研究,但2种输血策略对贫血早产儿近期和远期预后的影响,尤其是对神经系统的影响仍存在争议[4]。近年近红外光谱监测仪(NIRS)可持续监测患儿脑组织氧饱和度(CrSO2)在新生儿科的应用越来越广泛[5,6,7]。本研究利用NIRS持续监测早产儿红细胞输注前、中、后的CrSO2,分析CrSO2和氧摄取分数(CFOE)随时间的变化,探讨红细胞输注对早产儿脑组织氧合的影响。
研究采用前瞻性队列研究设计,选取2017年9月至2018年3月复旦大学附属儿科医院新生儿科收治的出生胎龄<37周并输注红细胞治疗的早产儿。排除标准:(1)严重的先天畸形;(2)Papile分级Ⅲ度以上的颅内出血;(3)存在血流动力学紊乱的动脉导管未闭;(4)使用血管活性药物。本研究通过复旦大学附属儿科医院医学伦理委员会批准(批准文号:2017-234),并获得患儿监护人知情同意。
参照第3版《儿科学》新生儿贫血分度标准[8]。轻度:血红蛋白(Hb) 144~120 g/L;中度:Hb 120~90 g/L;重度:Hb 90~60 g/L;极重度:Hb<60 g/L,本研究纳入患儿分为中度贫血组和重度贫血组。
患儿是否输注红细胞由本院新生儿科主治以上医师根据患儿Hb和患儿的临床情况综合考虑。输血量按照15~20 mL/kg计算获得,输血时间约4 h,输血速度根据输血量与输血时间的比值计算,患儿均接受定向供血者或随机献血者的去白细胞、照射后、巨细胞病毒阴性的红细胞。
苏州爱琴生物医疗电子有限公司EGOS-600A近红外光谱监测仪。工作原理是以用波长700~900 nm的近红外光对人体组织有良好的穿透性,而人体组织对该段光的吸收主要源于微细血管血液中还原Hb和氧合Hb 2种吸收体,利用两者吸收谱的差异,通过修正的双波长朗伯-比尔定律,可求出组织中Hb浓度随时间的变化量,从而得到局部组织氧饱和度(rSO2)。
患儿取仰卧位,将B型探头(探测深度1.0~1.5 cm)固定在其前额上(眉骨上方1.5 cm,探头下方避开脑中线),用3M贴膜将探头固定在被测部位的体表,确保探头底面同被测部位的体表紧密接触,防止漏光。利用NIRS从红细胞输注前2 h、输注过程中至输注后24 h持续监测CrSO2,利用多功能心电监护仪同步测量患儿经皮动脉氧饱和度(TcSaO2)、心率(HR)和血压(BP)。患儿CFOE由CrSO2和TcSaO2计算获得:CFOE=(TcSaO2-CrSO2)/TcSaO2。NIRS监测仪每2 s记录1次CrSO2,在各时间点(输血前2 h,输血过程中,输血后2、6、12、24 h)计算CrSO2的平均值。多功能心电监护仪每5 min记录一次TcSaO2、HR和BP,在输血前2 h和输血后2 h计算TcSaO2、HR和BP的平均值。
收集入组患儿出生胎龄、出生体质量、输血时日龄、输血时矫正胎龄、输血时体质量、通气模式、输血前后Hb等数据。
采用SPSS 22.0统计软件进行数据分析,正态分布的计量资料用 ±s表示,非正态分布的计量资料用中位数(最小值~最大值)[M(min~max)]表示,计数资料的统计描述以例(%)表示。采用独立样本t检验、Mann-Whitney U检验和χ2检验比较2组患儿的基本情况;采用配对t检验和Mann-Whitney U检验比较2组患儿输血前2 h和输血后2 h的TcSaO2、HR和BP的变化;采用混合线性模型(MLM)比较2组患儿输血过程中和输血后CrSO2随时间变化的差异,其中将贫血严重程度分组指标、时间和贫血严重程度分组与时间的交互作用纳入固定效应,出生胎龄、输血时校正胎龄、出生体质量和输血时体质量纳入协变量进行统计分析,检验水准α=0.05。
±s表示,非正态分布的计量资料用中位数(最小值~最大值)[M(min~max)]表示,计数资料的统计描述以例(%)表示。采用独立样本t检验、Mann-Whitney U检验和χ2检验比较2组患儿的基本情况;采用配对t检验和Mann-Whitney U检验比较2组患儿输血前2 h和输血后2 h的TcSaO2、HR和BP的变化;采用混合线性模型(MLM)比较2组患儿输血过程中和输血后CrSO2随时间变化的差异,其中将贫血严重程度分组指标、时间和贫血严重程度分组与时间的交互作用纳入固定效应,出生胎龄、输血时校正胎龄、出生体质量和输血时体质量纳入协变量进行统计分析,检验水准α=0.05。
共纳入患儿71例,中位出生胎龄29(24~37)周,中位输血时日龄43(2~139) d,中位出生体质量2 195(710~3 950) g,输血时体质量(2 199±689) g,1、5 min Apgar分别为6.5(3.0~10.0)和8.0(1.0~10.0)分。中度贫血组患儿17例(24%),重度贫血组患儿54例(76%),中度贫血组患儿出生胎龄和输血时矫正胎龄较小(U=3.365、2.085,均P<0.05),出生体质量和输血时体质量较低(U=3.120、2.958,均P<0.05),见表1。
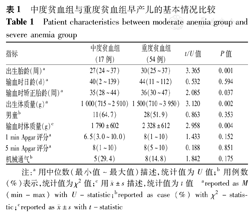
中度贫血组与重度贫血组早产儿的基本情况比较
Patient characteristics between moderate anemia group and severe anemia group
中度贫血组与重度贫血组早产儿的基本情况比较
Patient characteristics between moderate anemia group and severe anemia group
| 指标 | 中度贫血组(17例) | 重度贫血组(54例) | t/U值 | P值 |
|---|---|---|---|---|
| 出生胎龄(周)a | 27(24~37) | 30(25~37) | 3.365 | 0.001 |
| 输血时日龄(d)a | 40(2~139) | 44(11~112) | 0.532 | 0.594 |
| 输血时矫正胎龄(周)a | 35(28~44) | 36(30~47) | 2.085 | 0.037 |
| 出生体质量(g)a | 1 000(715~2 910) | 1 500(710~3 950) | 3.120 | 0.002 |
| 男童b | 11(64.7) | 28(51.9) | 0.863 | 0.353 |
| 输血时体质量(g)c | 1 790±602 | 2 328±612 | 2.958 | 0.004 |
| 1 min Apgar评分a | 6.5(3.0~10.0) | 8(1~10) | 1.433 | 0.152 |
| 5 min Apgar评分a | 8(1~10) | 8(5~10) | 0.188 | 0.851 |
| 机械通气b | 5(29.4) | 8(14.8) | 1.842 | 0.175 |
注:a用中位数(最小值~最大值)描述,统计值为U值;b用例数(%)表示,统计值为χ2值;c用 ±s描述,统计值为t值 areported as M (min-max) with U-statistic;breported as case (%) with χ2-statistic;creported as
±s描述,统计值为t值 areported as M (min-max) with U-statistic;breported as case (%) with χ2-statistic;creported as  ±s with t-statistic
±s with t-statistic
与红细胞输注前2 h比较,2组患儿红细胞输注后2 h HR均明显降低(t=-2.099、-4.204,均P<0.05),舒张压均明显升高(t=3.131、6.038,均P<0.05),平均动脉压均明显升高(t=3.329、5.313,均P<0.05)。2组患儿红细胞输注前2 h与输注后2 h的TcSaO2和收缩压的差异均无统计学意义,见表2。
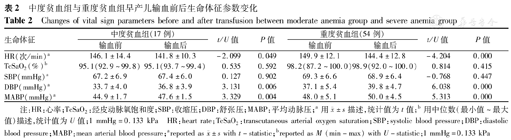
中度贫血组与重度贫血组早产儿输血前后生命体征参数变化
Changes of vital sign parameters before and after transfusion between moderate anemia group and severe anemia group
中度贫血组与重度贫血组早产儿输血前后生命体征参数变化
Changes of vital sign parameters before and after transfusion between moderate anemia group and severe anemia group
| 生命体征 | 中度贫血组(17例) | t/U值 | P值 | 重度贫血组(54例) | t/U值 | P值 | ||
|---|---|---|---|---|---|---|---|---|
| 输血前 | 输血后 | 输血前 | 输血后 | |||||
| HR(次/min)a | 146.1±14.4 | 141.8±10.3 | -2.099 | 0.049 | 149.9±12.1 | 144.4±12.8 | -4.204 | 0.000 |
| TcSaO2 (%)b | 95.1(92.9~99.8) | 95.1(93.7~99.4) | 0.535 | 0.592 | 98.2(87.2~100.0) | 98.9(92.0~100.0) | 0.814 | 0.415 |
| SBP(mmHg)a | 67.2±6.9 | 67.4±6.0 | 0.127 | 0.902 | 69.3±6.6 | 68.9±6.4 | -0.768 | 0.447 |
| DBP(mmHg)a | 33.7±4.0 | 36.8±3.9 | 3.131 | 0.006 | 37.1±5.4 | 39.8±4.7 | 6.038 | 0.000 |
| MABP(mmHg)a | 44.9±1.7 | 47.6±1.5 | 3.329 | 0.004 | 48.0±5.1 | 50.0±4.5 | 5.313 | 0.000 |
注:HR:心率;TcSaO2:经皮动脉氧饱和度;SBP:收缩压;DBP:舒张压;MABP:平均动脉压;a用 ±s描述,统计值为t值;b用中位数(最小值~最大值)描述,统计值为U值;1 mmHg=0.133 kPa HR:heart rate;TcSaO2:transcutaneous arterial oxygen saturation;SBP:systolic blood pressure;DBP:diastolic blood pressure;MABP:mean arterial blood pressure;areported as
±s描述,统计值为t值;b用中位数(最小值~最大值)描述,统计值为U值;1 mmHg=0.133 kPa HR:heart rate;TcSaO2:transcutaneous arterial oxygen saturation;SBP:systolic blood pressure;DBP:diastolic blood pressure;MABP:mean arterial blood pressure;areported as  ±s with t-statistic;breported as M (min-max) with U-statistic;1 mmHg=0.133 kPa
±s with t-statistic;breported as M (min-max) with U-statistic;1 mmHg=0.133 kPa
与红细胞输注前2 h比较,所有患儿红细胞输注过程中CrSO2平均增加1.96%(t=9.536,P<0.001),CFOE平均降低-0.02(t=-8.688,P<0.001)。
与红细胞输注前2 h比较,中度贫血组患儿红细胞输注后2 h的CrSO2升高(t=3.874,P<0.05),CFOE降低(t=-4.091,P<0.05);重度贫血组患儿红细胞输注过程中CrSO2明显升高(t=9.221,P<0.001),CFOE显著降低(t=-8.583,P<0.001),且此作用一直持续至红细胞输注后2 h(t=5.926、-5.556,P<0.001),见表3、表4。
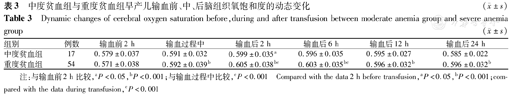
中度贫血组与重度贫血组早产儿输血前、中、后脑组织氧饱和度的动态变化 ( ±s)
±s)
Dynamic changes of cerebral oxygen saturation before,during and after transfusion between moderate anemia group and severe anemia group ( ±s)
±s)
中度贫血组与重度贫血组早产儿输血前、中、后脑组织氧饱和度的动态变化 ( ±s)
±s)
Dynamic changes of cerebral oxygen saturation before,during and after transfusion between moderate anemia group and severe anemia group ( ±s)
±s)
| 组别 | 例数 | 输血前2 h | 输血过程中 | 输血后2 h | 输血后6 h | 输血后12 h | 输血后24 h |
|---|---|---|---|---|---|---|---|
| 中度贫血组 | 17 | 0.579±0.037 | 0.591±0.032 | 0.599±0.035a | 0.596±0.035 | 0.595±0.027 | 0.585±0.022 |
| 重度贫血组 | 54 | 0.571±0.038 | 0.592±0.039b | 0.605±0.038bc | 0.603±0.035bc | 0.596±0.032b | 0.596±0.032b |
注:与输血前2 h比较,aP<0.05,bP<0.001;与输血过程中比较,cP<0.001 Compared with the data 2 h before transfusion,aP<0.05,bP<0.001;compared with the data during transfusion,cP<0.001
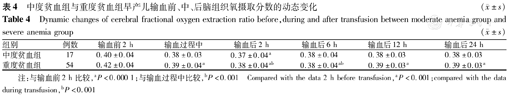
中度贫血组与重度贫血组早产儿输血前、中、后脑组织氧摄取分数的动态变化 ( ±s)
±s)
Dynamic changes of cerebral fractional oxygen extraction ratio before,during and after transfusion between moderate anemia group and severe anemia group ( ±s)
±s)
中度贫血组与重度贫血组早产儿输血前、中、后脑组织氧摄取分数的动态变化 ( ±s)
±s)
Dynamic changes of cerebral fractional oxygen extraction ratio before,during and after transfusion between moderate anemia group and severe anemia group ( ±s)
±s)
| 组别 | 例数 | 输血前2 h | 输血过程中 | 输血后2 h | 输血后6 h | 输血后12 h | 输血后24 h |
|---|---|---|---|---|---|---|---|
| 中度贫血组 | 17 | 0.40±0.04 | 0.38±0.03 | 0.37±0.04a | 0.38±0.04 | 0.38±0.03 | 0.38±0.03 |
| 重度贫血组 | 54 | 0.42±0.04 | 0.39±0.04a | 0.38±0.04ab | 0.38±0.04ab | 0.39±0.03a | 0.39±0.03a |
注:与输血前2 h比较,aP<0.000 1;与输血过程中比较,bP<0.001 Compared with the data 2 h before transfusion,aP<0.001;compared with the data during transfusion,bP<0.001
与红细胞输注前2 h的CrSO2比较,重度贫血组患儿红细胞输注后24 h的CrSO2明显升高(t=6.894,P<0.001),而CFOE显著降低(t=-8.536,P<0.001);但中度贫血组患儿红细胞输注后24 h的CrSO2和FTOE与红细胞输注前2 h的差异无统计学意义,见图1。


注:CrSO2:脑组织氧饱和度;CFOE:脑组织氧摄取分数;aP<0.05,bP<0.001 CrSO2:cerebral oxygen saturation;CFOE:cerebral fractional oxygen extraction ratio;aP<0.05,bP<0.001
红细胞输注后2组患儿HR下降,说明红细胞输注后缓解了机体组织缺氧,改善了心脏代偿功能[9]。红细胞输注后2组患儿收缩压的改变差异无统计学意义,但舒张压和平均动脉压升高,考虑可能与红细胞数目增多,血液黏稠度增大,外周循环阻力增加有关[10]。本研究未观察到红细胞输注后TcSaO2的明显改变,国外学者的研究中红细胞输注后TcSaO2也无明显改变[11,12]。
所有患儿红细胞输注过程中CrSO2增加,CFOE降低,表明红细胞输注后Hb水平升高,机体携氧能力增强,氧运输增加,患儿脑组织氧合得到改善[13]。与中度贫血组早产儿比较,重度贫血组患儿红细胞输注后脑组织饱和度和氧摄取分数出现变化的时间更早,变化的幅度更大,说明重度贫血组患儿可能存在脑组织缺氧,更受益于红细胞输注。进一步比较发现重度贫血组红细胞输注后24 h的CrSO2高于红细胞输注前2 h的CrSO2,但中度贫血组患儿红细胞输注后24 h的CrSO2与红细胞输注前2 h的差异无统计学意义,说明中度贫血组患儿红细胞输注后脑组织氧合改善小,过早红细胞输注可能增加不必要的氧运输,增加患儿机体氧化应激的风险[14]。目前临床情况不同的早产儿红细胞输注的Hb阈值也不同,患儿的临床情况很难定量评估,因此,有时候新生儿科临床医师很难判断早产儿是否需要红细胞输注[14]。本研究虽未能明确脑组织缺氧时的Hb临界值,但发现利用NIRS监测仪进行脑组织氧合监测可判断患儿脑组织是否缺氧,进一步明确患儿是否需要红细胞输注。近年Andersen等[15]的研究发现红细胞输注前CFOE较高的患儿红细胞输注后CFOE降低幅度更大;Seidel等[16]的研究发现红细胞输注前CrSO2较低的患儿红细胞输注后CrSO2升高幅度更大,提示是否可以找到合理的NIRS监测指标用于指导红细胞输注,需进一步的深入研究。
脑血流受多因素的影响,二氧化碳分压[p(CO2)]是调节脑血流最主要的因素。本研究中纳入多为自主呼吸患儿,尽可能排除了p(CO2)对患儿脑组织氧合的影响。再者,生理性应激和感染可能会影响患儿的组织氧耗,但研究期间尽量减少应激事件的发生,且研究期间没有患儿发生新的感染。除上述提及的混杂因素外,研究仍存在一些不足之处。本研究是小样本单中心前瞻性队列研究,为获得更具说服力的结论,需进行多中心大样本研究。患儿额叶皮质是否是脑组织氧合监测最可靠的区域,其他皮质区域,甚至是皮质下结构监测脑组织氧合是否更合理。患儿在病情评估、临床护理后重置探头,可能引起探头位置微小变化,导致CrSO2产生变异。研究未利用多普勒超声检查同步监测脑血流,未能得到可靠的反映脑血流的指标。
总之,研究虽未明确脑组织缺氧时的Hb临界值,但提示新生儿科医师重度贫血(Hb<90 g/L)可能增加早产儿脑组织缺氧的风险。NIRS监测仪脑氧合监测为早产儿红细胞输注的临床管理提供了新的思路。
所有作者均声明不存在利益冲突



























