
神经系统副肿瘤综合征是一组与肿瘤相关的影响中枢神经和外周神经肌肉系统的罕见的自身免疫性疾病,如累及大脑边缘叶系统则表现为副肿瘤性边缘叶脑炎。早期识别神经系统副肿瘤综合征患者有一定困难,因为导致副肿瘤性神经系统疾病的肿瘤常常无症状或隐匿,且单次相关抗体检测可能出现假阴性。在此,我们报道1例抗Hu、Yo抗体双重阳性的副肿瘤性边缘叶脑炎患者,并结合相关文献进一步分析讨论,以提高对该病的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经系统副肿瘤综合征(PNS)是一组由肿瘤远隔效应引起的疾病,其作用机制是自身免疫介导的神经损伤,而非肿瘤的直接侵袭或转移。PNS可以影响神经系统的不同部位,如累及大脑边缘叶系统即表现为副肿瘤性边缘叶脑炎(paraneoplastic limbic encephalitis,PLE)[1]。现将我院收治的1例抗Hu、Yo抗体双重阳性的PLE患者病例报道如下。
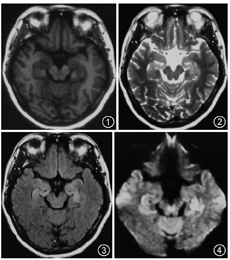
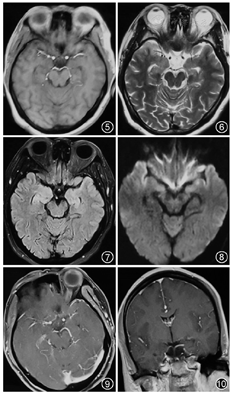
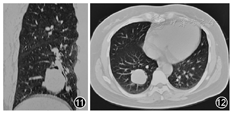
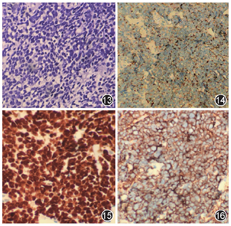
患者45岁,女性,既往体健。因"记忆力减退、精神异常3个月"余于2018年5月25日入滨州医学院附属学院。患者于2018年2月14日无明显诱因出现记忆力减退,表现为近期事件遗忘,反应尚可,可正常交流,2月16日后出现情绪不稳定,烦躁不安,时有喊叫及自言自语,交流困难,睡眠障碍,当时测体温38 ℃,遂就诊博兴县人民医院,颅脑MRI提示双侧海马硬化(图1,图2,图3,图4),血常规:嗜酸细胞百分比0%,单核细胞计数0.73×109/L,嗜酸细胞计数0×109/L,余未见明显异常。未予治疗,由于上述症状持续存在,于2月18日就诊胜利油田中心医院,行颅脑MRI+磁共振波谱(MRS)示双侧海马FLAIR信号增高,不除外海马硬化;MRS示左侧海马N-乙酰天冬氨酸(NAA)减低,NAA/肌酐、NAA/肌酐+胆碱比值降低。腰椎穿刺:颅内压190 mmH2O(1 mmH2O=0.009 8 kPa),脑脊液常规:无色透明,无凝块,潘氏蛋白定性(-),白细胞计数3×106/L,白细胞单核100%。脑脊液生化:蛋白0.41 g/L,葡萄糖3.8 mmol/L,氯化物122.3 mmol/L,腺苷脱氨酸0.3 U/L。新型隐球菌涂片、抗酸杆菌涂片阴性。脑脊液神经系统副肿瘤综合征系列:阴性。脑脊液自身免疫性脑炎系列:N-甲基-D-天冬氨酸受体(NMDA)型抗体、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)1型抗体、AMPA2型抗体、抗富亮氨酸胶质瘤失活蛋白抗体、抗接触蛋白关联蛋白2(CASPR2)、抗GABAB受体抗体IgG阴性。血清自身免疫性脑炎系列:NMDA型抗体、AMPA1型抗体、AMPA2型抗体、抗富亮氨酸胶质瘤失活蛋白抗体、抗CASPR2、抗GABAB受体抗体IgG阴性。血清肿瘤标志物:鳞状细胞癌相关抗原、胃泌素释放肽前体、糖链抗原、神经元特异性烯醇化酶、细胞角蛋白19片段、甲胎蛋白、癌胚抗原、异常凝血酶原在正常范围,糖链抗原72-4 16.24 U/ml(高于正常值)。血常规:嗜酸细胞百分比0.3%,单核细胞计数0.64×109/L,余未见明显异常。诊断:病毒性脑炎、双侧海马硬化。给予阿昔洛韦、奥拉西坦治疗15 d出院,出院时无发热,情绪较稳定,仍近记忆力减退。5月15日受惊吓(打雷)后再次出现烦躁不安、时有吵闹,胡言乱语,无法交流,夜间不眠,测体温38.6 ℃,再次就诊博兴县人民医院,行颅脑CT未见异常,血常规示中性粒细胞百分比75.6%,淋巴细胞百分比19.1%,嗜酸性粒细胞百分比0.3%,余无异常,未予治疗。后再次就诊胜利油田中心医院,颅脑MRI+增强示双侧颞叶海马区斑片状长T2高信号,弥散加权成像(DWI)异常信号;增强后未见异常强化,除外脑炎可能(图5,图6,图7,图8,图9,图10)。胸部CT示右肺下叶占位,建议增强扫描,双肺间质性改变(图11,图12)。血常规:单核细胞百分比13.7%,余无异常。肿瘤标志物:鳞状细胞癌相关抗原8.60 ng/ml,神经元特异性烯醇化酶48.13 ng/ml。血T细胞绝对值计数:CD3+细胞绝对计数1 600×109/L,CD4+772×109/L,CD8+724×109/L,CD4+/CD8+:1.07,均在正常范围。诊断:右肺癌、颅内感染?认知障碍,给予阿昔洛韦、头孢曲松、吡拉西坦、丙戊酸、苯巴比妥钠等治疗7 d,体温波动在37.2~38.1 ℃,症状无好转,为求进一步诊治于5月25日入滨州医学院附属医院。入院体格检查:体温37.5 ℃,意识清楚,反应迟钝,交流困难,言语欠流利,记忆力、计算力、定向力减退,余神经系统体格检查无明显异常。相关检查回报:血清副肿瘤综合征检测:抗Hu、Yo抗体(+)。氟代脱氧葡萄糖(FDG)-正电子发射计算机断层扫描(PET)示右肺高代谢肿块,纵隔内高代谢淋巴结,考虑右肺癌并淋巴结转移;直肠近肛管处FDG代谢增高;甲状腺双侧叶病变,代谢不高;双侧基底节区FDG代谢略稀疏。右肺占位穿刺活体组织检查:小细胞癌,免疫组织化学染色:细胞角蛋白(CK)(+)、突触素(+)、嗜铬素A(+)、CD56+、甲状腺转录因子-1(+)、Ki-67阳性率约90%(图13,图14,图15,图16)。脑电图示背景为弥漫性低-中波幅不规则慢波,两侧无明显不对称,基线不稳(图17)。





诊断:(1)抗Hu、Yo抗体阳性副肿瘤性边缘叶脑炎;(2)右肺小细胞癌。治疗经过:给予甲泼尼龙抑制免疫反应,奈达铂+依托泊苷方案化疗,治疗1个月后出院。出院时无发热,仍有反应迟钝、记忆力减退、交流略困难。出院1个月后电话随诊,患者体温36.9~37.0 ℃,反应迟钝及记忆力明显好转,可正常交流。
目前认为,免疫机制是产生PNS的主要机制。神经元中存在与肿瘤相关的抗原,后者使机体免疫应答产生的抗体与神经元中相似抗原产生交叉免疫反应,于是损害神经组织而出现临床症状。如累及大脑边缘叶系统则表现为PLE。边缘叶脑炎主要侵及边缘系统,临床症状主要为近记忆丧失、精神行为异常(如烦躁易激惹、幻觉等)及癫痫发作。抗Hu抗体和抗Yo抗体是其最常见的标志物,前者多见于小细胞肺癌,后者多见于妇科肿瘤或乳腺癌患者[2]。根据2004年Graus等[3]提出的PNS的诊断标准,本例患者经临床表现、影像学及实验室检查确诊为抗Hu、Yo抗体双重阳性PLE。
本例患者于外院第1次就诊时虽有边缘叶脑炎损害的临床及影像学表现,但因患者有发热、颅内压高的颅内感染表现,且血清和脑脊液副肿瘤及自身免疫性脑炎系列检查阴性,血清肿瘤标志物阴性,未行肺部影像学检查,因而误诊为病毒性脑炎,外院第二次就诊时虽行胸部CT发现右肺下叶占位,但因之前副肿瘤及自身免疫性脑炎系列检查阴性,仍未能诊断PLE。抗Hu抗体检测对诊断PNS具有较高的特异度(99%)和敏感度(80%以上)[4,5],但仍有不少患者体内未能检测出任何已知的相关抗体,秦应之等[6]研究发现PLE患者抗Hu抗体阳性率为2/7。我们认为对于可疑PLE患者应该常规检测肿瘤性神经抗体,以提高早期诊断效率,但这些指标并非确诊必要条件,需结合其他检查结果综合判断,必要时可复查相关抗体。
Hu抗原本质是表达于神经元细胞核表面的一种相对分子质量为38 000的神经特异性RNA结合蛋白,在mRNA编码蛋白质中起重要作用[7]。某些肿瘤细胞,特别是小细胞肺癌细胞也有该蛋白表达,因此可以诱导机体产生具有自身抗体性质的抗Hu抗体,并介导自身免疫性的神经系统损害。Sillevis Smitt等[8]报道了73例抗Hu抗体阳性的PNS患者,其临床类型包括感觉神经病(55%)、小脑变性(22%)、边缘性脑炎(15%)和脑干脑炎(16%),23%伴有自主神经功能障碍如胃肠动力障碍(14%);85%的患者发现肿瘤,其中77%为肺癌;与该患者病变相符。
抗Yo抗体是由Greenlee和Brashear[9]于1983年在副肿瘤性小脑变性患者中发现的攻击浦肯野细胞的高效价抗体。经免疫组织化学染色显示其靶抗原为浦肯野细胞的一种颗粒性胞质标志物,经免疫印迹法已证实其相对分子质量为34 000和62 000的2种已被克隆的抗原[3],相关抗体可直接攻击由浦肯野细胞以及相关肿瘤所表达的小脑变性相关蛋白[10]。典型的抗Yo抗体阳性副肿瘤综合征首发表现常为头晕、眩晕,随后出现进展迅速的共济失调、构音障碍、下跳性眼震以及震颤[11]。抗Yo抗体主要见于女性副肿瘤性小脑变性患者,绝大多数患者患有卵巢癌、乳腺癌、膀胱癌[3,12]。但也有文章报道抗Yo抗体阳性与肺癌相关[13]。该患者病程中无小脑、脑干受累临床表现,与临床常见的抗Yo抗体副肿瘤综合征不同。然而,抗Yo抗体并非总是导致疾病,有些表达在没有神经系统副肿瘤综合征的肿瘤患者中[14]。
抗Hu抗体是小细胞肺癌的指向性抗体,任海涛等[15]发现531例自身免疫性脑炎抗体阳性患者中合并其他抗神经元抗体阳性的患者仅有10例,其中5例抗GABA受体抗体阳性患者中同时合并抗Hu抗体阳性,均为小细胞肺癌患者。抗Yo抗体与副肿瘤性小脑变性对应,多合并妇科恶性肿瘤,但该患者无小脑性共济失调的表现,PET-CT检查未发现妇科肿瘤。关鸿志等[16]曾对北京协和医院神经内科抗Yo抗体阳性的病例进行回顾,发现如果临床上没有小脑性共济失调时,抗Yo抗体阳性对肿瘤的指向意义不大。但有文章报道抗Yo抗体阳性与肺癌相关[13],则抗Hu、抗Yo抗体双重阳性对肺癌可能有更大指向意义。但Seluk等[2]发现多重抗神经元抗体阳性对神经系统综合征和肿瘤类型并无倾向性。
针对本病例特点,我们应对PLE的诊断提高认识,对怀疑PLE患者,应进行相关神经元抗体的筛查及相关影像学检查尽快明确诊断,寻找肿瘤证据,给予针对性治疗;对于相关神经元抗体阴性或未发现肿瘤者应随诊观察,必要时复查,以防漏诊或误诊。对于多重抗神经元抗体阳性患者可提示潜在肿瘤类型,有助于及时明确病因,但应具体患者具体分析。
所有作者均声明不存在利益冲突
None declared



























