
探讨1,25-二羟维生素D3[1,25(OH)2D3]对食物过敏(FA)小鼠的影响及其作用机制。
清洁级4周龄BALB/c小鼠40只随机分为5组,每组8只。包括对照组(C组)、FA模型组(FA组)。其中FA组根据1,25(OH)2D3干预剂量不同,分为FA0组(0)、FA低组[10 μg/(kg·d)]、FA中组[50 μg/(kg·d)]和FA高组[100 μg/(kg·d)]。卵清蛋白(OVA)致敏和激发建立FA模型,不同剂量1,25(OH)2D3灌胃干预,对照组以9 g/L盐水替代。末次激发后留取小鼠血清,采用酶联免疫法测血清中OVA-IgE、白细胞介素(IL)-9和IL-17水平;留取小鼠小肠组织行HE染色和病理学检查。
与C组相比,FA0组和FA高组小鼠小肠黏膜有不同程度的破坏,小肠黏膜部分剥落,结构紊乱,绒毛上皮细胞局灶性脱落、坏死,固有层水肿、充血,大量炎性细胞浸润,但FA低和FA中组黏膜损伤轻,肠上皮基本完整,无明显充血、水肿,炎性细胞浸润程度较轻。不同组血清IgE、IL-9、IL-17水平比较差异均有统计学意义(F=40.770、9.530、5.624,均P<0.05)。与FA0组[(41.87±3.19) ng/L]比较,FA低组[(22.71±4.77) ng/L]和FA中组[(16.34±2.81) ng/L]OVA-IgE显著降低(t=5.533、11.835,均P<0.01),但FA高组[(36.29±6.52) ng/L]无显著差异(t=1.673,P>0.05)。与FA0组[(161.77±50.44) ng/L]比较,FA低组[(94.29±18.79) ng/L]和FA中组[(84.45±30.88) ng/L]小鼠血清IL-9水平显著降低,差异均有统计学意义(t=3.267、3.366,均P<0.01),而与FA高组[36.29±6.52 ng/L]无明显差异(t=0.777,P>0.05)。与FA0组[(81.55±29.37) ng/L]比较,FA高组[(133.58±47.05) ng/L]小鼠血清IL-17水平显著增高,差异有统计学意义(t=2.653,P<0.05);而FA低组[(79.41±25.15) ng/L]、FA中组[(58.81±26.00) ng/L]较FA0组[(81.55±29.37) ng/L]水平低,但差异均无统计学意义(t=0.154、1.640,均P>0.05)。
补充低、中剂量1,25(OH)2D3可抑制小鼠FA,而高剂量的1,25(OH)2D3却加重小鼠FA的表现,1,25(OH)2D3对IL-9分泌的影响是其影响FA的机制之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,食物过敏(food allergy,FA)的发生率呈明显上升趋势,FA可严重影响患儿的生长发育和生活质量,并可延续至成年,也造成了相当的社会压力,鉴于FA的高发病率及不良影响,对FA的研究也越来越受到重视。维生素D作为重要的免疫调节剂和常用营养补充剂,相关研究逐渐完善,但研究结果不尽一致,而且仍缺乏足够的实验室研究证据。1,25-二羟维生素D3[1,25(OH)2D3]是维生素D的活性形式,本研究旨在探讨1,25(OH)2D3对FA的影响并探讨可能的机制,对FA的预防和治疗提供新的方法和理论依据。
不含卵清蛋白(OVA)的标准饲料及纯净水;清洁级4周龄(相当于人类10~12岁)BALB/c小鼠(上海南方模式生物研究中心提供);白细胞介素(IL)-9酶联免疫吸附试验(ELISA)试剂盒,IL-17 ELISA试剂盒,IgE ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司);酶标仪(Bio-Rad,美国)。
选取40只4周龄BALB/c雌鼠依次编号,再按照随机数字表法分为5组,每组8只,其中包括对照组(C组)、食物过敏组(FA组),FA组根据1,25(OH)2D3干预的剂量不同分为FA0组(0)、FA低组[10 μg/(kg·d)]、FA中组[50 μg/(kg·d)]和FA高组[100 μg/(kg·d)]。
所有小鼠给予不含OVA的标准饲料及纯净水进行喂养。监测小鼠体质量、精神状态、粪便等。致敏阶段:第0、7、14天予小鼠腹腔注射含OVA 100 μg和氢氧化铝1 mg的无菌9 g/L盐水0.5 mL。激发阶段:自第14 d,每3天1次以OVA 9 g/L盐水溶液0.5 mL (含OVA 50 mg)灌胃激发,共6次。第4、5、6次激发后1 h观察小鼠腹泻、过敏症状并记录。对照组:与FA足小时、同时间、等量9 g/L盐水进行腹腔注射及灌胃。自激发始每5 d监测小鼠体质量。
不同浓度的1,25(OH)2D3溶液配制:首先配制1,25(OH)2D3-二甲基亚砜[ 1,25(OH)2D3-DMSO]:取1 mg 1,25(OH)2D3,加入DMSO 1 mL混匀,使之完全溶解,即配制成1 g/L的l,25(OH)2D3-DMSO。再用pH值为7.4的磷酸盐缓冲液(PBS)将l,25(OH)2D3-DMSO稀释为不同浓度的l,25(OH)2D3溶液:低剂量组(FA低)2 mg/L、中剂量组(FA中)10 mg/L、高剂量组(FA高)20 mg/L,然后用DMSO溶液滴定,使各组DMSO浓度均为1%,无维生素D干预组(FA0)以1%的DMSO-PBS代替。干预方式:隔天以灌胃的方式(5 mL/kg)给予各组小鼠不同浓度的l,25(OH)2D3,1次/d,持续3周,直至实验结束。
处死小鼠,留取血液,凝血后离心(2 000×g,20 min),取血清,按照ELISA试剂盒说明检测小鼠血清IgE、IL-9、IL-17的蛋白表达。处死小鼠留取小肠长度约为0.5 cm组织各2段,置中性甲醛固定液中、石蜡包埋和切片用于常规病理检查。
应用SPSS 22.0软件对数据进行单因素分析,结果以 ±s表示,组间比较采用方差分析,对各组平均值进行两独立样本的t检验,P<0.05为差异有统计学意义。
±s表示,组间比较采用方差分析,对各组平均值进行两独立样本的t检验,P<0.05为差异有统计学意义。
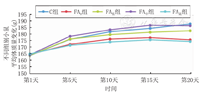
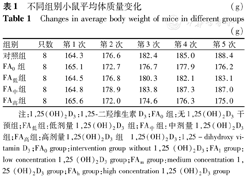
经过致敏阶段,FA0组5只小鼠(62.5%)出现了排稀便,进食量减少,6只(75.0%)活动减少;FA高组有6只(75.0%)出现排稀便,进食量减少,5只(62.5%)活动减少;FA低组2只出现轻微排稀便;FA中组小鼠无明显排稀便或进食减少现象。FA中组小鼠体质量增长与对照组基本相当,其余3组小鼠体质量增长明显低于对照组,且FA高组小鼠体质量增长最为缓慢,并于后期出现体质量下降情况。各组小鼠平均体质量增长见表1、图1。

注:1,25(OH)2D3:1,25-二羟维生素D3;FA0组:无1,25(OH)2D3干预组;FA低组:低剂量1,25(OH)2D3组;FA中组:中剂量1,25(OH)2D3组;FA高组:高剂量1,25(OH)2D3组 1,25(OH)2D3:1,25-dihydroxy vitamin D3;FA0 group:intervention group without 1,25 (OH)2D3;FAl group:low concentration 1,25 (OH)2D3 group;FAm group:medium concentration 1,25(OH)2D3 group;FAh group:high concentration 1,25 (OH)2D3 group
不同组别小鼠平均体质量变化(g)
Changes in average body weight of mice in different groups(g)
不同组别小鼠平均体质量变化(g)
Changes in average body weight of mice in different groups(g)
| 组别 | 只数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
|---|---|---|---|---|---|---|
| 对照组 | 8 | 164.3 | 176.6 | 182.4 | 185.0 | 188.4 |
| FA0组 | 8 | 165.1 | 172.7 | 176.7 | 177.9 | 176.2 |
| FA低组 | 8 | 164.5 | 176.8 | 180.3 | 182.1 | 183.1 |
| FA中组 | 8 | 164.8 | 178.9 | 183.8 | 187.3 | 187.0 |
| FA高组 | 8 | 165.6 | 172.0 | 174.6 | 176.3 | 175.0 |
注:1,25(OH)2D3:1,25-二羟维生素D3;FA0组:无1,25(OH)2D3干预组;FA低组:低剂量1,25(OH)2D3组;FA中组:中剂量1,25(OH)2D3组;FA高组:高剂量1,25(OH)2D3组 1,25(OH)2D3:1,25-dihydroxy vitamin D3;FA0 group:intervention group without 1,25 (OH)2D3;FAl group:low concentration 1,25 (OH)2D3 group;FAm group:medium concentration 1,25 (OH)2D3 group;FAh group:high concentration 1,25 (OH)2D3 group
2组小鼠肠黏膜形态学变化见图2。与C组相比,FA0组和FA高组小鼠小肠黏膜有不同程度的破坏,小肠黏膜部分剥落,结构紊乱,绒毛上皮细胞局灶性脱落、坏死,固有层水肿、充血,大量炎性细胞浸润,但FA低和FA中组黏膜损伤轻,肠上皮基本完整,无明显充血、水肿,炎性细胞浸润程度较轻。
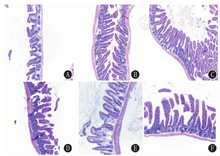

注:1,25(OH)2D3:1,25-二羟维生素D3 1,25(OH)2D3:1,25-dihydroxy vitamin D3
各组小鼠1,25(OH)2D3补充后血清水平:C组(64.97±20.7) nmol/L、FA0组(63.87±19.77) nmol/L、FA低组(79.8±26.68) nmol/L、FA中组(97.24±20.49) nmol/L、FA高组(115.03±29.27) nmol/L。
各组间血清IgE水平比较差异有统计学意义(P<0.05)。与FA0组比较,FA低组和FA中组OVA-IgE显著降低(t=5.533、11.835,均P<0.01),但FA高组差异无统计学意义(t=1.673,P>0.05),见表2。
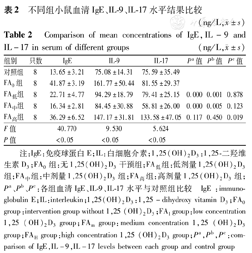
不同组小鼠血清IgE、IL-9、IL-17水平结果比较(ng/L, ±s)
±s)
Comparison of mean concentrations of IgE,IL-9 and IL-17 in serum of different groups(ng/L, ±s)
±s)
不同组小鼠血清IgE、IL-9、IL-17水平结果比较(ng/L, ±s)
±s)
Comparison of mean concentrations of IgE,IL-9 and IL-17 in serum of different groups(ng/L, ±s)
±s)
| 组别 | 只数 | IgE | IL-9 | IL-17 | Pa值 | Pb值 | Pc值 |
|---|---|---|---|---|---|---|---|
| 对照组 | 8 | 13.65±3.21 | 75.08±14.31 | 75.59±35.49 | |||
| FA0组 | 8 | 41.87±3.19 | 161.77±50.44 | 81.55±29.37 | |||
| FA低组 | 8 | 22.71±4.77 | 94.29±18.79 | 79.41±25.15 | 0.000 | 0.001 | 0.878 |
| FA中组 | 8 | 16.34±2.81 | 84.45±30.88 | 58.81±26.00 | 0.000 | 0.005 | 0.123 |
| FA高组 | 8 | 36.29±6.52 | 147.17±31.81 | 133.58±47.05 | 0.117 | 0.450 | 0.019 |
| F值 | 40.770 | 9.530 | 5.624 | ||||
| P值 | <0.05 | <0.05 | <0.05 |
注:IgE:免疫球蛋白E;IL:白细胞介素;1,25(OH)2D3:1,25-二羟维生素D3;FA0组:无1,25(OH)2D3干预组;FA低组:低剂量1,25(OH)2D3组;FA中组:中剂量1,25(OH)2D3组;FA高组:高剂量1,25(OH)2D3组;Pa、Pb、Pc:各组血清IgE、IL-9、IL-17水平与对照组比较 IgE :immunoglobulin E;IL:interleukin;1,25(OH)2D3:1,25-dihydroxy vitamin D3;FA0 group:intervention group without 1,25 (OH)2D3;FAl group:low concentration 1,25 (OH)2D3 group;FAm group:medium concentration 1,25 (OH)2D3 group;FAH group:high concentration 1,25 (OH)2D3 group;Pa,Pb,Pc:comparison of IgE,IL-9,IL-17 levels between each group and control group
组间差异有统计学意义(P<0.05)。与FA0组比较,FA低组和FA中组小鼠血清IL-9水平显著降低(t=3.267、3.366,P<0.01),而与FA高组比较差异无统计学意义(t=0.777,P>0.05),见表2。
组间差异有统计学意义(P<0.05)。与FA0组比较,FA高组小鼠血清IL-17水平显著增高(t=2.653,P<0.05),而FA低组、FA中组较FA0组水平低,但差异均无统计学意义(t=0.154、1.640,均P>0.05),见表2。
FA指食物进入人体后,机体对其产生异常免疫反应,从而导致机体生理功能的紊乱和/或组织损伤。接触少量的致敏性食物即可引发诸如胃肠功能紊乱、荨麻疹和呼吸道炎症等临床症状,严重时可危及生命。近二、三十年来FA发生率呈全球性逐年上升趋势,1997年至2007年美国18岁以下的儿童FA发生率增加了18%,澳大利亚FA引起的过敏相关死亡人数平均每年增加9.7%[1]。1999年至2009年,中国FA患病率从3.5%上升至7.7%[2]。FA常合并其他免疫性疾病,如支气管哮喘(哮喘)、变应性皮炎,严重影响儿童的生长发育,并且增加了社会负担。新生儿和幼儿是罹患FA的易感人群,可能与胃肠道黏膜未发育成熟相关,严重影响婴幼儿生长发育[3,4]。
维生素D具有重要的免疫调节作用。流行病学、遗传学和基础科学研究表明,维生素D在某些系统性和特定器官的自身免疫疾病的发病机制中具有潜在的作用[5]。维生素D缺乏与FA的患病率呈正相关。墨尔本一项研究结果表明,维生素D不足会增加儿童1岁时的FA风险。在维生素D缺乏的婴儿中,花生或蛋类过敏的发生率是普通婴儿的3倍,FA婴儿维生素D缺乏的发生率是无FA婴儿的6倍[6]。然而,也有研究认为,高维生素D水平或过量口服补充维生素D可能与过敏性疾病发生率增加有关,Vassallo和Camargo[7]研究发现,孕期及脐带血维生素D水平越高,儿童在2岁内发生FA的风险越大。
本研究结果显示,各组小鼠1,25(OH)2D3补充后血清水平分别为:C组(64.97±20.7) nmol/L、FA0组(63.87±19.77) nmol/L、FA低组(79.8±26.68) nmol/L、FA中组(97.24±20.49) nmol/L、FA高组(115.03±29.27) nmol/L,按照目前国际维生素D水平评估标准[8],维生素D不足:50.0~<75.0 nmoL/L、维生素D充足:75.0~<250.0 nmoL/L、维生素D过量:250.0~<375.0 nmoL/L(我国维生素D过量标准125.0~<150.0 nmol/L)。本研究小鼠补充1,25(OH)2D3后血清水平均在正常范围,不存在维生素D过量。与对照组相比,FA0组、FA低组和FA高组的OVA-IgE显著增高,而FA中组无显著差异,虽然FA低和FA中组的OVA-IgE升高,但平均值显著低于FA0组。与FA0组相比,FA低和FA中组出现过敏反应的小鼠数量和反应程度均减轻,体质量增长较理想。而FA高组小鼠出现过敏反应的数量和程度均较相似,体质量增长较对照组严重落后,并出现体质量不增或体质量下降的情况。由此推测,生命早期补充低剂量和中等剂量的1,25(OH)2D3可降低FA的发生率或严重程度,且中等剂量效果优于低剂量,而高剂量的1,25(OH)2D3反而降低了这种效果甚至加重了过敏反应,与以往1,25(OH)2D3对于哮喘的研究[9]一致。从IL-9水平看,FA0组和FA高组小鼠血清IL-9水平显著增高。而FA低组和FA中组与对照组比较无显著差异。与FA0组比较,FA中组小鼠血清IL-9水平更低。从IL-17水平看,与C组相比,FA低组、FA中组和FA0组水平无明显差异,但FA高组小鼠血清IL-17水平显著增高。可以推测,高剂量1,25(OH)2D3有可能增加FA的发生。
目前FA的发病机制尚不明确,主要受到遗传、环境和基因组-环境相互作用的影响[10,11,12]。维生素D主要通过影响Toll样受体和T淋巴细胞分化,尤其是Th17对免疫系统进行调节。维生素D可以提高内源性抗生素(如抗菌肽和防御素)的转录,发挥抗感染作用,保持上皮屏障的完整性[12,13]。维生素D受体(VDR)广泛存在于多种免疫细胞,如单核细胞、T淋巴细胞和树突状细胞(DC)表面,1,25(OH)2D3与VDR结合后可诱导抗菌肽的产生,激活Toll样受体识别抗原,促进IL-9、IL-13等的表达[13]。维生素D缺乏时,抗菌肽分泌减少,在感染共同作用下可破坏肠道屏障完整性,这使得低分子食物蛋白渗透到免疫系统,导致IgE产生增加,增强Th2介导的免疫反应。一项利用肥大细胞(MCs)缺陷小鼠的早期研究表明,MCs可能在调节肠道屏障功能方面发挥重要作用,从而导致肠道过敏反应的产生[14]。IL-9是肥大细胞生长因子,小鼠模型中发现,IL-9在FA的发病机制中起着至关重要的作用。大量研究明IL-9作为一种Th2细胞因子可以促进2型免疫反应。最近研究表明,与健康个体相比,FA患者的十二指肠黏膜MCs产生高水平的IL-9和IL-13[14,15]。本研究中FA0组IL-9明显升高,而FA低组和FA中组IL-9与FA0组无明显差异,与IgE水平变化基本一致,低剂量和中等剂量1,25(OH)2D3可减轻或抵消小鼠的FA反应,IL-9可反映FA的发生和严重程度,可作为FA检测过程中的检测指标之一。IL-17的促炎作用在T淋巴细胞促发的炎性反应中起上游调节作用,主要通过促进Th17的激活和刺激上皮细胞、内皮细胞、成纤维细胞等产生多种细胞因子和生长因子,可诱导IL-6、IL-8、粒细胞集落刺激因子和化学增活素的表达,导致细胞侵入和组织破坏,完成炎性反应[9]。同时作为一种炎性反应的早期启动因子,IL-17也能通过促进促炎因子的释放来扩大炎性反应。有研究表明IL-17在肠道免疫性组织损伤中发挥重要作用[16]。本研究结果显示,IL-17在FA0组和FA高组中显著升高,表明IL-17与FA的发生呈正相关。维生素D可能通过IL-9机制作用于MCs对FA产生影响。
值得注意的是,当给小鼠补充大剂量的维生素D时,研究结果提示小鼠的FA反应增加,IgE、IL-9、IL-17水平明显升高,在以往研究[13]中有类似结果发生。由于维生素D促进或者抑制FA机制尚不明确,最近的研究表明,维生素D反馈分解代谢的表观遗传学在放大1,25(OH)D的生物有效性方面起重要作用[6],推测不同剂量的维生素D对预防FA中的作用是不同的,需要进一步的科学研究予以验证,中国儿童理想的血清维生素D界值水平仍需进一步完善。本研究上存在一些不足,样本数量较少以及因小鼠的肠壁过薄无法进行MCs等的计数,希望在今后的研究中予以完善。
综上所述,低、中剂量补充1,25(OH)2D3可抑制小鼠FA,而高剂量1,25(OH)2D3却加重小鼠FA的表现,1,25(OH)2D3对IL-9分泌的影响是其影响FA的机制之一。
所有作者均声明不存在利益冲突



























