
评价含四环素和甲硝唑四联疗法一线治疗青霉素过敏患者幽门螺杆菌(H.pylori)感染的疗效和安全性。
采用回顾性研究方法,收集2014年1月至2016年6月在北京大学第一医院就诊的因对青霉素过敏而接受含四环素和甲硝唑四联疗法一线治疗H.pylori感染的120例患者的临床资料。治疗方案为:兰索拉唑(30 mg/次,2次/d)+胶体果胶铋(150 mg/次,3次/d)+四环素(500 mg/次,3次/d)+甲硝唑(400 mg/次,3次/d),疗程14 d。所有患者均于治疗后7 d、14 d、治疗结束至少4周后进行随访,记录患者治疗期间症状和不良反应情况。疗程结束至少4周后采用13C-尿素呼气试验判断H.pylori根除情况。
所有患者中,男34例,女86例,平均年龄59岁。104例患者根除成功,56例(46.7%)患者出现不同程度不良反应,其中10例女性患者因头痛、呕吐、皮疹、乏力等症状终止治疗。按符合方案(PP)分析及按意向性(ITT)分析的H.pylori根除率分别为94.5%(104/110)和86.7%(104/120)。
含四环素和甲硝唑四联14 d疗法作为青霉素过敏患者H.pylori感染的一线治疗方案,H.pylori根除率较高,患者不良反应发生率较高,在治疗过程中应密切监测患者的不良反应发生情况,尤其是女性患者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幽门螺杆菌(H.pylori)是慢性胃炎、消化性溃疡、胃癌和胃黏膜相关淋巴组织(MALT)淋巴瘤等上胃肠道疾病的重要致病因素。我国成人H.pylori感染率为40%~60%[1,2]。质子泵抑制剂(PPI)联合铋剂和两种抗生素的四联疗法是目前用于H.pylori感染的一线治疗方法[3,4]。最理想的H.pylori根除治疗方案是指在治疗抗生素敏感菌株时根除率≥90%(优选≥95%)的方案[5],而针对青霉素过敏患者的抗生素选择比较困难。流行病学资料表明,在我国很多地区H.pylori对甲硝唑耐药率为60%~70%,克拉霉素为20%~38%,左氧氟沙星为30%~38%[6,7],四环素耐药率相对较低[7]。PPI联合铋剂、甲硝唑和四环素(PPI+BMT)四联疗法被国内外相关处理共识推荐用于青霉素过敏患者治疗H.pylori感染。在中国,由于多数地区H.pylori对甲硝唑耐药率较高,国内外共识均推荐在应用该方案时可通过增加甲硝唑剂量(1 600 mg/d)提高疗效[3,4],而延长方案的疗程也可以提高疗效[8]。增加抗生素剂量同时常常会导致不良反应发生风险增高。本研究通过对既往资料的回顾分析,评价含四环素和甲硝唑铋剂四联疗法作为青霉素过敏患者一线治疗H.pylori感染的疗效和安全性。
本研究采用回顾性分析方法。研究对象为2014年1月至2016年6月因H.pylori感染且对青霉素过敏到北京大学第一医院门诊就诊,因病情需要而接受了含四环素和甲硝唑四联疗法进行H.pylori一线根除治疗的患者。
入选标准:(1)因对青霉素或阿莫西林过敏,而不能接受含阿莫西林方案治疗;(2)既往未接受过H.pylori根除治疗;(3)年龄、性别不限;(4)所有患者均填写了H.pylori治疗登记表格,详细记录患者基本信息、病史、伴随症状及随访情况。排除标准:(1)治疗前1个月内使用过抑酸剂、铋剂或抗生素;(2)已知对本研究所用药物过敏者;(3)妊娠或哺乳期妇女;(4)患者不能表达自己主诉,不能依从本研究治疗方案。终止治疗标准:(1)治疗期间出现严重不良反应,患者无法耐受者;(2)治疗期间出现其他疾病干扰本次治疗者;(3)失访;(4)治疗期间妊娠。
共120例患者纳入研究,其中男34例,女86例,年龄19~75岁(平均59岁),病程2个月至30余年不等,吸烟者14例,饮酒者16例。其中慢性胃炎99例,消化性溃疡21例;伴有心血管疾病30例,内分泌疾病14例,过敏性疾病11例,皮肤病10例,呼吸道疾病3例;有胃癌家族史者11例。
所有患者在接受治疗前均采用13C-尿素呼气试验(13C-UBT)进行检测(德国FANci——13C呼气测定分析仪,深圳海德威公司尿素[13C]胶囊呼气试验药盒),检测值超过临界值(DOB值=4.0)2倍以上患者确认H. pylori感染。
兰索拉唑(天津武田药品有限公司,商品名:达克普隆)30 mg/次,2次/d;胶体果胶铋(华北制药)150 mg/次,3次/d;四环素(成都锦华制药有限公司)500 mg/次,3次/d;甲硝唑(山东华鲁制药有限公司)400 mg/次,3次/d;疗程14 d。嘱所有患者在服药期间避免烟酒及摄入海鲜、辛辣食物。所有患者均于治疗开始后7 d、14 d、治疗结束至少4周后随诊,详细记录其治疗期间发生的不良反应及症状情况。
治疗结束停药至少4周后(停药期间嘱患者避免服用抗生素及其他可能影响H. pylori检测的相关药物,以免影响呼气结果)进行13C-尿素呼气试验检查,检测结果阴性判断为H. pylori根除。
使用SPSS 16.0统计分析软件进行计算。对所有入组病例进行意向性(ITT)分析及及符合方案(PP)分析,计数数据采用均数或例(%)描述,分类数据采用χ2检验或校正χ2检验及Fisher′s精确概率法。所有统计检验均采用双侧检验,P<0.05为差异有统计学意义。
10例患者因严重不良反应停药,此10例患者均未复查呼气试验,按不良反应退出处理;5例患者完成治疗后未复查呼气检查(其中2例因治疗结束后妊娠,3例失访)按失访处理。110例患者完成了治疗后13C-尿素呼气试验的复查,其中104例患者根除成功,按PP和ITT分析H. pylori的根除率分别为94.5%(104/110)和86.7%(104/120)。
慢性胃炎患者总体根除率按PP和ITT分析分别为95.9% (85/89)和85.9% (85/99)。21例消化性溃疡(其中十二指肠溃疡13例,胃溃疡8例)患者总体根除率按PP和ITT分析均为90.5% (19/21),根除率与胃炎患者的差异无统计学意义(PP:χ2=0.14,P>0.05; ITT:χ2=0.04,P>0.05)。
56例(46.7%)患者出现了不同程度的不良反应(表1),多数患者症状较轻微,可以耐受;部分患者同时具有多个症状。其中男9例(占男性患者26.5%,9/34),女47例(占女性患者54.7%,47/86),不良反应发生与性别具有明显相关性(26.5%比54.7%,χ2=7.77,P<0.01);在73例有伴随疾病患者中,42例发生不良反应,47例无伴随疾病患者中,14例发生不良反应,不良反应的发生与有无伴随疾病具有明显相关性(57.5%比29.7%,χ2=8.84,P<0.01)。56例发生不良反应患者中,46例(82.1%)患者获得根除,与未发生不良反应患者根除率(90.6%,58/64)差异无统计学意义(χ2=1.86,P>0.05);10例患者因不良反应终止治疗(表2),均为女性,平均年龄56岁(范围39~65岁),导致患者终止治疗的主要症状为头晕头痛伴恶心呕吐、皮疹和乏力,其中4例患者完成了复查,3例患者根除成功。
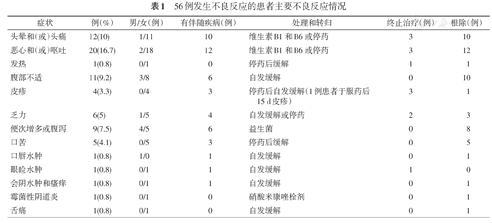
56例发生不良反应的患者主要不良反应情况
56例发生不良反应的患者主要不良反应情况
| 症状 | 例(%) | 男/女(例) | 有伴随疾病(例) | 处理和转归 | 终止治疗(例) | 根除(例) |
|---|---|---|---|---|---|---|
| 头晕和(或)头痛 | 12(10) | 1/11 | 10 | 维生素B1和B6或停药 | 3 | 10 |
| 恶心和(或)呕吐 | 20(16.7) | 2/18 | 12 | 维生素B1和B6或停药 | 3 | 12 |
| 发热 | 1(0.8) | 0/1 | 0 | 停药后缓解 | 1 | 1 |
| 腹部不适 | 11(9.2) | 3/8 | 6 | 自发缓解 | 0 | 10 |
| 皮疹 | 4(3.3) | 0/4 | 3 | 停药后自发缓解(1例患者于服药后15 d皮疹) | 3 | 1 |
| 乏力 | 6(5) | 1/5 | 4 | 自发缓解或停药 | 2 | 3 |
| 便次增多或腹泻 | 9(7.5) | 4/5 | 6 | 益生菌 | 0 | 8 |
| 口苦 | 5(4.1) | 0/5 | 3 | 停药后缓解 | 0 | 5 |
| 口唇水肿 | 1(0.8) | 1/0 | 1 | 自发缓解 | 0 | 1 |
| 眼睑水肿 | 1(0.8) | 0/1 | 1 | 自发缓解 | 1 | 0 |
| 会阴水肿和瘙痒 | 1(0.8) | 0/1 | 1 | 自发缓解 | 0 | 1 |
| 霉菌性阴道炎 | 1(0.8) | 0/1 | 0 | 硝酸米康唑栓剂 | 0 | 1 |
| 舌痛 | 1(0.8) | 0/1 | 0 | 自发缓解 | 0 | 1 |

10例终止治疗的患者情况
10例终止治疗的患者情况
| 编号 | 性别 | 年龄(岁) | 体质指数 | 不良反应症状 | 伴随疾病 | 服药天数(d) | 结局 |
|---|---|---|---|---|---|---|---|
| 1 | 女 | 64 | 22.9 | 服药1次后皮疹 | 高血压 | 1 | 未复查 |
| 2 | 女 | 47 | 26.0 | 头晕头痛,恶心呕吐 | 桥本病,高脂血症 | 2 | 未复查 |
| 3 | 女 | 47 | 26.0 | 头晕头痛,恶心呕吐 | 桥本病,高脂血症 | 3 | 未复查 |
| 4 | 女 | 62 | 22.6 | 眼睑浮肿,饥饿感 | 桥本病 | 3 | 未根除 |
| 5 | 女 | 39 | 24.9 | 皮疹 | 无 | 8 | 未复查 |
| 6 | 女 | 55 | 20.5 | 头晕头痛,服药5 d,停服5 d后再服3 d | 无 | 8 | 根除 |
| 7 | 女 | 63 | 20.7 | 皮疹 | 慢性荨麻诊,室性早搏 | 9 | 未复查 |
| 8 | 女 | 65 | 19.5 | 恶心,乏力 | 过敏性哮喘,过敏性鼻炎 | 10 | 未复查 |
| 9 | 女 | 64 | 27.4 | 乏力 | 高血压,冠心病,糖尿病 | 12 | 根除 |
| 10 | 女 | 57 | 18.3 | 发热 | 二尖瓣狭窄 | 13 | 根除 |
H. pylori对抗生素耐药问题日益严重,使得目前临床应用的根除治疗方案疗越来越低,对于抗生素敏感菌株的治疗方案根除率可达90%,而对于耐药菌株的根除率低于75%[3]。H. pylori对克拉霉素和(或)氟喹诺酮类药物的耐药率在中国很多地区已高达50%[9],这意味着在没有确认细菌对抗生素的敏感性的情况下,不建议将这些抗生素用于H. pylori治疗。H. pylori对甲硝唑的耐药率在中国也很高,但与克拉霉素和喹诺酮类抗生素不同,增加甲硝唑给药剂量、与铋剂联合应用及延长疗程,可以克服H. pylori对甲硝唑的低-中度耐药性,提高含甲硝唑方案的H. pylori根除疗效[4,10]。H. pylori对四环素、呋喃唑酮、阿莫西林的耐药率在中国一直处于较低水平,这使它们成为根除H. pylori治疗方案的理想药物[11,12]。
含四环素和甲硝唑铋剂四联疗法,在国际上被称为经典四联疗法,由于H. pylori对四环素耐药率低,在欧美一些国家和地区,经典四联疗法被推荐用于H. pylori根除的一线或补救治疗[3]。对于抗生素敏感菌株,常规治疗剂量和疗程的方案即可获得较理想的H. pylori根除率;对于耐药菌株,在方案中增加铋剂可以提高耐药菌株30%~40%的根除率[13]。有研究显示,7 d疗法的H. pylori根除率低于75%[14];延长疗程可以提高疗效,7 d以上的四联方案对抗生素耐药菌株可获得较好的疗效[15]。经典四联疗法由于其潜在的不良反应发生风险可能相对较高,既往在国际上主要推荐用于H. pylori感染的补救治疗,但由于H. pylori对克拉霉素和喹诺酮类抗生素耐药问题日益严重,使得经典四联疗法近年来越来越被重视,在西方,克拉霉素耐药率高的地区,该方案被推荐用于一线治疗H. pylori感染[3, 16],尤其被建议用于因青霉素过敏而不能应用含阿莫西林方案的患者[3,17]。
在我国,由于四环素的可获得性问题,经典四联疗法的普及率较低。曾有研究显示,PPI(标准剂量)+胶体次枸橼酸铋+四环素(1.5 g/d)和甲硝唑(1.2 g/d)7 d方案的H. pylori根除率ITT为79.1%,PP为82.9%,10 d方案的H. pylori根除率ITT为88.9%,PP为91.6%[12, 18]。但在山东临朐的流行病学研究中,较大剂量10 d方案疗效并不不理想:PPI(标准剂量)+枸橼酸铋钾(440 mg/d)+四环素(2.25 g/d)+甲硝唑(1.5 g/d),H. pylori根除率仅为ITT 76.7%和PP 83.3%[19]。在一项前瞻性研究中,疗程延长到14 d,增加了抗生素给药剂量,PPI(标准剂量)+枸橼酸铋(440 mg/d)+四环素(2.0 g/d)+甲硝唑(1.6 g/d),获得了较理想的根除率(PP 93.1%,ITT 87.9%)[20]。
青霉素过敏的患者一旦初次治疗失败,由于其可选择的治疗方案极为有限,其再次治疗的成功率将明显降低。对于青霉素过敏患者,理想的方案选择应当是根据细菌对抗生素的敏感性选择敏感抗生素治疗H. pylori感染。在实际临床中,治疗前行抗生素敏感性检测在国内外均难以普及,使得根据经验的首次治疗方案选择愈发重要。目前认为,H. pylori对克拉霉素和左氧氟沙星耐药率较高,对四环素耐药率低,增加甲硝唑剂量和联合铋剂可以克服H. pylori对甲硝唑的中低度耐药性[4],从理论及经验角度,含四环素和甲硝唑铋剂四联疗法的疗效应当优于含克拉霉素和(或)左氧氟沙星方案,且可能更适合用于青霉素过敏患者H. pylori根除的一线治疗。除疗效考量外,此方案的安全性是重点。延长疗程和增加甲硝唑剂量,常常导致药物不良反应发生风险增高,尤其对于存在药物过敏史患者。
本研究采用含四环素和甲硝唑铋剂四联疗法作为青霉素过敏患者H. pylori根除的一线治疗方案,治疗中选择了相对较低的抗生素剂量(四环素1.5 g/d,甲硝唑1.2g/d),疗程14 d,仍然获得较理想的根除率(PP 94.5%,ITT 86.7%)。本研究中四环素和甲硝唑的总用量虽低于国内以往研究使用的抗生素剂量[18],但疗效却不低于甚或高于既往相关研究中的根除率,这可能由于有药物过敏史患者,在日常生活中应用药物可能会更慎重、较少应用抗生素等原因,使得这些患者对抗生素的治疗更敏感。
尽管本研究中H. pylori根除率较高,患者的不良反应发生率(46.7%,56/120)也很高,其中10例(8.3%)患者因不良反应而终止了治疗。四环素的常见药物不良反应包括胃肠道症状(恶心、呕吐和上腹不适)、光敏反应、过敏、肝肾功能障碍、过敏性休克、哮喘、溶血性贫血。甲硝唑的常见不良反应是胃肠道反应(恶心、呕吐、食欲不振、腹泻、味觉改变、舌炎等),多数轻微不影响治疗。在既往研究中,PPI+铋剂+四环素+呋喃唑酮四联方案在被用于青霉素过敏患者的补救治疗时,虽然方案的根除率(ITT为91.7%,PP为95.2%)超过90%,但5.6%的患者出现了较严重的不良反应(药物热,0.1%患者出现发热)[21]。含四环素-甲硝唑四联方案与含四环素-呋喃唑酮四联方案相比,前者严重不良反应发生率低。
在我们的研究中,导致10例患者终止治疗的主要不良反应是皮疹(3例)、头晕/头痛/恶心/呕吐(3例)、乏力(2例)、发热(1例)。4例皮疹患者,1例皮疹轻微,发生在14 d治疗结束后,对治疗无影响,另3例分别在服药后1 d、2 d和8 d出现皮疹,这些皮疹考虑为药物过敏。2例患者出现严重头痛伴恶心、呕吐,分别发生在服药第2天、第4天。这些患者的不良反应症状在停药后均逐渐减轻和缓解。值得注意的是:不良反应发生率女性明显高于男性,有伴随疾病者明显高于无伴随疾病者;10例终止治疗的患者也均为女性,平均年龄56岁(范围39~65岁),其多同时伴有其他疾病(如桥本病、其他过敏性疾病);本研究中入选的女性患者例数也高于男性。
含四环素(1.5 g/d)和甲硝唑(1.2 g/d)四联疗法作为青霉素过敏患者H. pylori根除的一线治疗方案可以获得较高的根除率,虽然该方案具有一定的不良反应发生率,但对于青霉素过敏患者,该方案目前可能是一个较理想的经验性治疗方案,在治疗过程中,应注意密切监测患者的不良反应发生情况,尤其对于合并有其他基础疾病的女性患者。
所有作者均声明不存在利益冲突



























