1型糖尿病绝大多数是自身免疫性疾病,由遗传和环境因素共同作用导致胰岛β细胞功能进行性衰竭,而使患者需终生依赖外源性胰岛素治疗。大量研究已表明,规律性从事体育锻炼可减少1型糖尿病患者的每日胰岛素用量。因此患者需要明确如何安全地增加运动量,把更多自主性身体活动纳入到日常生活中,同时掌握运动禁忌证以规避运动风险。目前建议所有1型糖尿病患者坚持进行中高强度有氧运动,可持续性进行,或采用高强度间歇训练方式,同时可结合阻力器、弹力带等抗阻训练以及瑜伽、太极等拉伸平衡练习,运动时间至少150 min/周以上,运动频率可设置为3~7次/周,视患者身体状态与运动强度而定,但不宜连续2 d进行抗阻训练。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1型糖尿病绝大多数是自身免疫性疾病,某些外界因素(如病毒感染、化学毒物和饮食等)作用于有遗传易感性的个体,激活T淋巴细胞介导的一系列自身免疫反应,引起选择性胰岛β细胞破坏和功能衰竭,体内胰岛素分泌不足进行性加重,最终导致糖尿病。此外,胰岛素抵抗在1型糖尿病的发病和发展中也具有一定作用。目前,全球1型糖尿病患者的精确人数尚未可知,在美国1型糖尿病总体患病率约为0.3%[1]。尽管自1921年发现胰岛素后,近一个世纪以来其诊疗已经取得了长足进展,但目前中国1型糖尿病仍呈现血糖达标率低、急慢性并发症发病率高和寿命短的特点[2],对其有效管理仍颇具挑战。
目前有大量证据表明,规律地从事体育锻炼对所有年龄段1型糖尿病患者均具有健康效益,其中有氧运动及抗阻训练均能有效增强患者的血糖控制能力[3]。而且,抗阻训练已被证实可以有效地将1型糖尿病运动后低血糖风险降至最低[4]。综合文献资料提示,运动很可能是1型糖尿病行之有效的干预手段之一。基于此,本文拟对近年来采用运动疗法防治1型糖尿病的相关研究进行梳理,并归纳出有效运动处方,以期为1型糖尿病运动疗法的应用与推广提供有益参考。
美国糖尿病协会(American Diabetes Association, ADA)指出1型糖尿病的诊断标准是:(1)空腹血糖(FPG)≥7.0 mmol/L,或75 g口服葡萄糖耐量试验(OGTT)2 h血糖≥11.1 mmol/L,或有典型的高血糖或高血糖危象症状且随机血糖≥11.1 mmol/L,则可确诊为糖尿病;(2)通过检测胰岛自身抗体来确诊是否为1型糖尿病,胰岛自身抗体包括谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody, GADA)、蛋白酪氨酸磷酸酶抗体(protein tyrosine phosphatase antibody, IA2A或ICA512)、胰岛细胞抗体(islet cell antibody, ICA)、胰岛素自身抗体(insulin autoantibody, IAA)和锌转运蛋白(zinc transporter protein, ZnT8),都被视为1型糖尿病的标志特征[1]。对儿童1型糖尿病发生风险进行的研究发现,超过2种自身抗体阳性与10年内1型糖尿病发病率两者之间存在接近70%的正相关,15年内相关性则可达84%[5]。
综合文献研究结果表明,规律性的运动锻炼(每周至少运动150 min、3 d/周)[6]对于1型糖尿病患者生活方式的管理至关重要(表1)。此外,对于不同年龄段的患者,规律运动可助其实现如下几个目标:(1)对于幼儿患者,可有效降低其HbA1C水平(下降约0.3%),并且明显提高其罹患心血管疾病的风险预测能力[7];(2)对于青少年患者,能有效改善其身体成分、心肺功能、血管内皮功能和血脂指标(即三酰甘油和总胆固醇)等[7];(3)对于成年患者,可降低其每日胰岛素的总需求量[8]。在一项针对18 028例1型糖尿病成年患者的大规模横向研究中,3 212例积极活动的患者(每周运动2次及以上)与静坐少动者相比,具有更理想的HbA1C浓度、更健康的体重指数(BMI)值、以及更低的血脂异常、高血压与并发症(如视网膜病变和微量白蛋白尿)发病率[9]。研究还发现,积极活动者更不易诱发糖尿病酮症酸中毒,且发生严重低血糖伴昏迷的几率更低[9]。
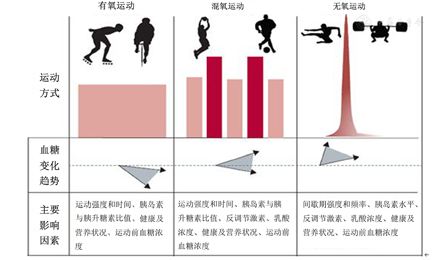
(1)运动过程中血糖异常:运动对1型糖尿病患者血糖的影响与胰岛素分泌、循环胰岛素水平、运动前血糖浓度、运动前饮食的构成以及运动强度和持续时间等因素有关[13](图1)。一方面,因为胰岛素水平在开始运动时不仅不会快速下调,而且在全身循环过程中还可能升高,所以大多数1型糖尿病患者在有氧运动中易发生低血糖[14]。另外,由于经常锻炼者的机体更适应有氧代谢,总体工作效率更高,在有氧运动期间其血糖降幅往往较无训练史患者更为显著[15]。因此,无论是经常锻炼抑或是无训练史的1型糖尿病患者,在开始有氧运动之前均应适当增加碳水化合物摄入量和(或)减少胰岛素剂量。另一方面,尽管抗阻训练可能引起部分患者的血糖在一定程度上升高[16],但其与连续中等强度有氧运动相比仍具有更好的血糖稳定性[4]。高强度间歇训练(high-intensity interval training, HIIT)与有氧运动相比亦是如此,通常情况下,在一次HIIT或短时间大负荷的无氧运动(如短跑、举重和其他一些竞技项目)期间,血糖浓度均表现为升高[16]。(2)运动后血糖异常:首先,有氧运动停止后,肌肉中的葡萄糖摄入会立即减少,但总体上葡萄糖代谢在运动后恢复期间仍将保持数小时高水平,从而有助于补充糖原储备。因此,在运动后24 h内低血糖的发生风险较高,特别是在下午运动后出现夜间低血糖的几率最大[17]。运动后低血糖多见于1型糖尿病青少年患者,基于此,患者及其家人、学校和老师应警惕运动后低血糖现象。其次,如上所述,举重、短跑等剧烈运动可促进血糖升高,并在运动后恢复期持续数小时。至于HIIT,有报道指出其与持续有氧运动相比具有更高的夜间低血糖发生风险,然而另外一些研究则并不认同[18]。有研究发现冲刺间歇训练(sprint interval training, SIT)可有效提高1型糖尿病患者骨骼肌氧化能力,并降低糖原分解率,从而可能防止运动后低血糖的发生,提示与此类似的HIIT方案可能较传统有氧运动更适用于1型糖尿病患者的日常训练[19]。还有报道指出,HIIT可增高血糖而持续中低强度运动则使血糖降低[20],而在有氧运动前进行抗阻训练不仅有助于维持运动过程中血糖稳定,还可减少运动后低血糖的持续时间和严重程度[21]。
从各种健康因素考虑,1型糖尿病患者都应从事适当运动锻炼。运动对机体糖稳态的作用受运动方式、强度和持续时间的影响。对于健康人群,在几乎所有形式的运动中,不管运动强度或持续时间如何,血糖浓度通常在4~6 mmol/L(70~110 mg/dl)范围内波动。对于所有患者,在运动前、运动中和运动后进行血糖监测是必不可少的,可有助于其采取相应策略以维持稳定、安全的血糖水平。
1型糖尿病患者在运动初始阶段应将个体的血糖浓度调整到适宜水平。基于目前的共识,大多数患者坚持1 h左右的有氧运动,其理想的血糖起始范围为7~10 mmol/L(126 ~180 mg/dl)。这一范围考虑了运动表现与低血糖发生风险之间的平衡性。在需要更多考虑预防低血糖的情况下,血糖值超出此范围或许也是可以接受的。然而,达到并将循环血糖浓度维持在这个范围内具有一定挑战性。运动应激下血糖反应是持续变化的,并且受到包括运动强度和持续时间、血糖初始水平、个体的有氧能力和循环胰岛素水平(图1)等若干因素的影响。由于血糖浓度趋于保持相对稳定,因而无氧运动以及一次性HIIT可在5~7 mmol/L(90~126 mg/dl)的初始血糖水平进行,但与持续有氧运动相比,其升高或下降幅度均较小(图1)。Riddell等[13]提供了一些运动前有效调节血糖浓度的策略,其中有一点需要切记的是:在进行30 min以上有氧运动时,可能需要额外补充碳水化合物。如果血糖水平因胰岛素缺乏而过高,可能会发生酮症以及继发的高血糖症。虽然目前尚不清楚与良好运动表现相对应的最佳血糖范围,但针对青少年患者研究的临床经验和数据显示,血糖值维持在约6~8 mmol/L(108~144 mg/dl)范围内可能最为理想[13]。
ADA最近指出:静坐少动且无明显症状的1型糖尿病患者计划从事中低强度(如健步走)体育活动之前,不必进行医学检查[22]。此前,ADA与美国运动医学会(American College of Sports Medicine, ACSM)则一致认为,1型糖尿病患者如果在坚持中低强度运动的基础上计划从事更高强度运动,或者个体已被评估为具有心血管疾病及其他不良并发症较高发生风险(例如血胆固醇升高、吸烟、有明显家族史等),其在开始运动锻炼之前务必采用有关的运动准备问卷调查表进行医学筛查,例如《体力活动准备医学检查量表》(ePARmed-X+)和《体力活动准备问卷》(PAR-Q+)[23]。
近年来,有氧运动(如步行、慢跑、骑自行车和游泳)和抗阻(力量)训练(借助阻力器、体重或弹力带等)均被广泛推荐给包括1型糖尿病在内的大多数糖尿病患者[4]。此外,HIIT亦被纳入糖尿病前期及1型、2型糖尿病患者可选择从事的运动锻炼方式[22]。有报道指出,1次10秒高强度冲刺可能有助于1型糖尿病患者预防运动后恢复早期低血糖现象。相比有氧运动,一次HIIT期间循环胰岛素水平均不会显著降低,在一定程度上这是由于运动持续时间通常较短所致。不仅如此,HIIT可为1型糖尿病运动员预防夜间低血糖症提供保护,并且还能有效增强1型糖尿病青年患者肌肉氧化代谢能力[24]。此外,身体拉伸练习(如静态性、动感性、瑜伽)和平衡训练(如单腿站立、平衡设备练习、太极)也适用于1型糖尿病患者[23]。虽然1型糖尿病患者建议首选的运动方式目前则仍不明确,但近期一些学者建议1型糖尿病患者应采取HIIT联合抗阻训练的方式进行锻炼,以预防较2型糖尿病患者更为显著的运动性低血糖症[25,26]。
ADA声明推荐任何年龄的1型糖尿病患者均可采用中高强度(50%~70% HRmax;50%~85%VO2max)进行有氧运动,以Borg量表12~17级的自我体力感觉为宜[22]。研究指出,大负荷运动可引起患者肾上腺素和胰升糖素等反调节激素更大程度的释放,使得血糖水平立即持续升高[27],而低强度运动容易导致血糖下降而诱发低血糖[14]。此外,抗阻训练以中等负荷(RM=15)至大负荷(RM=6-8)为宜,完成1~3组,每组练习8~10次以上,以接近疲劳为度[22]。
然而,对于长期患病或者HbA1C水平远高于临界值的个体,尤其是当1型糖尿病患者出现诸如不稳定的增殖性视网膜病变、严重的自主神经功能障碍或肾衰竭时,大负荷运动、负重练习以及对抗性耐力项目可能加重高血糖症,因而均为其运动禁忌证[13]。故糖尿病并发症患者可从低强度运动中获得可观的健康收益,同时几无任何不良事件的发生风险[13]。
ADA推荐儿童和青少年患者应每天坚持60 min左右的运动[4],建议成年患者(受缺乏时间、担心其安全性等因素影响)每周至少运动150 min,每周3~7 d(连续休息不超过2 d)。此外,每次以大约10 km/h配速运动达25 min的成人可适当缩减总时间,以75 min/周为宜[1,22]。然而,与2型糖尿病患者不同的是,较长运动时间如持续运动90~120 min对于儿童和青少年1型糖尿病患者尤其不利,其发生低血糖事件的几率将增加2倍以上[28]。
ADA建议1型糖尿病患者每周多次参与有氧和抗阻训练,其中儿童和青少年患者应每天坚持,将这些肌肉调节活动作为日常玩耍、游戏、娱乐、体育和家庭环境的一部分;成年患者进行有氧运动频率则至少应2 d 1次,以3~7 d/周为宜,2次练习最多间隔1 d,而抗阻训练以2~3 d/周为宜,避免连续2 d进行训练,以防止连续训练引发运动过程中及运动后血糖的异常波动[22]。目前,体力活动水平儿童问卷(PAQ-C)和国际体力活动问卷(IPAQ)是公认有效、在国际上较为广泛使用、且分别适用于儿童(8~14岁)和成人(15~69岁)的体力活动水平测量问卷,已用于中国糖尿病人群研究[29,30],故医务人员可根据临床需要选择合适的量表来评估患者的运动量,以期更好地进行管理。综上所述,归纳1型糖尿病与2型糖尿病运动疗法的差异见表2。

T1DM与T2DM之间的运动处方内容差异
T1DM与T2DM之间的运动处方内容差异
| T1DM | T2DM | 备注 | |
|---|---|---|---|
| 运动方式 | HIIT联合抗阻训练为最佳 | 有氧运动联合抗阻训练为最佳 | T1DM患者在有氧运动之中及之后24 h内易发生低血糖。 |
| 运动强度 | 中高强度(1)50%~85%VO2max或Borg记分12~17;(2)抗阻训练:RM=15至6~8。 | 中低强度(1)50%~60%VO2max或Borg记分9~14;(2)抗阻训练:RM=10~15。 | T1DM患者进行低强度运动易诱发低血糖。 |
| 运动时间 | 儿童青少年患者:60 min/d;成年患者:150 min/周,3~7 d/周。 | 30 min/d以上,肥胖及老年患者宜较低强度、较长时间的运动。 | 较长运动时间如持续运动90~120 min对于儿童青少年T1DM患者尤其不利,易发生低血糖。 |
| 运动频率 | 3~7 d/周。 | 不宜连续2 d进行抗阻训练。 |
注:T1DM:1型糖尿病;T2DM:2型糖尿病;HIIT:高强度间歇训练
(1)酮体生成增多:在运动开始之前,若血中酮体堆积(≥1.5 mmol/L)或尿酮体呈强阳性(≥4.0 mmol/L或2+)(即酮症),必要时应通过胰岛素给药和(或)补充碳水化合物来应对[13]。此外,还应明确酮体生成增多的原因,例如1次长时间的耐力性运动(如马拉松和徒步登山)以及碳水化合物摄入量极低等,均可导致患者血液中的酮体浓度升高,但不会呈现血糖升高现象。因此,医护人员应制定相应方案监测酮体变化,并采取恰当的措施应对血液或尿液酮体生成增多现象。若血中酮浓度为3.0 mmol/L甚至更高时,应立即由医护人员进行诊治[13]。(2)近期低血糖症:在过去24 h内出现严重低血糖症(血糖值≤2.8 mmol/L或发生过1次需要他人救助的低血糖事件)被视为运动禁忌证之一,因为在此情况下进行运动,患者发生更加严重低血糖症的几率将显著升高。此外,在轻度低血糖事件(血糖值为2.9~3.9 mmol/L,且有能力自救)发生后,必须考虑到复发风险也会有所增加[13]。因此,1型糖尿病患者应注意,如果近期身体状况较差,则在重视血糖监测的同时,一些运动项目诸如高山滑雪、攀岩、游泳或徒步旅行等都应避免参与。(3)对运动性低血糖做足准备:在运动前的准备阶段,高强度间歇训练患者应注意其初始血糖浓度,并配备血糖监测设备和零食以应对低血糖。此外,还应建议患者穿戴或携带某种形式的糖尿病相关鉴别装备。
规律运动不仅可以显著提高1型糖尿病患者的血糖控制能力,还能为其带来更多的健康收益。运动疗法是积极有效的1型糖尿病康复治疗方法之一。合理地运用运动处方,有针对性地安排运动方式,能够促进疾病治疗、提高康复医疗效果。然而在一部分人的观念中,1型糖尿病只能静养,不能运动,我们希望通过用运动处方的方式来改变一些人的观念,正确认识运动与1型糖尿病的关系。而且目前包括胰岛素泵、动态血糖监测仪在内的诸多技术设备均可用于协助1型糖尿病患者平衡胰岛素用量和饮食摄入量,在实现安全有效运动的同时获得最佳的血糖控制效果。因此,随着1型糖尿病日渐成为影响人体健康的普遍问题,以及人们对运动疗法重要性认识的逐步加深,对1型糖尿病运动疗法及其监测技术的研究必将是今后运动处方研究的热点之一。
所有作者均声明不存在利益冲突
1.确诊1型糖尿病的空腹血糖标准是( )。
A. ≥6.0 mmol/L B. ≥6.5 mmol/L C. ≥7.0 mmol/L D. ≥7.5 mmol/L
2.1型糖尿病患者在从事运动锻炼之前,血糖值维持在( )范围内最为理想。
A. 6~8 mmol/L B. 6~10 mmol/L C. 8~10 mmol/L D. 10~12 mmol/L
3.下列不属于1型糖尿病运动疗法的血糖管理技术为( )。
A.可穿戴追踪设备 B.动态血糖监测仪 C.胰岛素泵 D.血乳酸仪
4.相较于2型糖尿病,1型糖尿病患者在低强度运动中更易发生( )。
A.低血糖症 B.高血糖症 C.低血压症 D.高血压症
5.1型糖尿病患者从事( )运动后更易诱发低血糖。
A.有氧 B.无氧 C.混氧 D.高强度间歇训练