
胃癌术后标本的淋巴结检出数目不足,可降低淋巴结转移分期的准确性,从而影响预后评估和辅助治疗策略的制定。在规范完成D2淋巴结清扫的前提下,胃癌标本淋巴结检出数目主要依赖于检取方法。本中心从2013年开始成立专门的淋巴结挑检团队,当年本中心平均每例标本淋巴结检取数目为46枚,较之前明显增加(2004—2012年平均18枚/例)。2014年经过持续质量改进及定期进行质量控制,平均每例标本检取淋巴结数目达到62枚。因此,本文总结南方医院普通外科的胃癌标本淋巴结检取方法和经验。本中心的胃癌淋巴结检取团队的整体构建主要包括3个部分:即成立专门的淋巴结挑检团队、行之有效的标准操作流程(SOP)和长效持续的质量控制。专门的淋巴结挑检团队由不参与手术、但由经过手术医生专业培训的研究生组成。标准操作流程包括胃周解剖的理论储备、手术观摩以对应标本离体和在体状态、标准化的标本处理流程。长效持续的质量控制要求定期进行淋巴结挑检数据的上报和对流程持续的反馈优化。利用纳米碳和吲哚菁绿染料剂染色等进行术中淋巴结示踪导航和标本淋巴结强化,再按照传统方法进行检取,可提高淋巴结、尤其是微小淋巴结的检取率。随着"精准医学"概念的提出,淋巴结示踪方法研究的跨学科合作将会成为热点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中国进展期胃癌比例超过80%,约60%的患者初诊或手术切除时已经存在淋巴结转移,故胃癌根治性手术中需要完成胃周D2淋巴结清扫[1]。淋巴结转移情况是胃癌术后病理诊断的重要组成部分,是影响胃癌患者预后的独立危险因素[2,3]。多项研究显示,胃癌患者术后生存情况与淋巴结检出数目、淋巴结转移数目存在相关性[4,5]。美国SEER(Surveillance,Epidemiology,and End Results)数据库中胃癌患者临床资料的研究显示,送检的淋巴结每增加10枚,就能在一定程度上改善患者预后[6]。甚至对于术后淋巴结阴性患者,淋巴结检出数仍然是影响预后的独立因素[4,7]。第8版美国癌症联合委员会胃癌TMN分期进一步强调了淋巴结转移情况在胃癌分期中的重要性,将N3a和N3b亚组单独进行分期[8]。因此,准确的淋巴结分期,是判断患者预后及采取术后辅助治疗的重要参考指标[4,5,9,10]。
日本胃癌学会推荐,胃癌术后检查淋巴结数目不能少于16枚[11]。有学者报道,为了提高胃癌标本病理淋巴结分期的准确性,N0期应至少检取10~15枚淋巴结,N1~3期需检取≥20枚淋巴结;如果检取≥30枚淋巴结送检,术后淋巴结分期可能会更加准确[12]。送检的淋巴结越多,检出转移性淋巴结的可能性越大[13]。淋巴结分期准确性越可靠,就越能降低或避免淋巴结分期迁移的发生(也称Will-Roger现象)[9]。遗憾的是,2017年Sano等[14]研究显示,日本每例胃癌标本平均淋巴结检出数目达到39.4枚,韩国紧随其后为33.0枚,而我国纳入调查的几家大的中心数据仅为24.8枚,甚至落后于欧美国家的29.5枚。由此可见,我国胃癌标本淋巴结病理质量的提高有较强的急迫性。而影响淋巴结检出数目的主要因素是淋巴结清扫范围和标本淋巴结检取方法。在规范完成D2淋巴结清扫的前提下,淋巴结检出数目主要受检取方法的影响。故优化淋巴结检出方法,成为提高我国胃癌术后淋巴结病理质量的关键点。
南方医科大学南方医院普通外科从2013年起成立了专门的淋巴结挑检团队,使得当年本中心平均每例标本淋巴结检取数目提升为46枚,较专门团队成立前明显增加(2004—2012年平均18枚/例)。2014年,经过持续质量改进及定期进行质量控制,定期总结、回顾淋巴结检取数目及经验,平均每例标本检取淋巴结数目达到62枚,在北京大学肿瘤医院季加孚教授调查的2014年全国胃癌平均淋巴结清扫数报告中位居第一。因此,本文总结和分享南方医科大学南方医院普通外科胃癌术后标本淋巴结检取方法和经验,以供同道参考。
我们中心的胃癌淋巴结检取团队的整体构建主要包括3个部分,即成立专门的淋巴结挑检团队、行之有效的标准操作流程(standard operating procedures,SOP)和长效持续的质量控制。见图1。
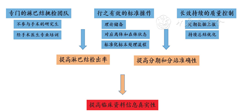

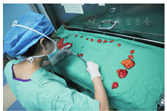
本中心2013年成立挑检淋巴结专业小组,由科室研究生组成。团队成员经过手术医生或资深医生1周左右的专业培训和考核后,单独进行全天候的胃癌标本淋巴结挑检。为了保证数据的客观性,规定参与手术的研究生不能进行该台手术标本淋巴结的检取。在手术室设置了专门的淋巴结分拣区,配备专门的操作桌子、器械和布巾,见图2。

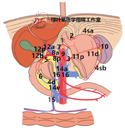
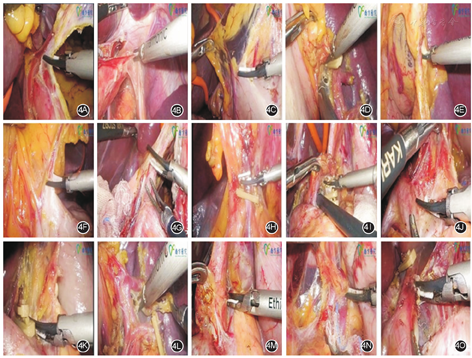
以下是本中心淋巴结挑检标准培训流程暨操作流程:(1)理论储备:成员先学习和熟悉胃周解剖,再由经验丰富的老师进行淋巴结分拣的理论授课讲解,让学员对胃的淋巴结分站和识别有系统和整体的认识,胃周淋巴结定位见图3。(2)识别和对应标本在体和离体状态:成员至手术室观摩和了解各种腹腔镜胃癌手术过程,观察手术医生如何分离各站淋巴结对应的组织、如何离段相应的血管,见图4,以便能够把离体标本和在体内时的状态对应起来,更加清晰地了解标本离体后各部分组织毗邻关系和血管夹等的来源。本中心在离断胃网膜左、胃网膜右、胃左、胃右动静脉等重要血管时,常规在标本侧予钛夹标记,从而能够更加精确地辨别各淋巴结分站。另外,在观看手术过程中,有时可看到手术医生单独分离和切除某些较为明显的肿大淋巴结,可提高学员对淋巴结形态和质感的鉴别能力。(3)离体标本淋巴结分拣:传统的胃癌离体标本的淋巴结检取方法,是直接在新鲜或甲醛固定的手术标本上取得淋巴结,该方法简单、低廉,易于推广,也是本中心目前最常用的检取淋巴结方法。为提高胃周淋巴结分站的准确性及检取数目,术者在离断胃周重要血管(胃网膜左、胃网膜右、胃左、胃右动静脉)时需要在标本侧予钛夹标记。标本离体后,利用解剖位置及钛夹定位胃周血管主干,然后按照第14版《日本胃癌处理公约》[15]依次将小弯侧与大弯侧的胃周组织进行分站处理。由于经过术者操作,离体标本跟实际胃周围组织的分布位置有误差,因此,各站别的归类也不是非常精准。


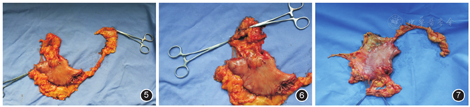
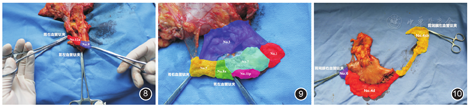
根据本中心术者的清扫习惯与处理标本的经验,以远端胃切除标本为例,总结分站方法供参考。具体如下:(1)标本袋贴标签、核对患者信息。(2)剪除大网膜后用清水简单清洗,再用毛巾擦拭。(3)将胃标本按体内原解剖位置摆放干净布单,测量大小弯长度并拍照,见图5。(4)淋巴结分站识别与分站,以远端胃为例:首先在小弯侧通过钛夹定位胃左动静脉、胃右动静脉,将它们向大弯侧牵拉,见图6和图7;结扎胃左动静脉钛夹的右上方至贲门右侧归为No.1,右下方归为No.11p,左上方钛夹附近组织归为No.9,左下方No.8a,结扎胃左动静脉钛夹与结扎胃右动静脉钛夹之间,稍微远离钛夹区域组织归为No.12a;结扎胃左动静脉钛夹至其第一个分支之间为No.7,结扎胃右动静脉钛夹至幽门上部分为No.5,靠近胃小弯侧的余下胃周组织归为No.3,见图8和图9;在胃大弯侧通过钛夹定位胃网膜左动静脉、胃网膜右动静脉。沿胃网膜左动静脉剪除组织归为No.4sb,沿胃网膜右动静脉剪除组织归为No.4d,幽门下区域组织归为No.6,见图10。由于胃大弯侧血管较明显,各站别比较容易区分,因此胃大弯侧淋巴结分站较小弯侧精准。如果是全胃切除的标本,在贲门小弯侧的胃周组织则归为No.1,在贲门大弯侧的胃周组织归为No.2,结扎胃网膜左动静脉钛夹上方的胃短血管周边组织归为No.4sa。全胃结构更完整,更容易识别,可通用远端胃方法。(5)各站淋巴结组织分离后的摆放与送检:按照固定的顺序摆放,再统一分袋送病理科检验,这样可以降低分拣过程中淋巴结站别错乱的概率。按大弯侧和小弯侧淋巴结两列分开摆放,每一列按站别数字大小顺序排列,见图11。检取之后仍然按该顺序摆放、分装并送检病理科。


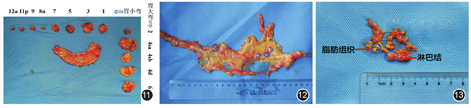

淋巴结检取技巧:(1)沿血管检取:淋巴结多沿血管分布,所以检取淋巴结时注意保护血管主干,沿血管检取。检取淋巴结过程中,辨别组织块内血管走形并细致剔除血管周围脂肪,可更好、更有层次感地暴露出沿血管走形排列的淋巴结,见图12。(2)逐层剥离软组织:对于脂肪厚度较大的组织,可用组织剪细致分离剪开脂肪,把组织逐渐打薄可减少体积较小的淋巴结的遗漏。(3)与脂肪颗粒鉴别:淋巴结最易与脂肪颗粒相混淆。颜色上鉴别,脂肪颗粒偏向橘黄色,部分淋巴结偏向白色,较透亮,部分淋巴结颜色与洗肉水样颜色相似,见图8;质地上鉴别,脂肪颗粒易压脆,淋巴结质地更韧、更硬,不易压碎,见图13。(4)视觉上无法分辨的组织碎片,可以通过食指揉压等方式作为第二道防线的"捡漏"。
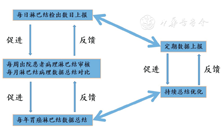
为了维持胃癌标本淋巴结检出的长期高质量,我们团队进行长效的质量控制、持续优化流程,见图14。由于团队管理模式一直根据实际情况和人员结构进行调整和优化,并没有具体的固定细节。目前,成员每人需要上报所检出胃癌标本的淋巴结数目,对于变异数值,进行原因分析:明确是由于标本本身原因,还是成员的技术问题、需要进行培训学习。而每周出院患者,手术医生会审核其最终病理结果,比较与成员上报的检出数目是否有较大的差异,也需要再次进行原因分析。每月、每年也会进行淋巴结数据的整理和总结。这种定期数据上报、持续总结优化的模式,使淋巴结检出质量不会因为人员的变更而出现大的质量下降。

目前,依靠术者视觉及触觉去检取胃癌术后标本的淋巴结仍是应用最广泛的方法,而纳米碳和吲哚菁绿染料剂等应用于胃癌淋巴结的示踪也具有巨大的应用前景[16,17]。利用染色进行术中淋巴结示踪导航和标本淋巴结强化显示,再按照传统方法进行检取,可提高淋巴结、尤其是微小淋巴结的检取率。随着"精准医学"概念的提出,淋巴结示踪方法的研究会成为一个热点。该领域的研究特别需要跨学科的合作,临床医生、病理科医生、基础医学研究者及化工材料研究者共同参与,期待能够开发出更加精准、有效的新型示踪剂,提高胃癌诊疗效果。
1.我国胃癌最常见的转移方式是什么?( )
A.血行转移;B.腹膜种植转移;C.淋巴结转移;
D.直接浸润
2.Sano教授2017年的研究显示,胃癌标本淋巴结检出数目中在下列哪个地区平均数最低?( )
A.中国;B.日本;C.韩国;D.欧美
3.根据北京大学肿瘤医院季加孚教授的报告,我国2014年各大中心的胃癌标本淋巴结检出数目最高的的中心达到多少枚每例?( )
A.62;B.44.5;C.39;D.31
4.日本胃癌学会推荐胃癌术后检查淋巴结数目至少不能少于多少枚?( )
A.10;B.15;C.16;D.30
5.哪一版的美国癌症联合委员会胃癌TMN分期中开始将N3a和N3b亚组单独进行分期?( )
A.第5版;B.第6版;C.第7版;D.第8版



























