
观察术中保温对胃肠道手术患者顺式阿曲库铵肌肉松弛恢复的影响。
选择中国医学科学院肿瘤医院2016年10月至2019年3月全麻下行开腹胃肠道手术患者60例,年龄20~60岁,美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级。随机数字表法分为两组:N组为常规术中不保温组,H组为术中保温组,每组30例。采用全身麻醉顺式阿曲库铵0.15 mg/kg诱导气管插管,术中持续监测并记录患者鼻咽温度。术中静脉输注顺式阿曲库铵1~3 μg·kg-1·min-1,维持4个成串刺激(TOF)引起的第一个肌颤触(T1)在1%~10%,手术结束前30 min停止输注。记录T1从25%恢复到75%的时间(肌肉松弛恢复指数),T1恢复至25%到TOF比值(TOFR,即TOF中第4个肌颤搐高度与T1的比值)恢复至90%的时间(完全恢复时间),药物累计用量,手术时间。
两组患者药物累计用量和手术时间差异均无统计学意义(均P>0.05);N组术毕体温为(35.7±0.2)℃,显著低于H组的(36.2±0.1)℃,差异有统计学意义(t=13.940,P<0.01);N组肌肉松弛恢复指数为(16.5±1.8)min,显著高于H组的(10.5±2.1)min,差异有统计学意义(t=12.094,P<0.01),N组完全恢复时间为(26.9±4.1)min,较H组的(15.0±2.9)min显著延长,差异有统计学意义(t=13.082,P<0.01)。
开腹胃肠道手术患者术中容易发生低体温,术中保温有助于顺式阿曲库铵的肌肉松弛作用的恢复。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
手术期间非人为的低体温是围手术期普遍存在的体温失衡现象,临床将体温低于36 ℃定义为低体温[1],术中低体温发生率为50%~70%[2]。体温对肌松药阻滞神经肌肉传导作用的影响是复杂的。本研究旨在评价术中保温对全麻患者顺式阿曲库铵肌松恢复的影响,评估体温监测和体温保护对肌松恢复的重要性。
选择中国医学科学院肿瘤医院2016年10月至2019年3月择期开腹行胃肠道手术的患者60例。年龄20~60岁,其中男34例,女26例,33例为胃癌手术,27例为结直肠癌手术。美国麻醉医师协会(ASA)分级Ⅰ或Ⅱ级;术前水电解质正常,无发热症状,无神经系统疾病;术前血红蛋白(Hb)>70 g/L,术中出血量<500 ml;术前、术中未使用影响肌松作用的药物。随机数字表法分为两组,N组为术中不保温组,H组为术中保温组,每组30例。H组采用WarmTouchTM充气式保温装置保温,用CAREDRAPETM下半身保温毯(规格151 cm×91 cm)覆盖耻骨联合以下两下肢区域,调节充气温度36~40 ℃;采用ASTOFLO PLUS血液和液体加温装置加热术中输血、输液,同时术中腹腔冲洗液加热至40 ℃。N组为非保温组,按传统不采取保温措施。
两组患者均无术前用药,采用静吸复合全身麻醉。全麻诱导用静脉注射咪达唑仑0.05 mg/kg、舒芬太尼0.5~1.0 μg/kg,丙泊酚2 mg/kg、顺式阿曲库铵0.15 mg/kg,待4个成串刺激(TOF)引起的第一个肌颤触(T1)最大抑制时气管插管,术中机械呼吸,调节呼吸参数维持呼气末二氧化碳分压(PETCO2)30~40 mmHg(1 mmHg=0.133 kPa);麻醉维持:吸入2.0%~2.5%的七氟醚,间断追加舒芬太尼,持续输注顺式阿曲库铵1~3 μg·kg-1·min-1,维持脑电双频指数(BIS)值在45~55。
患者意识消失后启动思路高肌松监测仪,当T1恢复至10%时开始微量泵持续静脉输注顺式阿曲库铵1~3 μg·kg-1·min-1,调节微量泵输注速度,维持1%<T1≤10%;手术结束前30 min停用顺式阿曲库铵,T1恢复至25%时给予新斯的明0.02 mg/kg和阿托品0.01 mg/kg拮抗肌松,记录停药时间和停药后T1恢复至25%、75%、90%的时间。记录T1从25%恢复到75%的时间(肌肉松弛恢复指数),T1恢复至25%到4个成串刺激(TOF)比值(TOFR,即TOF中第4个肌颤搐高度与T1的比值)恢复至90%的时间(完全恢复时间),药物累计用量,手术时间。
保持手术室温度在22 ℃左右。麻醉诱导后放置温度探头至鼻咽部,持续监测鼻咽温度作为机体核心温度。记录麻醉诱导时、T1恢复10%时、T1恢复至25%、TOFR恢复至90%各个时间点的鼻咽温度。
应用SPSS 13.0统计学软件处理。正态分布的计量资料以 ±s表示,计量资料比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
±s表示,计量资料比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
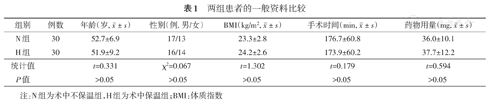
两组间年龄、体质指数、性别、肌肉松弛药累积用量和手术时间的差异均无统计学意义(均P>0.05)。见表1。
两组患者的一般资料比较
两组患者的一般资料比较
| 组别 | 例数 | 年龄(岁,  ± s) ± s) | 性别(例, 男/女) | BMI(kg/m2,  ± s) ± s) | 手术时间(min,  ± s) ± s) | 药物用量(mg,  ± s) ± s) |
|---|---|---|---|---|---|---|
| N组 | 30 | 52.7±6.9 | 17/13 | 23.3±2.8 | 176.7±60.8 | 36.0±10.1 |
| H组 | 30 | 51.9±9.2 | 16/14 | 24.2±2.6 | 173.9±60.2 | 37.7±12.2 |
| 统计值 | t=0.331 | χ2=0.067 | t=1.302 | t=0.179 | t=0.594 | |
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:N组为术中不保温组,H组为术中保温组;BMI:体质指数
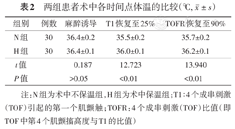
在麻醉诱导时,两组间体温的差异无统计学意义(P>0.05)。在T1恢复至25%及TOFR恢复至90%时,N组的体温显著低于H组(P<0.01)。见表2。
两组患者术中各时间点体温的比较(℃,  ±s)
±s)
两组患者术中各时间点体温的比较(℃,  ±s)
±s)
| 组别 | 例数 | 麻醉诱导 | T1恢复至25% | TOFR恢复至90% |
|---|---|---|---|---|
| N组 | 30 | 36.4±0.2 | 35.5±0.2 | 35.7±0.2 |
| H组 | 30 | 36.4±0.1 | 36.0±0.1 | 36.2±0.1 |
| t值 | 0.187 | 12.723 | 13.940 | |
| P值 | >0.05 | <0.01 | <0.01 |
注:N组为术中不保温组,H组为术中保温组;T1∶4个成串刺激(TOF)引起的第一个肌颤触;TOFR:4个成串刺激(TOF)比值(即TOF中第4个肌颤搐高度与T1的比值)
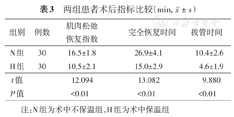
H组肌肉松弛恢复指数、完全恢复时间、拔管时间显著短于N组(P<0.01)。见表3。
两组患者术后指标比较(min,  ±s)
±s)
两组患者术后指标比较(min,  ±s)
±s)
| 组别 | 例数 | 肌肉松弛恢复指数 | 完全恢复时间 | 拔管时间 |
|---|---|---|---|---|
| N组 | 30 | 16.5±1.8 | 26.9±4.1 | 10.4±2.6 |
| H组 | 30 | 10.5±2.1 | 15.0±2.9 | 4.6±1.9 |
| t值 | 12.094 | 13.082 | 9.880 | |
| P值 | <0.01 | <0.01 | <0.01 |
注:N组为术中不保温组,H组为术中保温组
加速康复外科(ERAS)是指采用一系列有循证医学证据的围手术期优化措施,减轻机体的应激反应,促进患者术后加速康复,减少术后并发症以及降低再入院风险和死亡风险[3,4,5]。全身麻醉状态下,温度的变化会引起一系列生理代谢及器官功能的改变[6],术中低温是麻醉和外科手术期间常见的并发症,患者的外周血管扩张,机体散热增多,阿片类等全身麻醉药以剂量依赖型方式抑制机体的中枢和外周体温调节能力,使机体保持体温恒定的能力削弱,肌肉松弛药使肌肉无法产热,患者易随环境温度下降而发生低温现象。术前消毒时消毒液的蒸发使体温下降迅速,手术开始后体温以每小时0.5~1.0 ℃的速度下降。本研究结果显示两组患者术中体温在麻醉诱导时,差异无统计学意义。在T1恢复至25%及TOFR恢复至90%时,N组的体温显著低于H组,说明开腹手术后,中心体温与周围体温温度梯度较大,体温通过热传递的方式散失增快,输血、输液及体腔内冲洗时体温也明显下降,内脏大面积长时间暴露,更易使体温下降。
体温过低可造成严重的不良影响,如心功能的改变、知觉水平降低、机体免疫能力下降、凝血功能障碍等[7]。低体温状态下,肝脏、肾脏对药物的清除能力下降,药物的作用时间延长。Caldwell等[8]研究发现,轻度低温可影响肌松作用,给予0.1 mg/kg的维库溴铵,中心体温由37 ℃降至36 ℃,维库溴铵的作用时间延长15%;而中心体温由35 ℃降至34 ℃,作用时间延长22%。Cammu等[9]发现在低温心肺转流(CPB)过程中,CPB前、中、后罗库溴铵的输注速率分别是4.42、3.57和4.24 μg·kg-1·min-1,差异不明显。这表明不同温度对于不同肌松药影响的程度和机制是不同的。本研究两组患者顺式阿曲库铵的累计用量差异并无统计学意义,这可能与病例数偏少及影响因素较多有关。顺式阿曲库铵为阿曲库铵的同分异构体,在体内消除主要依赖于Hofmann降解,其代谢对温度的依赖性较其他肌松药强。有研究显示[10],术中低温会导致术后肌松残余的发生率增高。肌松残余作用是麻醉后呼吸功能损害的危险因素之一,在肌松消退过程中可能发生上呼吸道阻塞、全身无力、低氧血症、肺部并发症以及误吸等不良后果[11]。
麻醉后低体温会影响到药物的吸收、分布、代谢、生物转化和排泄,从而影响药物的药理学特征[12,13]。本研究结果显示,H组患者肌肉松弛恢复指数、完全恢复时间显著短于N组患者,说明体温可影响神经肌肉接头处神经递质的释放,改变突触后膜对乙酰胆碱的敏感性,当给予肌松药时这种作用得到进一步强化,从而影响肌松药的肌松效应。但也有研究表明[14],神经肌肉接头对非去极化肌松药的敏感性未发生变化。细胞外调节蛋白激酶(ERK)作为重要的丝氨酸/苏氨酸蛋白激酶,其在学习和记忆中具有非常重要的作用,国外有文献报道低体温可抑制大鼠海马组织中ERK的表达[15,16,17],低体温对机体的其他影响还有待进一步研究。
所有作者均声明不存在利益冲突



























