胃神经内分泌肿瘤(g-NEN)有4个临床亚型。1型和2型g-NEN都是低级别胃泌素依赖性肠嗜铬样细胞肿瘤。1型g-NEN发生于自身免疫性萎缩性胃炎基础上,2型发生于佐林格-埃利森综合征和(或)多发性内分泌肿瘤1型相关性胃泌素瘤患者,3型为非胃泌素依赖性散发性神经内分泌瘤,4型为神经内分泌癌或混合性腺-神经内分泌癌。4个亚型因病因病理不同而各具临床特征。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃神经内分泌肿瘤(gastric neuroendocrine neoplasm,g-NEN)是一组高度异质性肿瘤,根据发病机制和临床特征分为4型,各型的治疗策略和预后不同。临床医师如能从病理学角度了解g-NEN的病因、发病机制和病理变化,将更加深刻理解g-NEN的疾病本质和发生发展规律,为g-NEN的诊治提供理论基础,达到知其然知其所以然的深度。
g-NEN命名和分类标准与全消化道和胰腺部位神经内分泌肿瘤(neuroendocrine neoplasm,NEN)标准一致。2010年,WHO根据Ki-67指数和核分裂象将胃肠胰NEN分为G1、G2和G3级,其中G1和G2级肿瘤称为神经内分泌瘤(neuroendocrine tumor,NET),G3级肿瘤称为神经内分泌癌(neuroendocrine carcinoma,NEC)。NEC组织中常混有腺癌成分,当两者比例均>30%,则称为混合性腺-神经内分泌癌(mixed adeno neuroendocrine carcinoma,MANEC)[1]。2013年,中国胃肠胰NEN病理诊断共识在WHO分类基础上提出了"高增殖活性NET"的概念,将部分形态分化良好、不符合低分化NEC且Ki-67指数>20%但<60%的NEN命名为"高增殖活性NET(NET G3级)",以区别于分化差的NEC[2]。2019年,新版WHO对2010版NEN的分类和分级进行了更新[3]。将NEN分为高分化的NET和低分化的NEC两大类;NET包括NET G1、G2和G3级,其中G1和G2级的定义与WHO 2010版一致,而NET G3级则指Ki-67指数>20%,但仍保留高分化形态学特点的NEN。NEC包括大细胞和小细胞NEC,不再属于G3级范畴。另将MANEC更名扩大为混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasm,MiNEN),要求各自占比>30%(表1)。

2019年第5版世界卫生组织胃肠/肝胆胰神经内分泌肿瘤分类和分级标准
2019年第5版世界卫生组织胃肠/肝胆胰神经内分泌肿瘤分类和分级标准
| 命名 | 分化程度 | 分级 | 核分裂象数c(/2 mm2) | Ki-67指数c(%) |
|---|---|---|---|---|
| 神经内分泌瘤,G1级 | 高分化 | 低 | <2 | <3 |
| 神经内分泌瘤,G2级 | 高分化 | 中 | 2~20 | 3~20 |
| 神经内分泌瘤,G3级 | 高分化 | 高 | >20 | >20 |
| 小细胞神经内分泌癌 | 低分化 | 高 | >20 | >20 |
| 大细胞神经内分泌癌 | 低分化a | 高 | >20 | >20 |
| 混合性神经内分泌-非神经内分泌肿瘤 | 高或低分化b | 多样b | 多样b | 多样b |
注:a低分化神经内分泌癌并无正式分级,但根据其定义,一般考虑为高分级。b在大部分混合性神经内分泌-非神经内分泌肿瘤中,神经内分泌肿瘤和非神经内分泌肿瘤成分均为低分化,并且神经内分泌肿瘤成分的增殖指数与其他神经内分泌癌一致。但这一概念分类允许这两种成分均可能是高分化,并且这两种成分在适用的情况下均应分别进行分级。c核分裂象数表示为核分裂象计数/2 mm2(该面积为40倍放大倍数和每个视野直径0.5 mm情况下的10个高倍镜视野),计数50个0.2 mm2的视野;Ki-67指数通过计数高染色区域(即热点区)至少500个细胞获得;最终分级采用两种增殖指数所对应的分级中较高的分级
2016版中国胃肠胰NEN专家共识依据g-NEN的发病机制、临床特征、治疗策略和预后将g-NEN分为4型[4],见表2。

胃神经内分泌肿瘤的临床分型
胃神经内分泌肿瘤的临床分型
| 分型 | 占比(%) | 肿瘤特征 | 相关疾病 | 胃内pH值 | 血清胃泌素 | 病理分级 | 转移率(%) | 病死率(%) |
|---|---|---|---|---|---|---|---|---|
| 1型 | 70~80 | 小(<1~2 cm),多发,息肉样 | 自身免疫性萎缩性胃炎 | 明显升高(胃酸缺乏) | 升高 | G1、G1 | 2~5 | 0 |
| 2型 | 5~6 | 小(<1~2 cm),多发,息肉样 | 胃泌素瘤(佐林格-埃利森综合征和多发性内分泌肿瘤1型) | 明显降低(胃酸过多) | 升高 | G1、G2 | 10~30 | <10 |
| 3型 | 14~25 | 单发,病灶常较大(>2 cm),息肉样或溃疡 | 无 | 正常 | 正常 | G1、G2、G3 | 50~80 | 25~30 |
| 4型 | 6~8 | 单发,病灶常较大(>2 cm),息肉样或溃疡 | 无 | 正常 | 大部分正常 | 神经内分泌癌、混合性腺-神经内分泌癌 | 80~100 | >50 |
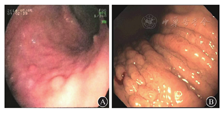
1型和2型g-NEN都是分化好的胃泌素依赖型肠嗜铬样细胞(enterochromaffin-like cell,ECL细胞)增生性肿瘤,常是多发性小息肉样病变,均局限于胃底和胃体,两者重要鉴别点是引起胃泌素水平升高的基础病因不同。1型g-NEN是由于自身免疫性萎缩性胃炎引起胃酸减少,刺激胃泌素G细胞增生导致继发性胃泌素水平升高;2型g-NEN是由于功能性胃泌素瘤[佐林格-埃利森综合征(Zollinger-Ellison syndrome,ZES)和多发性内分泌肿瘤1型(multiple endocrine neoplasia type 1,MEN1)相关性胃泌素瘤]引起原发性高胃泌素血症。由于两者基础病因不同,故胃镜下背景胃黏膜的改变也不同。1型g-NEN的胃黏膜背景呈萎缩性胃炎改变,而2型g-NEN的胃黏膜背景呈肥厚性胃炎改变,需要强调的是这些改变仅局限于胃底和胃体的泌酸黏膜,而胃窦黏膜是相对正常的,这一胃镜下特点有别于H.pylori感染所致的以胃窦为中心向近端和远端扩散的慢性萎缩性胃炎。因而有经验的临床医师在胃镜下观察到局限于胃底和胃体多发性小息肉样病变时,根据泌酸黏膜背景是萎缩亦或是肥厚改变的不同可以初步区分1型与2型g-NEN(图1)。

3型和4型g-NEN都是非胃泌素依赖性散发性肿瘤,与慢性萎缩性胃炎和高胃泌素血症无关,无萎缩或肥厚性胃炎背景,病变常单发,且体积较大(最大径>2 cm),呈息肉样肿块或伴溃疡,两者的鉴别主要根据病理诊断。3型g-NEN是分化良好的NET,分级可以是G1、G2或G3级;而4型g-NEN则是分化差的NEC或MANEC。
高胃泌素血症为什么会导致1型和2型g-NEN发生?两型的病理改变会有什么不同?
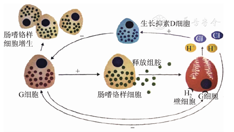
胃黏膜至少有8种不同类型的神经内分泌细胞,参与胃酸分泌调节机制的细胞主要有3种,分别是分泌组胺的ECL细胞,分泌胃泌素的G细胞和分泌生长抑素的D细胞。D细胞分布于全胃黏膜,以旁分泌方式通过生长抑素受体调控其他神经内分泌细胞,是G细胞的拮抗细胞。ECL细胞仅位于胃底和胃体泌酸黏膜腺体的下1/3,而G细胞则分布于胃窦腺颈部。G细胞分泌胃泌素与ECL细胞上的胃泌素受体结合,刺激ECL细胞释放组胺,组胺再与壁细胞上的组胺受体结合,导致胃酸分泌。胃酸水平的高低既可以通过负反馈作用于G细胞来调节胃泌素的分泌,也可以通过正反馈作用于D细胞来抑制G细胞分泌胃泌素。此外,G细胞分泌的胃泌素还有另外一个重要功能,就是对ECL有很强的营养作用,胃泌素水平升高会继发ECL细胞数量增加[5](图2)。
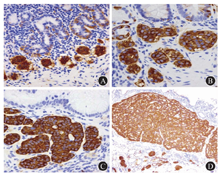
自身免疫性萎缩性胃炎患者由于有壁细胞抗体和抗内因子自身抗体,导致胃底和胃体泌酸黏膜被破坏,壁细胞和主细胞丢失,从而导致胃黏膜萎缩,胃酸减少。胃酸减少反馈刺激胃窦G细胞增生分泌胃泌素,由于壁细胞被破坏,正常的胃酸循环被打断,持续性低胃酸不断刺激G细胞分泌胃泌素,导致继发性高胃泌素血症。这是一个漫长的过程,壁细胞的破坏并非一蹴而就。胃底和胃体ECL细胞在高胃泌素营养环境下出现系列增生改变,从线性增生、微小结节状增生、腺瘤性增生一直进展到异型增生阶段,当异型增生的ECL细胞团巢直径>0.5 mm或浸润到黏膜下层时则诊断为NET[1,6] (图3),这就是1型g-NEN的发病机制。1型g-NEN是胃泌素依赖性ECL细胞增生性肿瘤,所以只发生在有ECL细胞的胃底和胃体部。正常ECL细胞位于黏膜层的下1/3,所以ECL细胞肿瘤常位于黏膜深层并易浸润至黏膜下,临床医师在胃镜下会误以为它是发生于黏膜下的肿瘤(图4)。肿瘤病灶周围除了萎缩性胃炎常有的肠化生和幽门腺化生背景以外,尚可见ECL细胞系列增生现象(因为胃底和胃体ECL细胞表面均有胃泌素受体,均受高胃泌素血滋养),这一特点明显有别于非胃泌素依赖性3型和4型g-NEN(图5)。1型g-NEN肿瘤生长缓慢,绝大多数是NET G1, 预后很好,但常复发,罕见死于肿瘤相关性病变。1型g-NEN多为散发性,尚未发现其特征性致病基因。2015年,西班牙学者发现了一个1型胃神经内分泌瘤(gastric neuroendocrine tumor,g-NET)家系,包括父母和10个子女中的5个均患有1型g-NET,此研究提示ATP4A基因是家族遗传性1型g-NET的致病基因[7]。

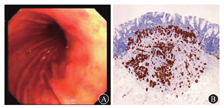

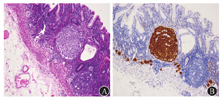

2型g-NEN常发生于ZES、MEN1相关的胃泌素瘤患者。胃泌素瘤最常好发于十二指肠和胰腺,肿瘤所致的高胃泌素血症一是刺激胃底和胃体壁细胞弥漫增生、肥厚,产生大量胃酸,从而导致ZES;二是营养胃底和胃体ECL细胞,导致ECL细胞增生。胃泌素瘤引起的ECL细胞增生与自身免疫性萎缩性胃炎引起的ECL细胞增生在程度上有所不同,前者常仅限于线性增生。这是因为胃泌素瘤患者的壁细胞未遭到破坏,胃酸循环通路正常,壁细胞通过代偿增生来适应增多的胃泌素,所以出现胃底和胃体肥厚性胃炎而胃窦正常的胃镜下特点。文献报道,在合并有MEN1综合征的胃泌素瘤患者中有53%的ECL细胞增生会进展到异型增生阶段,有23%形成2型g-NEN[5]。75%的2型g-NEN患者显示有MEN1位点的杂合性缺失(loss of heterozygosity,LOH)[8]。MEN1基因位点的LOH似乎是高胃泌素血症诱导ECL细胞从适应性增生向肿瘤性增生转化的一个重要前提条件。也有学者认为胃泌素水平持续升高才是导致2型g-NEN的关键,否则无法解释有25%无MEN1 LOH改变的2型g-NEN,也无法解释为什么只有ECL细胞增生而其他类型的神经内分泌细胞没有增生[9]。由此可见,MEN1基因的LOH改变尚不能解释2型g-NEN的全貌,还需大样本研究。
3型g-NEN为散发性非胃泌素依赖性肿瘤,因而没有ECL细胞系列增生背景。肿瘤可以来源于ECL细胞,也可以来源于胃内其他神经内分泌细胞(如D细胞、EC细胞、G细胞、饥饿素细胞等),多为NET G2或G3,也可以是NET G1,预后和临床治疗决策随病理分级和临床分期不同而异。3型g-NEN遗传易感性资料甚少。
4型g-NEN是一类散发性的起源于非ECL细胞的分化差的高级别NEC,有小细胞和大细胞NEC两种亚型,以及MANEC。无论是病理形态,还是基因改变,以及临床表现,4型g-NEN完全不同于上述3种类型g-NEN。p53和RB1基因异常是NEC的分子特征。>70%的4型g-NEN或多或少合并有腺癌成分,提示胃NEC与胃腺癌可能起源于同一内分泌前体细胞[10],预后最差。
1型和2型g-NEN都是胃泌素依赖性ECL肿瘤,其肿瘤形态是一样的,都是低级别的NEN,故仅从肿瘤细胞形态上无法区分二者。但病理医师可以从胃炎背景、胃底和胃体非肿瘤区ECL细胞是否增生,以及胃窦G细胞是否增生等特点为临床分型提供病理依据。因此,当临床医师在胃镜下看到胃底和胃体多发性息肉样病变而胃窦黏膜相对正常时,应将g-NEN作为第一鉴别诊断,并可通过观察病变背景是萎缩性还是肥厚性胃炎对g-NEN分型作出初判。中国病理共识提醒临床医师在怀疑NEN时一定要进行多部位活组织检查(以下简称活检),不仅要多取肿瘤性病变区组织,还要在相对正常的胃底、胃体和胃窦各取2块组织。同时,还要注意深部活检,因为增生的ECL细胞位于黏膜深层,取材表浅常会漏诊。临床提供一个完美的活检标本是病理正确诊断的前提。临床胃镜下小息肉活检流程见图6。
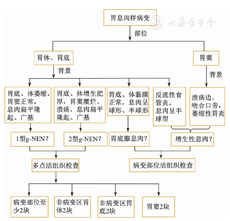

注:g-NEN为胃神经内分泌肿瘤
中国病理共识要求胃肠胰NEN的标准病理报告应该包含11项内容[2]:①标本类型,活检小标本或手术标本;②肿瘤部位;③肿瘤大小和数量;④肿瘤浸润深度;⑤血管、淋巴管和神经累及情况;⑥核分裂象和Ki-67指数;⑦神经内分泌标志物如嗜铬粒蛋白A、突触素和CD56;⑧切缘情况;⑨淋巴结转移情况;⑩其他有关改变(如胃黏膜背景和神经内分泌细胞增生情况);⑪病理诊断(2013年中国病理共识或WHO标准),部位+NET(G1、G2或G3)、NEC或MANEC。临床医师拿到病理确诊g-NEN的病理报告,可以参照上述项目检查病理报告是否完整。尤其是神经内分泌标志物嗜铬粒蛋白A、突触素、CD56免疫组织化学染色结果是诊断NEN所必做的检查项目,还有Ki-67指数和核分裂象数也是肿瘤分级所必需的指标,两者缺一不可。如果一份诊断了g-NEN的病理报告中没有这2个必检项目,临床医师就可以质疑这份病理诊断报告的正确性。另外病理报告尚需提供背景胃黏膜的改变情况,为临床分型提供病理依据。
总之,遇到胃镜下息肉样病变时,临床医师需要关注g-NEN这一种肿瘤,通过了解g-NEN相关发病机制和病理特点,学会胃镜下分辨1型和2型g-NEN,及时且准确地作出第一判断,做到规范化取材。将临床与病理紧密联系,才是正确诊断和精准治疗g-NEN的保证。
所有作者均声明不存在利益冲突