
探讨经右心导管检查(RHC)确诊的原发性干燥综合征相关肺动脉高压(pSS-PAH)患者的临床特征。
回顾性分析2013年1月至2019年6月就诊于天津医科大学总医院风湿免疫科或心血管内科,符合2002年修订版原发性干燥综合征(pSS)的国际诊断标准并经RHC确诊的20例pSS-PAH患者的临床资料,描述其一般情况、血流动力学、治疗方案及随访情况等,并探索治疗达标预测因素,同时对抗SSB抗体阳性及阴性患者进行亚组比较。
20例患者均为女性,确诊肺动脉高压(PAH)(基线)中位年龄为54.5(岁),PAH中位病程为12个月,活动后气短为pSS-PAH患者最常见的临床表现(17例,占85%),其中5例(26.3%)以PAH症状为首发表现,右心导管测得平均肺动脉压力(mPAP)(mmHg)、肺血管阻力(PVR)(IU)及心指数(L·min-1·m-2)分别为48(38,55.75)、11.23(6.17,14.69)及2.59(2.04,2.98)。右心室内径≤40 mm[P=0.009,HR=5.92,95%CI(1.55,22.59)]为pSS-PAH患者的达标预后因素。此外,亚组分析显示,抗干燥综合征B(SSB)抗体阳性患者较阴性患者PVR(IU)[14.1(11.23,22.63)比6.4(6.15,12.36),P=0.025]及mPAP(mmHg)[55(48.5,59)比39 (32.5,50.75),P=0.013]更高,同时心指数(L·min-1·m-2)更低[2.1(1.6,2.5)比2.9(2.56,3.41),P=0.002]。
pSS-PAH患者以中年女性为主,主要表现为活动后气短,以PAH为首发症状就诊者并不少见,对于抗SSB抗体阳性及基线时右心室径线增大的pSS-PAH患者更需注意其血流动力学、心功能情况及预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性干燥综合征(pSS)是一种常见的主要累及外分泌腺的自身免疫性疾病,同时系统受累也不少见[1],主要包括血液系统、关节及肺部累及[2]。肺动脉高压(PAH)是一组以肺小血管增生和重塑为特征的疾病,导致肺血管阻力逐渐增加,终致右心衰竭和死亡[3]。PAH作为pSS一种严重的并发症,可能并不少见,在中国人群中经超声心动图确诊的原发性干燥综合征相关肺动脉高压(pSS-PAH)患病率高达12.5%[2],同时pSS-PAH患者预后不良[4]。然而,鲜有研究报道通过金标准——右心导管检查(RHC)来诊断PAH。本研究旨在描述并分析经右心导管检查确诊的pSS-PAH患者的基线及随访资料,以提高风湿科医师对本病的认识。
回顾性收集于2013年1月至2019年6月就诊于天津医科大学总医院风湿免疫科或心血管内科,并经RHC明确诊断为pSS-PAH患者20例的临床资料。所有患者均符合2002年修订版的pSS国际诊断标准[1]。PAH的诊断[3]符合静息时经RHC测得平均肺动脉压力(mPAP)≥ 25 mmHg (1 mmHg=0.133 kPa),PAWP ≤ 15 mmHg及肺血管阻力(PVR)>3 IU。并排除符合以下标准的患者:(1)符合其他结缔组织疾病(CTD)诊断;(2)明确心脏结构病变足以解释PAH;(3)严重肺部疾病:HRC提示存在重度肺间质纤维化;或肺功能检查中用力肺活量占预计值百分比(FVC% pre)<70%预计值和(或)一氧化碳弥散量占预计值百分比(DLCO% pre)<40%;(4)存在肺血栓栓塞证据;(5)其他已知的、非干燥综合征相关的PAH。
收集所有患者的临床症状、实验室检查、基线治疗方案及超声心动图、右心导管检查等血流动力学资料,定义确诊PAH时的资料为基线资料,同时评估患者脏器受累情况,并计算疾病活动评分,干燥综合征(SS)疾病损伤指数(SSDDI)和欧洲抗风湿病联盟干燥综合征疾病活动度评分(ESSDAI)。诊断PAH时基线病程≤6个月定义为早期诊断[5]。血液系统受累定义为自身免疫性血细胞减少中性粒细胞减少症(中性粒细胞<1.5×109/L),和(或)贫血(血红蛋白<120 g/L),和(或)血小板减少症(血小板<100×109/L),和(或)淋巴细胞减少症(淋巴细胞<1×109/L)。肾脏受累定义为肾小管酸中毒伴或不伴肾功能不全(肾小球滤过率≥60 ml·min-1·(1.73 m2)-1,和(或)24 h尿蛋白>0.5 g,和(或)肾功能不全(肾小球滤过率<60 ml·min-1·(1.73 m2)-1。肝脏受累定义为存在血清肝功能测试结果(转氨酶、碱性磷酸酶、γ-谷氨酰转移酶和胆红素)和或影像学检查中胆管改变的证据(超声、CT或磁共振成像)。
收集患者随访资料,随访截至2019年6月,主要随访终点为全因死亡,同时记录患者死亡原因。此外,本研究定义次要随访终点为PAH治疗达标,达标定义采用第五届世界肺高血压大会所提出的定义,即达到:(1):世界卫生组织(WHO)心功能分级(WHO FC)稳定于Ⅰ或Ⅱ级;(2)经胸超声心动图或心脏核磁提示右心径线及功能正常或接近正常;(3)6 min步行试验>380~440 m;(4)B型钠尿肽(BNP)水平正常。复查RHC及心肺运动试验因不是常规检查未纳入。
采用SPSS 19.0统计软件。计量资料用中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Wilcoxon秩和检验。计数资料用例数和百分率(%)表示,组间比较采用Fisher精确概率检验。通过单因素COX回归分析寻找达标预测指标;结合Kaplan-Meier曲线绘制不同预后因素下的累积达标曲线,并进行Log-rank检验;以P<0.05为差异有统计学意义。
20例患者均为女性,pSS中位发病年龄为51(岁),确诊PAH时pSS中位病程为3(年),确诊PAH(基线)中位年龄为54.5(岁),PAH首发症状至确诊的中位病程为12个月,20例中5例以PAH症状为首发表现,PAH早期诊断率为25%。
20例患者常见SS相关临床症状依次为口眼干、关节痛、雷诺现象及猖獗齿,其中5例合并轻度肺间质病变(ILD)。所有患者抗核抗体、抗干燥综合征A(SSA)抗体均阳性,9例(45%)患者抗干燥综合征B(SSB)抗体阳性,2例(10%)抗U1核糖核蛋白抗体(抗U1RNP抗体)阳性。所有患者抗Smith抗体、抗双链DNA抗体、自身免疫性肝病相关抗体均阴性。
20例患者脏器受累及疾病评价情况为:合并血液系统、肾脏、肝脏受累及甲状腺功能低下者分别为6例(30%)、5例(25%)、10例(50%)及6例(30%),SSDDI及ESSDAI分别为2(0,3)和5(4,17)。SSDDI分值主要来源于口腔/涎腺损伤及肾损伤,此外1例合并非霍奇金淋巴瘤。ESSDAI分值主要来自血液系统受累和血清学变化[高球蛋白血症和(或)IgG>16 g/L和(或)低补体血症]。
活动后气短(17例,85%)为pSS-PAH患者最常见的临床表现,9例(45%)患者基线时WHO FC Ⅲ/Ⅳ,超声心动图提示心包积液者6例(30%),左心房前后径(mm)及左心室舒末径(mm)分别为31(30,36)和42(39,45),右心房左右径(mm)及右心室左右径(mm)分别为43(38,54)和40(36,45)。所有患者右心导管测得mPAP(mmHg)、mRAP(mmHg)、PVR(IU)及心指数(L·min-1·m-2)分别为48(38,55.75)、6 (4.25,7)、11.23(6.17,14.69)及2.59(2.04,2.98)。其中4例(20%)急性肺血管扩张试验(AVT)阳性。所有患者肺功能提示,FVC% pred为89.25(80.13,93.7),DLCO% pred为64.35(52.1,88.63)。
基线时17例患者接受PAH靶向治疗,其中主要为波生坦、他答拉非,4例患者初始即使用他答拉非联合波生坦治疗。13例接受激素治疗,其中小剂量者(等效于泼尼松≤0.5 mg·kg-1·d-1)6例,中等剂量者(等效于泼尼松0.5~1 mg·kg-1·d-1)5例,大剂量者(等效于泼尼松≥1 mg·kg-1·d-1)2例。13例患者接受免疫抑制剂治疗,主要为联合应用环磷酰胺及羟氯喹(6例,30%)、单药应用羟氯喹(5例,25%)。
随访至2019年6月,无患者失访及死亡,20例患者中位随访时间为43.6个月(6~78个月)。20例中12例(60%)PAH治疗达标,其中5例在诊断1年之内即达标,中位达标时间为19个月。对本pSS-PAH研究队列进行达标预测因素的单因素COX分析发现,右心室内径≤40 mm[P=0.009,HR=5.92,95%CI(1.55,22.59)]为pSS-PAH患者的达标预测因素(图1)。
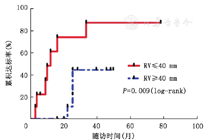

抗SSB抗体阳性与抗SSB抗体阴性患者的亚组分析:将患者按照抗SSB抗体是否阳性分为亚组后分析表明,抗-La/SSB抗体阳性患者较阴性患者PVR(IU)[14.1(11.23,22.63)比6.4(6.15,12.36),P=0.025]及mPAP(mmHg)[55(48.5,59)比39(32.5,50.75),P=0.013]更高,同时心指数(L·min-1·m-2)更低[2.1(1.6,2.5)比2.9(2.56,3.41),P=0.002](表1)。
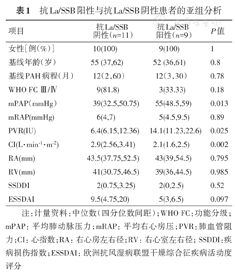
抗La/SSB阳性与抗La/SSB阴性患者的亚组分析
抗La/SSB阳性与抗La/SSB阴性患者的亚组分析
| 项目 | 抗La/SSB阴性(n=11) | 抗La/SSB阳性(n=9) | P值 |
|---|---|---|---|
| 女性[例(%)] | 10(100) | 9(100) | 1 |
| 基线年龄(岁) | 55 (37,62) | 52 (36,61) | 0.8 |
| 基线PAH病程(月) | 12(2,60) | 12(3,30) | 0.78 |
| WHO FC Ⅲ/Ⅳ | 9(81.8) | 3(33.33) | 0.18 |
| mPAP(mmHg) | 39(32.5,50.75) | 55(48.5,59) | 0.013 |
| mRAP(mmHg) | 6(4,7) | 5(4.5,9.5) | 0.89 |
| PVR(IU) | 6.4(6.15,12.36) | 14.1(11.23,22.6) | 0.025 |
| CI(L·min-1·m-2) | 2.9(2.56,3.41) | 2.1(1.6,2.5) | 0.002 |
| RA(mm) | 43.5(37.75,52.5) | 43(39,54.5) | 0.795 |
| RV(mm) | 41(30.75,46.5) | 39(36,44.5) | 0.985 |
| SSDDI | 2(0.75,3.25) | 2(0,2.5) | 0.52 |
| ESSDAI | 9.5(4.75,20) | 5(3,6.5) | 0.097 |
注:计量资料:中位数(四分位数间距);WHO FC:功能分级;mPAP:平均肺动脉压力;mRAP:平均右心房压;PVR:肺血管阻力;CI:心指数;RA:右心房左右径;RV:右心室左右径; SSDDI:疾病损伤指数; ESSDAI:欧洲抗风湿病联盟干燥综合征疾病活动度评分
PAH作为CTD一种虽不常见但却不容忽视的并发症,因其死亡率高,预后不良[6]。与西方国家CTD-PAH以系统性硬化相关为主[6,7]不同的是,在中国以系统性红斑狼疮(SLE)及pSS为主[4]。以往研究发现,经超声心动图确诊的pSS-PAH患病率可能高达10%~23.4%[2,8],同时PAH作为影响pSS预后的危险因素[2],这更加提示需要关注pSS-PAH。
PAH的具体发病机制尚未阐明,但目前认为是由于血管增生、重塑及凝血异常导致血栓形成以及免疫介导的血管病变所致,最终导致PVR[9,10]。有研究提示,抗SSB抗体是SLE患者发生PAH的发病危险因素[11],本研究结果表明,抗SSB抗体与pSS-PAH患者PVR、mPAP相关,提示抗SSB抗体可能在PAH的发病中起作用。作为SS的高度特异性抗体,抗SSB抗体与高丙种球蛋白血症[12]、B淋巴细胞异常活化浸润[13]相关,而炎症细胞的浸润如B细胞在PAH的发病机制中起作用[10]。抗SSB抗体作为一种抗RNA抗体,可以活化Toll样受体(TLR)7[14],最终激活STAT3(signal transducer and activator of transcription 3)信号通路。此通路的激活会促进大鼠肺血管平滑肌增殖并抑制其凋亡,最终导致PAH的发生。因此,抗SSB抗体很可能参与了PAH发病的病理生理机制,但是需要更多相关的研究来进一步证实这一点。
在PAH达标治疗理念被提出之后,大量研究已经证实,治疗达标明显改善患者预后。本研究发现,右心室内径≤40 mm为pSS-PAH患者治疗达标的预测因素。与之相一致的是,Liu等[15]研究发现,基线时右心室前后径大的pSS-PAH患者更不易达标。同时右心室形态改变作为患者右心功能受损的观测指标之一,基线时心功能情况与预后即治疗达标情况密切相关。对于特发性肺动脉高压(IPAH)[16]和SLE-PAH患者[17],右心室内径增加同样是患者预后不良的危险因素。因此,右心室增大不仅可以反映患者右心室形态改变及功能受损,同时代表患者可能对初始PAH治疗方案应答欠佳。对于基线时右心室即增大的患者,初始即给予强化治疗的管理策略是否能改善患者达标情况及预后还有待探讨。
目前,尚无pSS相关PAH诊疗指南,临床多采用免疫抑制剂及PAH靶向药物治疗pSS-PAH患者。作为风湿性疾病治疗中的基石,免疫抑制剂同样在结缔组织病相关肺动脉高压(CTD-PAH)患者的管理中发挥重要作用。Qian等[17]研究发现,强免疫抑制剂(如环磷酰胺、霉酚酸酯、他克莫司等)的应用,特别是针对基线时有浆膜炎的SLE-PAH患者,明显改善患者预后,促进治疗达标。强免疫抑制剂还能明显改善CTD-PAH患者mPAP和PVR等血流动力学指标[18]。此外,Liu等[15]发现,对于接受免疫抑制剂的pSS-PAH患者,在治疗后更容易达标,再次强调了早期、足量的免疫抑制剂在改善pSS-PAH患者预后中的地位。本组患者经治疗后无死亡病例,其中达标的12例接受激素联合免疫抑制剂治疗,6例接受强免疫抑制剂(环磷酰胺)治疗,预后良好。这提示了免疫抑制剂在pSS-PAH患者管理中的地位。
然而,本研究仍存在一定的局限性。首先,本研究中心作为三级医疗机构,许多患者转诊至本中心,故可能存在入组偏倚。其次,目前队列样本量较少,未来仍需进一步扩充样本量,对患者进行长期随访,以期优化管理治疗策略。
pSS-PAH患者以中年女性为主,主要表现为活动后气短等非特异性症状,以PAH为首发症状就诊者并不少见。风湿免疫科医师对于抗SSB抗体阳性及基线时右心室径线增大的pSS-PAH患者,更需注意其血流动力学、心功能情况及预后。
所有作者均声明不存在利益冲突



























