版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是最常见的恶性肿瘤之一,其发病率在全球居于恶性肿瘤第3位,死亡率高居第2位,是占全球发病和死亡首位的消化系统恶性肿瘤[1],严重威胁人民群众的生命健康。近来随着我国生活方式及饮食结构的西化,结直肠癌发病率总体呈现上升趋势[2,3,4],已成为我国消化系统发病率第2位、患病率第1位的恶性肿瘤[5,6]。2018年预计我国结直肠癌新发病例超过52.1万,死亡病例约24.8万,新发和死亡病例均接近全世界同期结直肠癌病例的30%[7],疾病负担沉重。因此,降低我国结直肠癌的死亡率和发病率既是刻不容缓的重大临床关键问题,也是实现十九大报告中"健康中国"这一宏伟战略的具体措施。
目前我国结直肠癌5年生存率远低于美国及日韩[8],85%以上的结直肠癌发现即已属晚期,即使经过手术、放化疗、靶向治疗等综合治疗,患者的5年生存率仍明显低于40%;相反,早期结直肠癌治疗后5年生存率可超过95%,甚至可以完全治愈。现阶段我国早期结直肠癌的诊断率低于10%,明显落后于日本(1991年早期诊断率已达到20%)和韩国(2009年已超过20%)[8,9]。因此,为改变我国结直肠癌高发病率、高死亡率和低早期诊断率的现状,早期结直肠癌筛查措施亟待在国内推广。
欧美等发达国家已建立起较为完善的国家结直肠癌筛查体系,我国结直肠癌筛查始于20世纪70年代[10],目前在部分省市或地区有区域性结直肠癌筛查项目开展[11,12,13]。为进一步推进我国的结直肠癌筛查计划,2019年4月13日,由国家消化系统疾病临床医学研究中心(上海)牵头,依托国家消化道早癌防治中心联盟,联合中华医学会消化内镜学分会、中华医学会健康管理学分会、中国医师协会内镜医师分会消化内镜/内镜健康管理与体检/内镜诊疗质量管理与控制专业委员会、中国健康促进基金会、国家消化内镜质控中心和中国抗癌协会肿瘤内镜学专业委员会,组织我国消化、内镜、肿瘤、健康管理和内镜质控等多学科专家,以《中国早期结直肠癌筛查及内镜诊治指南(2014年,北京)》[14]为基础,进一步细化并确立适合我国实际情况的早期结直肠癌筛查流程,联合制定本共识意见。
也称自然人群筛查(natural population screening)或无症状人群筛查(asymptomatic population screening),是采用标准化设计的筛查方案,进行以人群为基础的筛查。多由国家或地区相关部门统一组织,统一投入,以各种手段督促符合筛查条件的全体人群,在规定的、相对集中的时期内参与筛查。其各阶段实施遵循严格的规范,每项流程均可跟踪审查,需要占用较多资源,常需医疗保险系统支持。在检出早期癌的同时发现并干预癌前病变,目的在于降低该人群或地区的结直肠癌死亡率和发病率。
也称机会性筛查或个体筛查(individual screening),是一种基于临床,针对就诊者或体检个体的筛查。依托现有医院、体检中心、社区门诊实施,无需额外资源支持,根据个体情况灵活选择筛查方式,旨在早期检出结直肠肿瘤(包括部分癌前病变),优化治疗效果,但无法判断是否可降低某一人群或地区的结直肠癌发病率。结构化的伺机筛查(structured opportunistic screening),指由官方政策支撑、医疗保险系统支持,广泛覆盖目标人群,通过各种手段推动完成并关注质量,监测结果的伺机筛查。结构化的伺机筛查以美国的广泛结肠镜筛查为典型代表,在我国尚未开展。
早期结直肠癌筛查的长期目标是降低人群结直肠癌死亡率和发病率。以美国为代表的少数发达国家,在全国范围内持续广泛推动早期结直肠癌筛查后,已观察到结直肠癌死亡率和发病率的显著下降[15]。在我国结直肠癌危险因素增多、人口结构老龄化加快、发病率逐步上升的大背景下,从开展筛查到遏制上升趋势,进而观察到实际死亡率和发病率的下降,将是一个相当漫长的过程。考虑到我国大部分地区尚未建立完善的死亡和肿瘤登记系统,有效监控长期目标存在诸多困难。早期结直肠癌筛查的中期目标是提高早期癌在结直肠癌总体中所占的比例,降低筛查间期结直肠癌的发病率。国际上有研究将结肠镜质控指标与筛查的中期指标如间期癌联系起来[16,17],但间期癌的定义、规范及识别在我国尚未达成广泛共识[18,19],可操作性较弱。筛查的短期目标着眼于提高人群筛查率,提高早期结直肠癌及重要癌前病变(进展期腺瘤、广基锯齿状病变及其他伴有高级别上皮内瘤变的病变)检出率和提高结肠镜检查质量。短期指标可即时观察早期结直肠癌筛查项目的成效,便于审查及持续质量改进[20],在我国现阶段可操作性较强。亚太结直肠癌筛查共识曾明确提出:结直肠癌筛查项目的各个环节都应进行审查和质量控制[21],主要通过监测多个短期指标实现。
筛查的长期目标:降低人群结直肠癌死亡率和发病率。筛查的中期目标:提高早期癌在结直肠癌总体中所占的比例,降低筛查间期结直肠癌的发病率。筛查的短期目标:提高人群筛查率,提高早期结直肠癌及重要癌前病变检出率,提高结肠镜检查质量。
推荐评估短期指标促进筛查项目质量持续改进,并酌情兼顾中、长期指标。
亚太结直肠癌筛查共识建议在发病率大于30.0/10万的国家或者地区开展人群筛查。目前,结直肠癌发病率≥30.0/10万的30个国家几乎都开展了基于人群结直肠癌筛查或结构化的伺机筛查,36个发病率≥25.0/10万的国家均进行了人群筛查试点[22]。随着经济社会发展,我国结直肠癌发病率持续上升,据GLOBOCAN2018数据估计,我国结直肠癌年龄标化发病率(世界标准人口)已达23.7/10万,其中男性发病率为28.1/10万,女性为19.4/10万[7],人群筛查的必要性和紧迫性逐渐增加。但我国人口众多,城乡、地域、经济社会发展程度差异巨大,目前尚无简易而高效的筛查手段进行全民结直肠癌普查。依据现有经验,我国结直肠癌预防知识知晓率低,人群筛查依从性不高,严重降低了筛查的效率[11]。在各级医疗机构(医院、卫生院、社区门诊)和体检中心面向就诊者及体检个体进行的伺机筛查,简便、实用、依从性较好,能明显缩小筛查人群,节省卫生资源,是我国结直肠癌筛查的重要组成部分和有效措施,特别是在资源有限的情况下,建议集中力量开展伺机筛查。加强结直肠癌预防宣传和健康科普教育,结合当地实际情况,将人群筛查与伺机筛查有机结合,是符合我国国情的筛查模式。
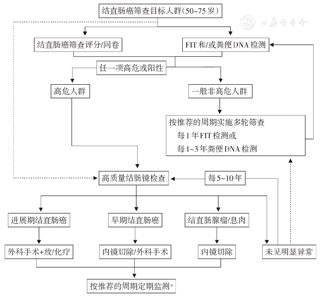
结直肠癌的发病率随年龄的增长而上升,在50岁之前发病率较低,而在50岁以后呈现快速上升的趋势。大多数欧美国家把50~75岁作为结直肠癌筛查的目标年龄段。76~85岁人群根据个人健康状况和预期寿命选择是否参与筛查,85岁以上则不再建议筛查。新近,美国癌症协会(ACS)根据流行病学数据和数学模型研究,建议从45岁开始结直肠癌筛查[23]。我国结直肠癌人群发病率从40岁开始上升速度加快,50岁以上加快更为明显[24]。而我国人口基数巨大,依据2010年第6次人口普查数据,我国50~75岁人群总数为2.94亿人,40~44岁和45~49岁人数分别达1.25亿和1.06亿。据2012年全国消化内镜医师执业情况普查数据显示,2012年全国仅开展结肠镜583.24万例[25],人均结肠镜资源极其匮乏。根据我国国情及结直肠癌临床流行病学资料,人群筛查建议将50~75岁作为目标年龄段。同时应密切关注40~49岁甚至更年轻人群的结直肠癌流行病学趋势[26,27],并纳入卫生经济学评估[28],结合当地经济社会发展水平、可获得的医疗资源、民众的接受程度等因素综合考虑是否将其纳入目标人群。需要注意的是,结直肠癌患者中约40%无明显报警症状,因此不应因无报警症状而排除筛查对象[29]。进行伺机筛查时,无症状一般个体参照人群筛查年龄范围,可酌情放宽,作为人群筛查未覆盖的年轻和高龄个体的补充。对于有相关症状和体征的个体,特别是便血、黏液血便、排便习惯改变、不明原因贫血、体重下降等报警症状的个体,则不作年龄限制。
筛查模式:人群筛查与伺机筛查有机结合。
推荐筛查对象:(1)人群筛查:50~75岁人群,无论是否存在报警症状。(2)伺机筛查:无症状一般个体,参照人群筛查年龄范围,可酌情放宽;有症状特别是有结直肠肿瘤报警症状的个体,不作年龄限制。
根据危险因素进行风险分层可简便快速筛选出高危受检者,具有重要临床意义。国内的结直肠癌筛查高危因素量化问卷(附表1)凝聚了我国结直肠癌高发现场筛查工作的宝贵经验,尤其适合筛选出有症状、有家族史和高危病史的人群,在我国使用范围广,顺应性良好,是社区筛查的常用风险分层系统[30],但尚有简化优化的空间[31,32]。伺机筛查风险问卷适合于到医院就诊个体的早诊筛查,一般由专业医务人员使用(附表2)。亚太结直肠筛查评分[33]及其修订版[34](年龄、男性、结直肠癌家族史、吸烟和肥胖)作为筛选结直肠癌和进展期腺瘤高风险人群的工具更为简洁易用,适用于我国无症状人群,已得到较为广泛的验证[21,35]。基于我国无症状人群年龄、性别、吸烟、结直肠癌家族史、体质指数(BMI)和自诉糖尿病的评分系统可预测结直肠腺瘤、进展期腺瘤和结直肠癌的总体风险,有助于后续筛查方案的选择[36](附表3)。
推荐选用结直肠癌筛查评分/问卷进行结直肠癌风险评估,提高筛查参与率,浓缩高危人群,指导筛查方法选择。
FOBT是结直肠癌无创筛查的最重要手段,包括化学法和免疫化学法。
愈创木脂粪便隐血试验(gFOBT)是目前最常用的化学法粪便隐血试验,具有价格低廉、检测便捷等优点,人群筛查参与率相对较高,研究证实其能降低结直肠癌的死亡率[37]。但gFOBT检出结直肠癌及其癌前病变的敏感性较低[38],故无法显著降低结直肠癌的发病率。此外,其检测结果易受食物、药物等多种因素干扰,假阳性率相对较高。近年来已逐步被免疫化学法粪便隐血试验所取代。
FIT利用人血红蛋白抗原抗体反应的原理进行检测,克服了化学法产品的不足,特异性、敏感性及阳性预测值明显提升,检测结果不受食物或药物的影响,更适用于人群筛查。FIT有多种检测方法,主要包括胶体金法、乳胶凝集比浊法以及酶联免疫法等,其中以定性的胶体金试纸在我国结直肠癌筛查中的应用最为广泛[12],且以连续两个粪便样本的FIT检测成本效益更佳[39,40],改善采样装置及检测模式有助于提升受检率[41]。乳胶凝集比浊法可量化测定粪便中低浓度的血红蛋白,具有自动化分析、通量高、判读客观、阳性界值可灵活调整等优点,在西方发达国家使用较多,我国亦有小范围开展。目前推荐每年进行1次FIT检测[42]。荟萃分析结果提示FIT筛检出结直肠癌的敏感性和特异性分别为79%和94%[43]。在无症状风险升高人群中,FIT诊断结直肠癌的敏感性和特异性分别为93%和91%[44]。FIT的主要不足是检出进展期腺瘤的敏感性偏低,一般仅20%~30%,在高危人群中亦不足50%[44,45]。
粪便DNA检测主要针对结直肠脱落细胞的基因突变和/或甲基化等特征,有单靶点和多靶点方案,也可与FIT联合检测,具有无需特殊设备、无需限制饮食、无创等优点,有望应用于人群普查,近年来成为研究的热点之一。
近期一项大规模临床研究发现,对于结直肠癌的诊断,多靶点FIT-DNA联合检测(包括FIT与KRAS突变、NDRG4甲基化和BMP3甲基化)比FIT敏感性更高(92.3%比73.8%),特异性略低(86.6%比94.9%),可检出更多的进展期腺瘤及有意义的锯齿状病变[45],美国多个权威组织推荐将其应用于无症状人群结直肠肿瘤早期筛查,推荐周期为3年1次或1年1次。与国外相比,该技术在国内虽然起步较晚,但一直在不断探索中。如人类肠癌SDC2粪便基因检测试剂盒目前已获国家药品监督管理局批准用于肠癌检测,临床试验数据显示,该试剂盒可以检测出84.2%(315/374)的结直肠癌,特异性达97.9%(821/839),其中对于可根治的Ⅰ-Ⅱ期肠癌检出率达86.7%(137/158)[46]。国内另一项多中心临床研究(共纳入500例患者,其中132例结直肠癌患者)显示,采用人类SFRP2和SDC2基因甲基化联合检测试剂盒(荧光PCR法)联合检测粪便中人源SDC2和SFRP2基因甲基化,诊断结肠癌和进展期腺瘤的敏感性分别达97.7%和57.9%,显著高于FIT法(69.7%和21.1%,P<0.05),区分良性息肉、其他肿瘤或非癌性结肠病变的特异性也显著高于FIT(90.5%比73.0%)[47]。
粪便DNA检测用于人群早期结直肠癌筛查的主要缺点在于价格相对偏高,筛查间期尚不确定。目前国内尚无粪便DNA检测的大样本人群筛查数据,也缺乏多轮粪便DNA检测筛查的长期随访研究结果。今后值得在国内开展大样本人群筛查研究以明确粪便DNA检测在结直肠癌筛查中的确切价值,验证最适合国人的分子靶点,并推荐最适宜的筛查间期。
结肠镜检查在结直肠癌筛查中占据独特而不可替代的地位,是整个结直肠癌筛查流程的核心环节。以美国为代表的少数发达国家采用结肠镜检查进行一步法筛查,大多数采用两步法的国家将其作为所有初筛阳性者的后续确证检查。结肠镜下活检或切除标本的病理检查是结直肠癌确诊的金标准,镜下切除癌前病变可降低结直肠癌的发病率和死亡率[48,49]。
结肠镜可直接观察到结直肠腔内壁,是发现肠道肿瘤最敏感的方法,但结肠镜检查仍有一定漏诊率,主要发生在近端结肠,以锯齿状息肉和平坦腺瘤为主[50]。获得良好的肠道准备,进行规范的结肠镜操作和精细耐心地镜下观察是降低病变漏诊率的重要措施。所以,结肠镜检查对受检者和内镜医师都有较高要求。由于结肠镜检查前需要进行饮食限制和严格的肠道清洁准备,未接受镇静/麻醉结肠镜检查的部分受检者需承受较大痛苦,导致其依从性不佳。另外,结肠镜检查的直接与间接费用也会影响人群参与筛查的意愿;而且结肠镜检查属于侵入性检查,有一定的并发症发生率,目标人群常由于畏惧而拒绝结肠镜检查。国内外研究数据显示,即使是FOBT阳性者,随后进行结肠镜检查的比例也仅有30%~40%[51]。
即使在美国等发达国家也远未实现适龄人群的结肠镜普查[52,53],考虑到我国结肠镜资源匮乏且分布不均,直接结肠镜筛查可作为个体化筛查的重要手段予以宣传推广,但不适宜应用于大规模人群普查。将适龄人群进行有效分层和精准初筛,在充分浓缩的高危人群中进行结肠镜检查并不断提高受检依从性,是更符合中国国情的人群筛查策略。
乙状结肠镜可检查降结肠、乙状结肠及直肠,对肠道准备要求低,在部分欧美国家用于结直肠癌筛查,而在我国应用较少。近期一项纳入170432例受检者的大样本量随机对照研究显示:乙状结肠镜筛查可显著降低人群结直肠癌的发病率和死亡率,其中发病率下降35%,死亡率下降41%[54]。但由于乙状结肠镜自身的局限性,其对近端结肠肿瘤的发病率无明显降低作用。我国一项研究显示:中国患者中38%的结肠腺瘤和42%的结直肠癌位于近端结肠,提示乙状结肠镜检查会遗漏大量结肠病变[55]。因此目前不推荐使用乙状结肠镜进行结直肠癌筛查。
结肠CT成像又称CT模拟全结肠镜,是指在肠道清洁后,通过腹部高精度CT检查模拟成像,获得结直肠的三维图像从而诊断肠道肿瘤的方法。该方法需肠道准备、操作相对复杂、检查费用昂贵,同时存在假阳性、放射线危害、人群接受度低等诸多问题,目前暂不建议应用于人群筛查。仅适用于部分无法完成全结肠镜检查的病例[56]。
胶囊内镜检查具有无痛苦、方便快捷等优点。目前有少数研究尝试将结肠胶囊内镜用于结直肠癌筛查。一项早期研究表明,胶囊内镜对大于1cm结肠息肉的诊断敏感性为60%,对结直肠癌的诊断敏感性仅74%,约2%的结肠胶囊内镜操作失败,8%的受检者出现不良事件[57]。虽然近期的研究提示其新一代产品诊断效能有所改善[58,59],但由于发现病变后无法取活检的局限性,仍需结肠镜确证,综合成本效益考虑,目前国内暂不推荐用于结直肠癌人群筛查。
甲基化SEPT9(mSEPT9)基因是结直肠癌早期发生发展过程中的特异性分子标志物,最近我国一项大规模临床试验发现其诊断结直肠癌的敏感性和特异性分别为74.8%和87.4%,均高于FIT检测[60]。但mSEPT9对于癌前病变(结直肠腺瘤、息肉及进展期腺瘤)的诊断敏感性和特异性不足,不推荐用于人群筛查,可作为个体化诊断的选择与补充。
肿瘤细胞中M2-PK的过表达可促进大分子的生物合成,进而影响肿瘤增殖和转移。对17项研究共12 116例受检者的荟萃分析表明,结直肠癌患者粪便中M2-PK的水平显著高于健康人群,其敏感性为80.3%,特异性为95.2%,均明显高于FOBT,目前尚待国内临床研究验证其筛查效果[61]。
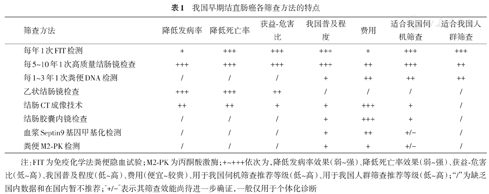
各种筛查方法的特点见表1。
我国早期结直肠癌各筛查方法的特点
我国早期结直肠癌各筛查方法的特点
| 筛查方法 | 降低发病率 | 降低死亡率 | 获益-危害比 | 我国普及程度 | 费用 | 适合我国伺机筛查 | 适合我国人群筛查 |
|---|---|---|---|---|---|---|---|
| 每年1次FIT检测 | + | +++ | +++ | +++ | + | +++ | +++ |
| 每5~10年1次高质量结肠镜检查 | +++ | +++ | +++ | +++ | ++ | +++ | ++ |
| 每1~3年1次粪便DNA检测 | / | / | / | + | ++ | ++ | ++ |
| 乙状结肠镜检查 | +++ | +++ | ++ | / | / | / | / |
| 结肠CT成像技术 | ++ | ++ | + | + | +++ | + | / |
| 结肠胶囊内镜检查 | / | / | / | + | +++ | + | / |
| 血浆Septin9基因甲基化检测 | / | / | / | + | ++ | +/− | / |
| 粪便M2-PK检测 | / | / | / | + | + | +/− | / |
注:FIT为免疫化学法粪便隐血试验;M2-PK为丙酮酸激酶;+~+++依次为,降低发病率效果(弱~强)、降低死亡率效果(弱~强)、获益-危害比(低~高)、我国普及程度(低~高)、费用(便宜~较贵)、用于我国伺机筛查推荐等级(低~高)、用于我国人群筛查推荐等级(低~高);"/"为缺乏国内数据和在国内暂不推荐;"+/−"表示其筛查效能尚待进一步确证,一般仅用于个体化诊断
推荐的筛查方法:(1)FIT,推荐筛查周期为每年1次;(2)粪便DNA检测,建议筛查周期为每1~3年1次;(3)结肠镜检查,推荐筛查周期为每5~10年1次高质量结肠镜检查。人群筛查主要选用上述推荐方法;伺机筛查时,为提高筛查参与率,应结合各方法特点,充分考虑个人意愿,灵活、综合选用筛查方法。
初筛环节的质量控制,因人群、方法差异较大,横向对比较为困难,目前建议依托筛查短期指标进行项目的纵向持续质量改进[20]。
高质量的结肠镜检查是保证结直肠癌筛查项目成功的关键。近期一项大规模荟萃分析发现,结肠镜对腺瘤的漏诊率为26%,进展期腺瘤漏诊率达9%[50]。建议在结直肠癌筛查时严格执行结肠镜检查的质控标准。
1.合格的肠道准备比例应≥90%。研究表明,肠道准备不充分时腺瘤检出率显著降低,漏诊率显著上升[62]。目前已有多种肠道准备评分量表,其中波士顿肠道评分量表(BBPS)具有稳定性较高、不同肠段的评分与该肠段息肉检出率相关且方便学习、推广等优点,BBPS评分≥6分时可认为肠道准备充分,在国内已有多项研究验证其有效性[63,64]。
2.盲肠插镜率≥95%。研究表明,盲肠插镜率高于95%的内镜医师,其所诊治患者的结肠间期癌发病率显著低于盲肠插镜率小于80%的内镜医师所对应的患者[65]。因此,在排除结肠梗阻性病变、活动性炎症性肠病、肠道准备极差等因素后,回盲部插镜率应≥95%。
3.退镜时间≥6 min:与平均退镜时间<6 min的内镜医师相比,退镜时间≥6 min的内镜医师腺瘤检出率显著提高(28.3%比11.8%)[66];中位退镜时间为9 min的内镜医师其腺瘤、锯齿状息肉的检出率最高[67]。因此推荐退镜观察时间应至少保证6 min,适当延长退镜时间可能进一步提高腺瘤检出率。
4.腺瘤检出率(adenoma detection rate, ADR):ADR被认为是与结肠镜质量最相关、最重要的指标:ADR每增加1%,结直肠间期癌发病风险则降低3%,致命性间期癌风险降低5%[17]。欧美国家的经验表明:在50岁以上的无症状平均风险人群中ADR应≥25%,男性≥30%,女性≥20%[68]。近期研究显示,中国人群的ADR约为14%~15%[63,69],建议我国适龄一般人群的ADR目标值≥15%,其中男性应≥20%,女性应≥10%。FIT或粪便DNA阳性人群的ADR应高于此标准。
5.阳性结肠镜平均腺瘤数(adenomas per positive index colonoscopy,APPC):荟萃分析发现,APPC与腺瘤漏诊率和进展期腺瘤漏诊率均独立相关,APPC低于和高于1.8时,腺瘤漏诊率分别为31%和15%;APPC低于和高于1.7时,进展期腺瘤漏诊率分别为35%和2%,可能是潜在的结肠镜质控指标[50]。因我国结直肠息肉切除术后病理送检情况差异较大,尚需后续研究证实。
绝大多数开展结直肠癌筛查的国家或地区采用两步法筛查,在我国人群筛查也推荐采用两步法进行。通过结直肠癌筛查评分、问卷和/或常用初筛试验可筛选出高危人群。评分、问卷评定为高风险或FIT、粪便DNA检测阳性者归为高危人群,其结直肠癌及癌前病变的发生风险明显升高,需接受结肠镜检查;无任一项者为非高危人群(包括部分评分系统的低风险和中等风险人群),风险相对较低,建议采取多轮非侵入筛查和定期随访策略,可优化资源配置,提高筛查效率。参考国内外的结直肠癌筛查策略,结合最新的高质量临床研究证据,建议我国早期结直肠癌人群筛查流程如图1。对于伺机筛查,则筛查方法更加灵活,流程更体现个体化。此外,随着认识的深入,对于部分较为特殊的人群,已有细致的专题讨论:典型的结直肠癌遗传家系的癌变发生风险很高,其诊治和管理流程依照相应共识进行[70];炎症性肠病相关肿瘤的筛查和监测不同于一般人群,参照相关共识推荐执行[71]。结直肠癌治疗后[72]或结直肠腺瘤切除后[14]的个体,以往在筛查中有所涉及,应逐步纳入规范的肿瘤监测管理。
参与本共识意见制定的专家(按姓氏汉语拼音排序):白书忠(中国健康促进基金会);柏愚(海军军医大学长海医院);蔡全才(海军军医大学长海医院);柴宁莉(解放军总医院);陈刚(中国健康促进基金会健康管理研究所);陈卫昌(苏州大学第一附属医院);陈卫刚(石河子大学医学院第一附属医院);陈幼祥(南昌大学第一附属医院);党彤(包头医学院第二附属医院);杜奕奇(海军军医大学长海医院);范竹萍(上海交通大学医学院附属仁济医院);戈之铮(上海交通大学医学院附属仁济医院);郭强(云南省第一人民医院);郭学刚(空军军医大学西京医院);何兴祥(广东药科大学附属第一医院);和水祥(西安交通大学医学院第一附属医院);洪海鸥(安徽省立医院);胡兵(四川大学华西医院);黄永辉(北京大学第三医院);姜慧卿(河北医科大学第二医院);金震东(海军军医大学长海医院);李良平(四川省人民医院);李汛(兰州大学第一医院);李延青(山东大学齐鲁医院);李兆申(海军军医大学长海医院);廖专(海军军医大学长海医院);令狐恩强(解放军总医院);刘俊(华中科技大学同济医学院附属协和医院);刘思德(南方医科大学南方医院);刘玉萍(四川省人民医院);吕宾(浙江省中医院);吕农华(南昌大学第一附属医院);梅浙川(重庆医科大学附属第二医院);任建林(厦门大学中山医院);任旭(黑龙江省医院);盛剑秋(解放军总医院第七医学中心);姒健敏(浙江大学附属邵逸夫医院);宋震亚(浙江大学医学院附属第二医院);孙明军(中国医科大学附属第一医院);王邦茂(天津医科大学总医院);王贵齐(中国医学科学院肿瘤医院);王洛伟(海军军医大学长海医院);王雯(解放军联勤保障部队第九〇〇医院);王新(空军军医大学西京医院);吴建胜(温州医科大学附属第一医院);徐红(吉林大学白求恩第一医院);徐卸古(中国健康促进基金会);许建明(安徽医科大学第一附属医院);杨玉秀(河南省人民医院);游苏宁(中华医学会继续教育部);于红刚(武汉大学人民医院);袁媛(中国医科大学第一临床学院);曾强(解放军总医院健康管理研究院);张国新(江苏省人民医院);张开光(安徽省立医院);张澍田(首都医科大学附属北京友谊医院);赵秋(武汉大学中南医院);赵晓晏(陆军军医大学新桥医院);郑树(浙江大学);智发朝(南方医科大学南方医院);钟良(复旦大学华山医院);周平红(复旦大学中山医院);邹多武(上海交通大学医学院附属瑞金医院);邹晓平(南京大学医学院附属鼓楼医院)
主要执笔者:柏愚(海军军医大学长海医院);杨帆(海军军医大学长海医院);赵胜兵(海军军医大学长海医院);潘鹏(海军军医大学长海医院)
专家组所有成员均声明不存在利益冲突

| 符合以下任何1项或1项以上者,列为高风险人群 | |
|---|---|
| 一、一级亲属有结直肠癌史 | |
| 二、本人有癌症史(任何恶性肿瘤病史) | |
| 三、本人有肠道息肉史 | |
| 四、同时具有以下2项及2项以上者 | |
| 1.慢性便秘(近2年来每年便秘在2个月以上) | |
| 2.慢性腹泻(近2年来腹泻累计持续超过3个月,每次发作持续时间在1周以上) | |
| 3.黏液血便 | |
| 4.不良生活事件史(发生在近20年内,并在事件发生后对调查对象造成较大精神创伤或痛苦) | |
| 5.慢性阑尾炎或阑尾切除史 | |
| 6.慢性胆道疾病史或胆囊切除史 | |

| 以下6种情况之一,可作为高危个体 |
|---|
| 一、有消化道症状,如便血、黏液便及腹痛者;不明原因贫血或体重下降 |
| 二、曾有结直肠癌病史者 |
| 三、曾有结直肠癌癌前疾病者(如结直肠腺瘤、溃疡性结肠炎、克罗恩病、血吸虫病等) |
| 四、结直肠癌家族史的直系亲属 |
| 五、有结直肠息肉家族史的直系亲属 |
| 六、有盆腔放疗史者 |
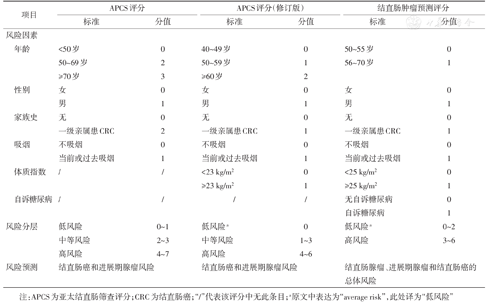
| 项目 | APCS评分 | APCS评分(修订版) | 结直肠肿瘤预测评分 | ||||
|---|---|---|---|---|---|---|---|
| 标准 | 分值 | 标准 | 分值 | 标准 | 分值 | ||
| 风险因素 | |||||||
| 年龄 | <50岁 | 0 | 40~49岁 | 0 | 50~55岁 | 0 | |
| 50~69岁 | 2 | 50~59岁 | 1 | 56~70岁 | 1 | ||
| ≥70岁 | 3 | ≥60岁 | 2 | ||||
| 性别 | 女 | 0 | 女 | 0 | 女 | 0 | |
| 男 | 1 | 男 | 1 | 男 | 1 | ||
| 家族史 | 无 | 0 | 无 | 0 | 无 | 0 | |
| 一级亲属患CRC | 2 | 一级亲属患CRC | 1 | 一级亲属患CRC | 1 | ||
| 吸烟 | 不吸烟 | 0 | 不吸烟 | 0 | 不吸烟 | 0 | |
| 当前或过去吸烟 | 1 | 当前或过去吸烟 | 1 | 当前或过去吸烟 | 1 | ||
| 体质指数 | / | / | <23 kg/m2 | 0 | <25 kg/m2 | 0 | |
| ≥23 kg/m2 | 1 | ≥25 kg/m2 | 1 | ||||
| 自诉糖尿病 | / | / | / | / | 无自诉糖尿病 | 0 | |
| 自诉糖尿病 | 1 | ||||||
| 风险分层 | 低风险 | 0~1 | 低风险a | 0 | 低风险a | 0~2 | |
| 中等风险 | 2~3 | 中等风险 | 1~3 | 高风险 | 3~6 | ||
| 高风险 | 4~7 | 高风险 | 4~6 | ||||
| 风险预测 | 结直肠癌和进展期腺瘤风险 | 结直肠癌和进展期腺瘤风险 | 结直肠腺瘤、进展期腺瘤和结直肠癌的总体风险 | ||||
注:APCS为亚太结直肠筛查评分;CRC为结直肠癌;"/"代表该评分中无此条目;a原文中表达为"average risk",此处译为"低风险"