
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染仍是全球重大公共卫生问题。慢性乙型肝炎临床治愈(亦称功能性治愈)即完成有限疗程后,血清乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)和HBV DNA持续检测不到、乙型肝炎e抗原阴转、伴或不伴HBsAg血清学转换,肝脏炎症缓解和组织病理学改善,终末期肝病发生率显著降低,是目前国内外最新慢性乙型肝炎防治指南推荐的理想治疗目标。临床实践证明,以直接抗病毒药物[如核苷(酸)类似物]或免疫调节剂(如聚乙二醇干扰素)序贯或联合治疗的优化方案针对部分优势人群显示出良好的疗效,开展了一系列成功实现HBsAg阴转的多中心随机对照临床研究。《慢性乙型肝炎临床治愈(功能性治愈)专家共识》阐述了联合治疗方案的最新循证医学依据,并总结了慢性乙型肝炎临床治愈路线图,以指导临床医师治疗决策的制定。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
《慢性乙型肝炎临床治愈(功能性治愈)专家共识》(以下简称共识)为规范CHB临床治愈(或功能性治愈)的治疗策略和技术原则而制定,旨在帮助临床医师在提高CHB临床治愈的抗病毒治疗中做出合理决策。本共识制定的循证医学证据主要来源于CHB核苷(酸)类似物[nucleos(t)ide analogs,NA]经治患者或NA先行治疗患者。本共识根据GRADE分级修订的证据等级分为A、B和C三个等级,推荐等级分为1和2两个级别。见表1。

推荐意见的证据等级和推荐等级
推荐意见的证据等级和推荐等级
| 级别 | 详细说明 | |
|---|---|---|
| 证据等级 | ||
| A级 | 证据来源于多项随机临床研究或多项meta分析 | |
| B级 | 证据来源于单项随机研究,或多项非随机研究 | |
| C级 | 证据来源于专家共识观点,病例报道或诊疗规范性文件 | |
| 推荐等级 | ||
| 1强推荐 | 充分考虑到了证据的质量、患者可能的预后情况及治疗成本而最终得出的推荐意见 | |
| 2弱推荐 | 证据价值参差不齐,推荐意见存在不确定性,或推荐的治疗意见可能会有较高的成本疗效比等,更倾向于较低等级的推荐 | |
随着HBV疫苗联合乙型肝炎免疫球蛋白的母婴阻断措施的普及和强效抗病毒药物的应用,HBV感染的防治取得了长足的进步,然而慢性HBV感染仍是全球的重大公共卫生问题。全世界约有2.4亿慢性HBV感染者,每年约超过65万例患者死于HBV相关终末期肝病,包括肝衰竭、肝硬化和肝细胞癌(hepatocellular carcinoma)[1,2]。CHB的治疗目标是延缓或减少肝硬化失代偿、肝衰竭和肝细胞癌的发生,从而改善患者生命质量和延长生存时间[3,4,5,6]。HBsAg阴转与肝脏功能改善、组织病理改善,以及长期预后改善相关[7],是目前国内外最新CHB防治指南推荐的理想治疗目标,即功能性治愈[3,4,5,6]。然而直接抗病毒药物(direct-acting antiviral agents,DAA;如NA)或免疫调节剂[如聚乙二醇化干扰素α(pegylated interferon alpha,Peg IFNα)]单独使用实现功能性治愈的作用有限。理论上,NA和Peg IFN针对HBV发挥不同的抗病毒作用机制,合理联用能够产生协同和互补的效应。临床实践证明,以NA和Peg IFN序贯或联合治疗的优化方案针对部分优势人群显示出良好的疗效,并积累了诸多成功实现HBsAg阴转的案例和经验。本共识阐述了联合治疗方案的最新循证学依据,并总结了CHB临床治愈路线图的专家共识,指导临床医师治疗决策的制定,以帮助CHB患者实现临床治愈[8]。
作为一种独特的嗜肝DNA病毒,HBV感染人体后通过肝细胞膜上受体,如钠离子-牛磺酸-协同转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)侵入肝细胞内,其基因组部分双链的松弛环状DNA(relaxed circular DNA,rcDNA)进入细胞核并形成病毒复制的模板cccDNA,HBV cccDNA与宿主组蛋白和非组蛋白结合形成病毒微染色体,具有高度稳定性,cccDNA半衰期较长,无需新的病毒进入肝细胞即可自我补充,保持一定数量的转录模板。此外,HBV基因组在宿主细胞酶的作用下,病毒双链线性DNA还可整合至宿主DNA中,整合的病毒基因组片段缺少核心蛋白的启动子和增强子,无法成为病毒复制的模板,但因其含有HBsAg的启动子区域,可持续表达HBsAg[9],是HBeAg阴性患者HBsAg的主要来源。HBV独特、复杂的基因组和复制模式使病毒难以从体内彻底被清除。
HBV感染人体后可导致不同的临床结局,包括急性自限性感染和慢性HBV感染,后者还可分为慢性或非活动性HBV携带者、HBeAg阳性或阴性CHB、隐匿性肝炎、乙型肝炎肝硬化等状态[6]。90%的围生期感染和25%~30%的婴幼儿感染发展为慢性感染;而5岁以后感染者绝大多数可自发清除HBV,仅有5%~10%发展为慢性感染。HBV感染的临床转归和疾病的进程主要取决于病毒复制和宿主免疫应答之间的相互作用。HBV急性感染后,机体通过产生有效的抗病毒免疫应答,包括天然免疫和适应性免疫应答,在清除病毒、控制疾病进程中发挥重要作用。急性自限性感染是理想的HBV感染自然转归,一般无需抗病毒治疗,患者多在感染后半年内发生HBsAg阴转,多数伴有HBsAg血清学转换,尽管不代表体内HBV被彻底清除,但患者长期预后良好。与急性自限性感染相比,慢性HBV感染时,HBV持续复制介导了淋巴细胞亚群功能失衡及紊乱[10,11,12],HBV特异性T淋巴细胞和B淋巴细胞应答的特异性和强度显著降低、功能耗竭[13,14,15,16],从而不能有效发挥抗病毒作用,最终导致免疫耐受状态和感染慢性化。
多数CHB患者通过抗病毒治疗可获得生物化学应答和病毒学应答,即ALT复常、HBV DNA持续低于检测值下限(基本的治疗终点),部分患者可获得HBeAg阴转和(或)血清学转换并达到可靠的停药终点(满意的治疗终点),最终获得肝组织学改善并降低肝硬化和肝细胞癌的发生风险。随着治疗个体化方案不断优化和追求的目标不断推进,以及现阶段高效、安全的慢性丙型肝炎治愈性抗病毒治疗的成功,为探索CHB的治愈策略增强了信心。
CHB治愈的类型主要包括完全治愈(又称为病毒学治愈)和临床治愈(又称为功能性治愈或免疫学治愈)[17,18,19]。完全治愈即血清HBsAg检测不到,肝内和血清HBV DNA清除(包括肝内cccDNA和整合HBV DNA),血清抗-HBc持续阳性,伴或不伴抗-HBs出现[17,18]。由于cccDNA持续稳定存在,且目前缺乏针对cccDNA的特异性靶向药物,所以完全治愈难以实现。临床治愈即完成有限疗程治疗后,血清HBsAg和HBV DNA持续检测不到,HBeAg阴转,伴或不伴HBsAg血清学转换,残留cccDNA可持续存在,肝脏炎症反应缓解和肝组织病理学改善,终末期肝病发生率显著降低。临床治愈类似于急性HBV感染后自发性病毒清除的状态,标志着CHB的持久免疫学控制,是目前国内外指南推荐的理想治疗目标[3,4,5,6]。然而HBsAg阴转时的年龄≥50岁是发生肝细胞癌的危险因素之一[20]。因此,对于适合的优势人群应尽可能追求早期功能性治愈。与完全治愈不同,临床治愈可在优势CHB患者中通过优化治疗方案实现。
目前批准的CHB抗病毒药物包括免疫调节剂(如Peg IFN)以及直接作用于病毒复制周期不同靶点的DAA(如NA)[3,4,5,6]。有限疗程的Peg IFN或长期NA治疗可获得持续生物化学和病毒学应答,肝脏组织学改善,可显著降低但无法彻底消除肝细胞癌发生风险[21]。然而单独应用Peg IFN或DAA均难以实现HBsAg清除。
NA使用方便且耐受性良好,目前约有80%以上接受抗病毒治疗的患者应用NA治疗。作为反转录酶抑制剂,NA可强效抑制HBV复制,然而即使是恩替卡韦(entecavir)、富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,TDF)或富马酸丙酚替诺福韦(tenofovir alafenamide,TAF)等一线NA,均不能直接抑制cccDNA的转录活性,从而无法有效抑制病毒蛋白如HBsAg的表达[22]。尽管长期NA治疗cccDNA和HBsAg水平逐渐下降[23,24,25],但HBsAg阴转率仅0~3%,且NA治疗难以获得持久的免疫学控制,停药后复发率高,因此绝大多数患者需要长期甚至终身服用。如何进一步提高NA经治患者的治疗效果并尽可能实现临床治愈是临床亟待解决的热点和难点问题。
干扰素通过增强免疫细胞功能和促进细胞因子的表达、诱导干扰素刺激基因(interferon-stimulated genes,ISG)的产生并经干扰素信号通路编码多种抗病毒蛋白等环节作用于HBV复制、转录等重要生物学过程,从而发挥免疫调节和抗病毒的双重作用。此外,干扰素可通过增强HBV前基因组RNA(pregenome RNA,pgRNA)和核心颗粒的降解,或通过对cccDNA的表观遗传修饰来抑制HBV转录并减少病毒蛋白如HBsAg的表达[26,27,28]。与NA相比,干扰素疗程有限,血清学应答较高且应答更持久,但干扰素单独使用仅在部分患者中有效,且耐受性相对较差。干扰素治疗优势人群的特点包括相对年轻(包括青少年)、A或B基因型、基线高ALT水平[2×正常值上限(upper limits of normal, ULN)~10×ULN]、低HBV DNA效价、低HBsAg水平等[29]。Peg IFN单药治疗HBsAg阴转率为3%~7%,稍高于NA治疗。上述CHB优势人群在无干扰素使用禁忌证的情况下建议优先考虑Peg IFN治疗,治疗原则请参见相关干扰素治疗指南[6]。
现阶段因缺乏可清除HBV cccDNA和整合HBV DNA的药物,只有打破免疫耐受状态使机体产生有效的固有和适应性抗病毒免疫应答,才能真正达到完全控制病毒复制甚至实现功能性治愈的目的[30,31,32,33]。单独应用NA或Peg IFN对宿主免疫的影响不同,且对免疫应答的恢复作用有限[34]。Peg IFN主要激活天然免疫应答,如增强CD56bright自然杀伤(natural killer, NK)细胞的抗病毒活性,但可能导致效应性CD8+T淋巴细胞功能消耗,对HBV特异性CD8+T淋巴细胞功能的恢复作用有限[35,36]。NA单独应用不能修复NK细胞的抗病毒活性,但对于ALT升高的患者,替比夫定(telbivudine)能一定程度上恢复CD56bright NK细胞的功能[37]。经过NA长期治疗获得病毒学应答的患者,受损的HBV特异性CD8+ T淋巴细胞功能部分恢复[38],提示病毒载量和HBsAg下降可能有助于HBV特异性CD8+T淋巴细胞的功能重建[39]。此外,NA抑制HBV复制,可以直接增强Peg IFN诱导的天然免疫激活效应[34,39,40],上述免疫学发现为两类药物合理联用可能发挥相加或协同效应提供了理论依据。研究表明,对于获得HBsAg清除的患者,阿德福韦酯(adefovir,ADV)和Peg IFN联合治疗可促进HBV特异性T淋巴细胞功能部分恢复[41]。恩替卡韦和Peg IFN序贯治疗诱导的血清学应答与治疗早期固有和适应性免疫细胞的功能修复[42]以及ISG的表达变化密切相关[43],Peg IFN序贯治疗激活CD56brightNK细胞的功能,后者通过直接和间接途径促进HBsAg和cccDNA的清除[44]。总而言之,诸多数据证实了联合治疗在恢复宿主抗病毒免疫应答和清除病毒方面的优势[39]。
推荐意见1:作为CHB抗病毒治疗理想的终点,临床治愈即完成有限疗程后,血清HBsAg和HBV DNA持续检测不到,HBeAg阴转,伴或不伴HBsAg血清学转换,残留cccDNA可持续存在,肝脏生物化学和组织病理学改善,终末期肝病发生率显著降低(A1)。
推荐意见2:CHB临床治愈可以通过恢复宿主固有和适应性免疫应答,从而持久控制HBsAg的产生而实现(A1)。
推荐意见3:NA和Peg IFN对固有和适应性免疫影响不同,且NA强效抑制病毒复制可增强Peg IFN的免疫调节作用,为两类药物合理联用提供了理论依据(A1)。
NA和Peg IFN两类药物的联合治疗通过整合强效抑制病毒和恢复宿主免疫应答的效应,是现阶段最可能实现临床治愈的有前景的治疗策略。临床实践中,NA和Peg IFN联合治疗方案积累了诸多成功实现HBsAg阴转以及NA安全停药的案例和经验[31]。10余年来,国内外肝病学者就联合策略陆续进行了大量探索,尤其是中国学者针对NA和Peg IFN联合个体化治疗策略不断进行优化,在选择何种药物联用、如何进行联用等方面开展了多项多中心随机对照临床研究。目前,NA和Peg IFN联合治疗方式主要包括初始联合治疗策略和序贯联合治疗策略,后者包括"换用"策略(即NA换用Peg IFN)和"加用"策略(即NA加用Peg IFN)。
早期评估初始联合治疗策略的相关研究重点探索如何提高病毒学应答或HBeAg血清学应答,未采用HBsAg阴转作为治疗效果终点。拉米夫定(或ADV)和Peg IFNα-2a初始联合治疗的相关研究表明,与Peg IFNα-2a单药相比,初始联合治疗策略治疗过程中病毒学应答率更高,但未能提高停药后的持续应答率[45,46,47]。一项提前终止的研究评估了HBeAg阳性初治患者接受替比夫定和Peg IFNα-2a联合治疗的疗效和安全性,与Peg IFNα-2a单药相比,联合治疗能显著降低病毒载量和血清HBsAg水平,然而意外增加了严重周围神经病变的风险,因而这两种药物应避免同时联用[48]。一项随机对照研究纳入HBeAg阴性初治患者,与Peg IFNα-2b单药相比,恩替卡韦和Peg IFNα-2b联合治疗病毒学应答率更高,然而两组间HBsAg阴转率差异无统计学意义(9.5%比4.8%)[49]。新近一项随机对照试验纳入HBeAg阳性和阴性初治患者,结果显示与TDF或Peg IFNα-2a单药治疗以及TDF联合Peg IFNα-2a治疗16周相比,TDF联合Peg IFNα-2a治疗48周可显著提高HBsAg下降幅度和停药后24周HBsAg阴转率(9.1%),尤其对于基因A型的患者[50]。继续随访至120周,接受48周联合治疗的患者中,有10.4%实现了HBsAg阴转[51]。另一项小样本研究纳入26例基因C型CHB患者,恩替卡韦和Peg IFNα-2a或Peg IFNα-2b联合治疗48周后,HBsAg阴转的5年累积率达15%[52]。上述研究提示,NA(TDF除外)和Peg IFNα初始联合治疗,HBsAg阴转率与单用Peg IFNα相当,针对干扰素使用优势人群可考虑初始单用Peg IFNα,如何提高非优势人群的临床治愈率需进一步探索,其中联合治疗的给药时机可能是影响治疗效果的关键因素之一。
近年来多项研究显示,对于长期接受NA治疗获得病毒学应答的患者,换用Peg IFN可实现持续HBsAg阴转并有助于NA安全停药。一项小样本单臂研究纳入既往干扰素治疗无应答患者,拉米夫定和干扰素α序贯治疗可实现持续病毒学应答和HBsAg血清学转换(3/14)[53]。OSST研究表明,恩替卡韦经治获得持续病毒学应答且HBeAg水平较低(<100 PEIU/mL)的HBeAg阳性患者,与恩替卡韦单药治疗相比,换用Peg IFNα-2a治疗48周可显著提高HBeAg血清学转换率和HBsAg阴转率(8.5%)[54]。OSST研究随访1年的数据显示,HBeAg血清学转换率由治疗结束时17.7%增加到停药后1年的38.7%,且85.7%治疗结束前发生HBsAg阴转的患者维持该应答[55]。上述数据和新近多项临床研究结果均为长期NA治疗序贯Peg IFN可促进HBsAg水平下降和清除提供了直接循证学依据[56,57]。换用时机可能是决定序贯治疗策略疗效的关键因素之一。一项随机对照研究表明,HBeAg阳性初治患者接受恩替卡韦治疗21周后Peg IFNα-2a序贯治疗48周,与Peg IFN单药治疗相比,在停药后持续应答上未显示出明显优势[58]。NEW SWITCH研究探索了干扰素"换用"策略的最佳时机和疗程,研究表明针对NA经治获得HBeAg阴转的患者,延长序贯Peg IFNα-2a疗程至96周较48周并未显著提高HBsAg阴转率(14.4%比20.7%)[59]。一项前瞻性研究纳入41例HBeAg阳性经恩替卡韦治疗后获得HBeAg血清学转换的患者,序贯Peg IFNα-2a治疗48周,停药后24周,6例(15%)患者实现HBsAg阴转[60]。Endeavor研究随机纳入接受长期恩替卡韦治疗并获得HBeAg阴转的患者,与换用Peg IFNα-2b单药或继续恩替卡韦单药治疗相比,Peg IFNα-2b、重组人IL-2和治疗性疫苗的序贯联合治疗HBsAg阴转率更高(9.38%)[61]。
"加用"治疗策略即在NA实现持续病毒学应答后加用Peg IFN,该策略与继续NA单药治疗相比,在HBsAg下降或清除方面显示出更好的疗效。一项观察性研究结果表明,12例接受NA治疗的患者加用Peg IFNα-2a后,2例患者发生HBsAg血清学转换[62]。一项前瞻性研究纳入10例经长期NA治疗获得HBV DNA持续抑制的HBeAg阴性患者,加用Peg IFNα-2a后6例患者实现HBsAg阴转及NA安全停药[63]。PEGON研究表明,恩替卡韦或TDF经治HBeAg阳性患者,加用Peg IFNα-2b联合治疗48周后,与NA单药治疗相比HBeAg血清学转换率无显著提高[64]。一项回顾性配对研究显示,长期接受恩替卡韦单药治疗未实现HBeAg血清学转换的HBeAg阳性患者,加用Peg IFNα-2a治疗可显著提高HBeAg血清学转换率(44%比65%)和HBsAg阴转率(0比4%)。且基线HBsAg低水平(<1 000 IU/mL)和12周HBsAg下降>0.5 lg IU/mL能预测最有可能实现HBsAg阴转的患者[65]。HERMES研究表明,NA经治基因D型HBeAg阴性的CHB患者,加用Peg IFNα-2a可显著降低其HBsAg水平[66]。PEGAN研究结果则显示,使用NA治疗并获得病毒学应答的HBeAg阴性患者,加用Peg IFNα-2a治疗48周,96周时HBsAg阴转率与继续NA单药治疗相比,差异无统计学意义(7.8%比3.2%),但HBsAg水平下降更显著[67]。ARES研究表明,针对HBeAg阳性患者,NA治疗第24周开始加用Peg IFNα-2a至48周,与NA单药治疗相比,HBeAg血清学应答率显著提高,且HBV DNA和HBsAg水平下降更明显[68]。新近一项随机对照研究纳入HBeAg阳性初治患者,接受TDF治疗12周后加用Peg IFNα-2b治疗24周,该方案较TDF单药治疗HBsAg阴转率更高(7.5%比1.9%)[69]。另一项小样本随机对照研究则纳入长期接受TDF治疗的HBeAg阳性患者,加用Peg IFNα-2a的患者中,20%实现了HBsAg阴转,而继续TDF单药治疗的患者无一例出现HBsAg阴转[70]。
近期一项meta分析纳入了24项涉及NA和干扰素联合治疗的临床研究,结果表明,序贯联合策略与初始联合策略相比,在治疗48周或52周时能实现更高的HBsAg阴转率(11%比8%)。此外序贯联合策略中,"换用"策略第48周或第52周的HBsAg阴转率(14%)显著高于"加用"策略(8%)[71]。一项回顾性研究纳入恩替卡韦经治HBeAg阴性患者,结果表明无论是"换用"Peg IFNα-2a治疗(9%)还是"加用"治疗(15%),其HBsAg阴转率均显著高于恩替卡韦单药治疗(0)。72周时"换用""加用"和恩替卡韦单药治疗组的应答率(HBsAg水平下降>1 lg IU/mL)分别为60%、40%和2%[72]。另一项针对NA经治获得病毒学应答的HBeAg阴性患者的非随机研究显示,8/10换用Peg IFNα-2a的患者和2/11加用Peg IFNα-2a的患者HBsAg水平下降>1 lg IU/mL,表明"换用"策略较"加用"策略更可能促进HBsAg水平降低。研究者推测由于"换用"策略中,停用NA可能通过激活宿主免疫应答从而有助于提高Peg IFN的疗效[73]。一项正在进行的随机对照研究(SWAP研究)纳入接受长期NA治疗的患者,中期分析数据表明,加用Peg IFN组(9.0%)和换用Peg IFN组(8.9%)的HBsAg阴转率均高于NA单药治疗对照组(0),而换用组的病毒学复发率(30.2%)显著高于对照组(3.3%)和加用组(2.0%)[74]。
根据现有的相关研究难以明确最佳的联合治疗策略,由于NA抑制HBV复制可直接增强Peg IFN介导的天然免疫激活效应,NA只有经长期治疗才能获得持续病毒学抑制并降低HBsAg水平,从而部分恢复HBV特异性T淋巴细胞功能,因而推测:药物选择(强效NA联合Peg IFN)、给药时机(NA先行治疗后序贯Peg IFN)以及患者筛选(持续病毒学抑制及低抗原血症)是影响联合治疗效果的关键因素。
基线及治疗早期HBsAg定量或HBsAg快速下降可作为预测干扰素序贯联合治疗HBsAg阴转和制定个体化治疗决策的重要标志物[75,76,77]。OSST研究和NEW SWITCH研究分层分析结果表明,长期NA治疗序贯Peg IFNα-2a时,基线HBeAg阴转且HBsAg<1 500 IU/mL的患者治疗48周时,HBsAg阴转率较高(22.2%~26.5%),而HBsAg≥1 500 IU/mL的患者HBsAg阴转率较低(1.6%~3.8%)。此外,治疗第12周或24周时,HBsAg<200 IU/mL的患者最有可能获得HBsAg阴转(48.9%~77.8%)。相反,第12周时HBsAg≥1 500 IU/mL或24周时HBsAg≥200 IU/mL的患者难以实现HBsAg阴转(0~1.7%),因此建议这些患者停用Peg IFN治疗[54,59]。与上述结果一致,新近一项研究采用换用Peg IFN治疗作为NA停药策略,结果同样表明20%基线HBsAg<1 500 IU/mL的患者可实现HBsAg清除,而基线HBsAg<500 IU/mL是预测HBsAg阴转的最佳指标(HBsAg阴转率达50%)[60]。据此本共识提出DAA(如恩替卡韦/TDF)序贯联合免疫调节剂(如Peg IFN)治疗过程中基于HBsAg动态变化的CHB临床治愈路线图,其中整合了基线特征指导治疗(baseline guided therapy, BGT)和应答指导治疗(response guided therapy, RGT)策略(图1)。基于该路线图,基线HBsAg低水平且HBeAg阴性的优势患者接受序贯Peg IFN治疗更有可能实现临床治愈,该理论被多项研究进一步证实。Endeavor研究显示,基线HBsAg水平<1 500 IU/mL的患者HBsAg阴转率高达27.3%[61]。目前,正在开展的多项研究针对优势人群采用序贯联合治疗进一步证实了BGT策略的有效性。一项随机对照研究纳入NA经治获得病毒学应答且HBsAg<2 000 IU/mL的患者,换用Peg IFNα-2b治疗60周,促进治疗结束时HBsAg阴转(32.6%)和HBsAg血清学转换(27.9%)[78]。Anchor研究则随机纳入NA经治低HBsAg水平(<3 000 IU/mL)的患者,与恩替卡韦单药治疗(HBsAg阴转率或转换率为0)相比,序贯联合96周Peg IFNα-2b加或不加粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)能显著提高HBsAg阴转率(21.21%~27.78%)和HBsAg血清学转换率(19.44%~21.21%)[79]。ICURE研究纳入NA经治低HBsAg水平(<1 000 IU/mL)且HBeAg阴性患者,接受序贯联合Peg IFNα-2b治疗后,66.67%的患者实现了临床治愈。治疗结束后,80%的患者在停药随访第24周仍维持应答[80]。为验证RGT策略,近期PYRAMID研究纳入NA经治后获得病毒学应答(HBsAg<5 000 IU/mL且HBeAg<100 PEIU/mL)的HBeAg阳性患者,第24周时HBsAg<200 IU/mL的患者,56.5%于第72周时实现HBsAg阴转;若第24周时HBsAg≥200 IU/mL者,继续联合治疗组仅4.5%的患者获得HBsAg阴转;而第24周时停用Peg IFN的患者均未能实现HBsAg阴转[81]。上述数据证实,基于24周时HBsAg<200 IU/mL的RGT策略可以帮助预测能继续使用联合治疗并可能获益的患者。此外,NA经治患者联合Peg IFN治疗后12周或者24周HBsAg下降的幅度同样可能是预测48周或72周的有效指标。Anchor研究中期数据显示,序贯联合Peg IFNα-2b治疗12周和24周HBsAg下降≥1 lg IU/mL,80.00%和62.50%的患者治疗72周时可实现HBsAg阴转,反之,仅8.43%和3.03%的患者可获得HBsAg阴转[79]。大样本多中心真实世界COST临床研究也将为路线图的验证提供有力的循证医学证据。
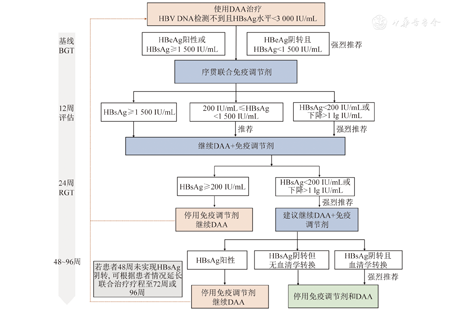

注:BGT为基线特征指导治疗;RGT为应答指导治疗;DAA为直接抗病毒药物;HBV为乙型肝炎病毒;HBsAg为乙型肝炎表面抗原;HBeAg为乙型肝炎e抗原
推荐意见4:联合治疗药物选择包括DAA(如强效NA:恩替卡韦和TDF等)和免疫调节剂(如Peg IFN)(A1)。
推荐意见5:对于接受NA治疗后HBV DNA检测不到,尤其是HBeAg阴转且HBsAg水平低(<3 000 IU/mL)的患者,"加用"或"换用"Peg IFN的序贯联合治疗策略可以提高功能性治愈率。"换用"策略可能出现病毒学复发,应注意随访和监测(A1)。
推荐意见6:整合基于HBsAg动态变化的BGT和RGT策略的路线图可用于指导DAA(如强效NA)序贯联合免疫调节剂(如Peg IFN)的治疗决策(A1)。
推荐意见7:DAA(如强效NA)序贯联合免疫调节剂(如Peg IFN)治疗,基线低HBsAg水平(<1 500 IU/mL)且HBeAg阴转,或治疗早期(12或24周)HBsAg<200 IU/mL或HBsAg下降>1 lg IU/mL可预测最有可能获得HBsAg阴转的患者(A1)。
推荐意见8:治疗24周时HBsAg≥200 IU/mL的患者获得HBsAg阴转的可能性小,应考虑停用Peg IFN,或选用其他治疗药物(如NA)(A1)。
在实现临床治愈的治疗过程中应定期和长期随访。肝活组织检查由于有创性和风险性而难以普及,临床实践中定量监测肝内cccDNA和总HBV DNA水平仍是重大挑战。为了更好地评估患者接受抗病毒治疗后是否获得临床治愈,需要探索新的无创替代标志物。
血清HBsAg水平一定程度上反映cccDNA转录以及mRNA翻译活性。基线和治疗早期HBsAg低水平或显著下降是预测HBeAg血清学转换后HBsAg阴转的有效标志物,可帮助识别干扰素治疗的优势人群[82,83]。即使是基线HBsAg<1 000 IU/mL的非活动性携带者,接受96周Peg IFNα-2a单药或联合ADV治疗后,44.7%的患者可获得HBsAg阴转[84]。对于初始使用Peg IFNα-2a的患者,治疗24周时是否获得HBsAg<1 500 IU/mL且HBV DNA<1×105拷贝/mL的应答可以指导后续治疗,并提高临床获益[85]。而对于NA经治患者,基线HBsAg<1 500 IU/mL、治疗12周或24周HBsAg<200 IU/mL的患者序贯Peg IFN治疗实现HBsAg阴转的可能性大。此外,NA治疗结束时HBsAg水平可预测停药后持续应答率并识别停药后可能获得HBsAg阴转的患者[86]。除外HBsAg定量,一项大型队列研究表明,HBeAg血清清除后ALT持续复常的患者在其后20年内HBsAg阴转率较高(70.3%)[87]。
基线抗-HBc水平是预测HBeAg阳性患者NA或Peg IFN抗病毒治疗效果的新型生物学标志物[88,89,90,91]。对于HBeAg阴性的CHB初治患者,抗-HBc定量水平可预测HBV DNA阴转及HBsAg清除[92]。由HBcAg、HBeAg和相对分子质量为22×103的前核心蛋白组成的HBV核心相关抗原(HBV core antigen related antigen,HBcrAg),与肝内cccDNA水平具有良好的相关性。HBcrAg水平联合HBsAg定量可帮助预测NA停药后的复发风险[93]。血清HBV RNA是反映肝内cccDNA转录活性的良好的生物学标志物[94],可早期预测抗病毒治疗期间HBeAg血清学转换以及停药后病毒学复发和HBsAg逆转[94,95,96]。
在应用Peg IFN单药或联合治疗前,需评估疗效和安全性相关重要指标,包括HBsAg、HBeAg和HBV DNA水平、血常规、生物化学指标、肝脏超声和瞬时弹性成像、甲状腺功能、精神状态、自身免疫抗体、眼底检查,以及其他常规检测,排除糖尿病、高血压等其他基础疾病,对于制定合适的治疗策略和预测治疗效果至关重要。此外,Peg IFN治疗过程中也应定期监测上述指标,以评估不良反应的严重程度和疗效。
对于实现HBsAg阴转或血清学转换的患者,治疗结束后第1年每3个月随访1次,第2年每6个月随访1次,此后若没有HBsAg逆转可延长至每年随访1次。如果在随访期间出现病毒学或临床复发,综合评估后可考虑再治疗。近期一项研究表明,干扰素停药后52周内HBsAg仍有发生逆转的风险,建议在此期间仍应密切监测HBsAg定量[97]。
一旦失去对HBV感染的免疫学控制,即便是获得HBsAg阴转的患者仍有可能发生HBsAg和HBV DNA逆转。因此,HBsAg阴转患者除外监测HBsAg,每年还应监测HBV DNA和ALT定量水平。
研究表明,尽管HBsAg阴转能显著降低肝细胞癌和肝脏疾病的发生风险,但仍有一部分获得HBsAg阴转的CHB患者会进展为肝细胞癌。对于已确诊肝硬化、HBsAg清除时年龄>50岁、男性或有肝细胞癌家族史的CHB患者应密切监测肝细胞癌发生风险[20]。
对于已实现HBsAg阴转的进展期肝纤维化或肝硬化患者,应每间隔3~6个月通过甲胎蛋白、肝脏超声、必要时CT或MRI等辅助检查监测肝细胞癌发生风险,对于基础合并食管静脉曲张的患者,则应定期行内镜检查对食管静脉曲张进行长期监测。若存在其他肝脏疾病的风险因素,如饮酒、肥胖和(或)2型糖尿病、非酒精性脂肪性肝病或非酒精性脂肪性肝炎的CHB患者,则需要进行更全面的评估。
最近一项研究显示,接受抗病毒治疗并获得完全病毒学抑制的患者肝细胞癌以及肝脏事件发生风险更低,在此基础上获得HBsAg阴转可进一步减少肝细胞癌发生风险,但并未降低肝脏事件发生风险以及肝脏相关病死率,提示肝脏炎症和损伤可能是发生肝脏事件的主要驱动因素。此外,有无肝硬化仍是患者发生肝脏事件和肝脏相关死亡的主要危险因素[98]。因此,HBsAg阴转后仍应持续监测HBV DNA和ALT水平。中国开展的大样本多中心真实世界OCEAN临床研究将提供远期转归的循证医学数据。
HBsAg阴性、抗-HBc阳性的患者接受免疫抑制剂治疗或肿瘤化学治疗时存在HBV再激活的风险[4,99]。开始相关治疗之前应评估患者的ALT、HBV DNA和HBsAg水平,治疗期间和治疗结束后也应密切监测上述指标。
推荐意见9:联合免疫调节剂(如Peg IFN)治疗之前,需评估包括HBsAg效价、HBV DNA、HBeAg、血常规、生物化学指标、肝脏超声和瞬时弹性成像、甲状腺功能、精神状态、自身免疫抗体、眼底检查等重要基线指标用以指导治疗决策、预测治疗效果等。治疗期间仍需定期监测上述指标以评估治疗安全性和有效性(A1)。
推荐意见10:即使获得HBsAg阴转,仍需长期监测HBV再激活、肝细胞癌,以及其他肝脏事件。建议治疗结束后第1年每3个月随访1次,第2年每6个月随访1次,此后若HBsAg持续阴性可延长至每年随访1次。若出现复发,综合评估后可考虑再治疗(A1)。
清除cccDNA和打破宿主免疫耐受的两大难题是实现CHB治愈的主要障碍。只有持续深度抑制HBV复制,并诱导有效的抗病毒免疫应答,才能彻底控制HBV感染[74]。目前,诸多全新的抗病毒治疗手段,包括针对HBV生命周期不同阶段,如HBV进入(NTCP抑制剂)、HBV cccDNA生成及加工(cccDNA抑制剂)、病毒复制及病毒蛋白表达(衣壳组装修饰剂、RNA干扰、核酸聚合物等)的DAA,以及恢复或提高宿主抗病毒免疫应答的免疫调节剂等,正在通过动物或细胞模型进行筛选,部分已经进入早期临床试验,这些新的治疗药物将有助于进一步优化和完善现有的CHB临床治愈抗病毒治疗方案[30],并最终清除cccDNA,实现CHB的完全治愈。
1.评估免疫学和病毒学生物标志物对治疗起始、临床治愈或治疗失败的预测价值。
2.需大样本研究进一步验证DAA(如NA)和免疫调节剂(如Peg IFN)的序贯/联合治疗路线图。DAA(如TAF)与Peg IFN等免疫调节剂联合使用的疗效及安全性有待进一步研究。
3.评估治疗结束后HBsAg阴转的持续应答率,探索预测停药后持续应答的生物化学标志物。
4.开展长期随访研究评估联合治疗实现临床治愈后肝细胞癌和肝脏事件的发生风险及相关风险因素。
5.治愈CHB任重道远,迫切需要研发针对HBV生命周期靶点的新型DAA或旨在重建机体抗HBV免疫应答的免疫调节剂。
共同起草专家:宁琴、吴迪、王贵强、任红、高志良、胡鹏、韩梅芳、王艳、张文宏、鲁凤民、王福生
编写专家组(按姓氏汉语拼音排序):陈良、陈新月、陈永平、邓存良、窦晓光、段钟平、福军亮、高海女、韩英、侯金林、贾继东、江家骥、李兰娟、李家斌、李军、李太生、李智伟、毛青、孟庆华、宓余强、南月敏、彭劼、尚佳、盛吉芳、谭德明、唐红、魏来、邬小萍、谢青、尤红、于岩岩、张欣欣、张跃新、赵彩彦、赵鸿、赵英仁
安纪红、陈佰义、陈红、陈红松、陈煜、陈智、陈志海、范建高、傅青春、甘建和、郭武华、韩涛、何艳、黄燕、贾战生、江建宁、江应安、李成忠、李佳、李杰、李树臣、李太生、李武、李兴旺、李用国、李玉芳、林炳亮、林锋、林明华、蔺淑梅、刘景丰、刘晓清、刘正印、陆伦根、路青华、罗新华、吕晓菊、马雄、茅益民、孟庆华、倪武、聂玉强、牛俊奇、彭仕芳、祁伟、任万华、石荔、孙剑、唐小平、王峰、王磊、王明贵、王煜、王者令、韦嘉、翁心华、肖永红、谢雯、辛绍杰、邢卉春、熊勇、许烂漫、徐小元、阎明、杨东亮、杨积明、杨永峰、余祖江、俞云松、曾玫、张岭漪、张权、张专才、赵景民、赵敏、赵守松、赵中夫、庄辉、左维泽,以及中国治愈肝炎联盟全体成员
所有作者均声明不存在利益冲突


























