
利用前列腺特异膜抗原(PSMA)抑制剂进行177Lu-PSMA放射性配体治疗(RLT)是针对转移性去势抵抗性前列腺癌(mCRPC)患者的一种新型治疗模式。研究表明,该疗法行之有效且患者耐受性好。基于临床需求和现有研究依据,该疗法已在全球范围内的多个医疗中心付诸实施。该文对177Lu-PSMA的RLT的几个重要方面进行综述,包括患者分级分期、治疗方案、合并用药、患者随访等,旨在对参与RLT的医务工作者和mCRPC患者提供指导。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)是一种在雄激素阻断治疗下仍可发生转移扩散及疾病进展的致死性前列腺癌。尽管mCRPC的治疗取得了一定进展,但其疾病进展往往不能得到有效控制,患者生存期通常不超过20个月[1]。基于临床对mCRPC有效疗法的迫切需求,以及放射性配体治疗(radioligand therapy, RLT)在转移性神经内分泌肿瘤治疗中的巨大成功,177Lu标记配体进行前列腺癌治疗的策略近年来逐步开展并取得了一定进展[2]。
由于前期131I标记前列腺特异膜抗原(prostate specific membrane antigen, PSMA)治疗研究取得了良好的结果,2015年海德堡大学医学院的德国癌症研究中心开始实施177Lu-PSMA的RLT[3]。177Lu-PSMA的RLT靶向于前列腺癌细胞膜上高表达的PSMA[4]。即使实施多种疗法,PSMA在转移灶中仍保持高表达[5,6],因此可经静脉反复给予177Lu-PSMA进行系统RLT[7]。
由于临床上mCRPC患者的迫切需求,且早期数据显示RLT安全有效,177Lu-PSMA的RLT已在德国和全世界广泛应用,预计目前已实施超过1 000次的治疗周期[7,8,9,10,11,12,13,14,15,16,17,18]。鉴于这种快速实施,大量关于剂量学、安全性和有效性等的回顾性研究为目前的临床方案提供了指导。在本文中,笔者对一些主要发现进行综述,总结177Lu-PSMA的RLT策略在mCRPC治疗中的现状,以便在患者纳入准则、治疗方案、临床应用、毒性和患者随访等方面为读者提供指导。
1.靶点。PSMA,又名叶酸水解酶Ⅰ或谷氨酸羧肽酶Ⅱ,在前列腺癌细胞中高表达[19,20]。PSMA的表达与肿瘤分级[19,21]和早期复发[22,23]呈正相关。与前列腺癌细胞相比,正常人体组织包括前列腺上皮细胞、小肠、肾小管和唾液腺中PSMA的表达水平极低[4]。
PSMA是一种Ⅱ型跨膜蛋白,包括2种单体及相应的膜内区、跨膜区和膜外区[24]。PSMA在同型二聚体模式下具有酶活性,经网格蛋白介导的内吞作用与配体结合[25]。确定底物及结合位点激发了脲基高亲和性PSMA抑制剂的发展,此类抑制剂通常有良好的生物分布,且在细胞摄取上有较高的肿瘤/本底比值[26,27,28]。
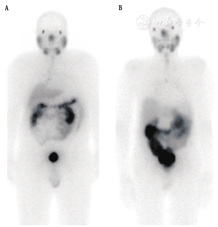
2.配体。目前,临床报道的用于177Lu的RLT主要有2种PSMA配体:一种是最早被Heidelberg研究组发现的177Lu-PSMA-617[29],是目前绝大多数研究中心使用的配体[9,10,11,12,14,16,17,18];另一种是由Wester研究组首次报道的177Lu-PSMA I&T(显像和治疗)[30]。2种配体对PSMA都有很高的亲和力(nmol级),且在前列腺癌细胞中有较强而持久的聚集。2种配体的生物分布极为类似,在肾脏、泪腺、唾液腺和近端小肠中有较高的生理性摄取(图1)。
主要受辐射照射的器官包括:肾脏(0.5~0.8 Gy/GBq,保守剂量限值23 Gy[31])、泪腺和唾液腺(0.6~1.4 Gy/GBq,剂量限值未确定[31])[8,10,11,12,17,32]。骨髓(0.05 Gy/GBq)[8,11,12,17]和肝脾(均0.5 Gy/GBq)[12,17,32]中的辐射剂量远低于临界值。
现有研究表明2种配体在临床上没有明显差异,但尚没有文献对两者进行详细对比。因此,177Lu-PSMA-617和177Lu-PSMA I&T被统称为177Lu-PSMA。
3.准则。177Lu-PSMA的RLT尚未被美国食品药品监督管理局(Food and Drug Administration, FDA)或欧洲药监局批准,因此暂无正式确定的患者纳入标准。现有治疗是以临床试验形式(NCT03042312, NCT03042468, ACTRN12615000912583)或在地方法规监管下用于所有其他疗法治疗无效的患者。非临床试验患者的纳入准则由德国12家RLT医学中心的放射性药物专家提出[33]。该准则是基于177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽[1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA)-D-Phe1-Tyr3-Thr8-octreotate,DOTATATE]或DOTA-酪氨酸3-奥曲肽(DOTA-Tyr3-octreotide, DOTATOC)治疗的回顾性研究[7]、专家意见和治疗建议[34]。

概括来讲,177Lu-PSMA适用于对现有批准疗法无效的进展性mCRPC患者,包括以下几种情况:经PSMA显像(PET或SPECT)确认的PSMA阳性表达的肿瘤或转移性病灶患者;具有足够的骨髓储备,WBC计数低于3×109/L(3 000/μl),PLT低于75×109/L(75 000/μl)的患者;血肌酐水平低于正常上限2倍的患者;氨基转移酶水平低于正常上限5倍的患者;停止骨髓抑制疗法6周以上的患者。
进行RLT前2周内应进行血液检查,包括全面的代谢功能检查和完整的血细胞计数。确诊或可疑的肾脏及泌尿系统疾病患者在每个治疗周期前都应行肾动态显像。尿路梗阻会增加肾脏承受额外辐射剂量的风险,在前期111In-喷曲肽实验中已发现这一现象[35],因此尿路梗阻是RLT的禁忌证之一。该准则应经多学科肿瘤委员会联合讨论确认。
4.RLT方案。目前,大部分医疗中心进行RLT间隔为8~12周[8,12,14,15,16,17,18]。177Lu-DOTATATE治疗经验提示,RLT间隔为8周,每个疗程后检测血细胞计数的最低点[2]。在RLT的疗程之间,每2~4周应进行完整的血细胞计数,以此来评估潜在的血液毒性[14]。图2提供了重复进行RLT可参考的治疗计划时间表。
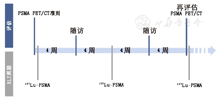

目前尚未评估患者可承受的最大治疗活度。多数治疗中心参照临床试验标准,即在每个治疗周期给予活度6.0或7.4 GBq。在此治疗剂量下,严重不良事件的发生率很低(≤10%),通常表现为血液毒性[7]。RLT的持续时间,即累积剂量,应根据个人反应和耐受程度进行调整。辐射剂量学可以用来监测肾脏和唾液腺的累积辐射剂量。多达6次RLT后,未发现放射性活度引起的肾脏毒性[36];4次治疗后,造成的唾液腺毒性未达3级以上[7]。但目前尚没有长期临床随访报道,考虑到mCRPC患者的平均预期寿命,目前外照射治疗的剂量限值不应在此作为参考[31],而应当以个体患者的有效治疗剂量为准。
5.177Lu-PSMA的临床应用。治疗之前,根据患者的心血管状态,必要时可考虑静脉滴注或口服补液。经静脉注射177Lu-PSMA进行RLT,可以缓慢手动注射或经灌流泵注射。治疗过程中应考虑给予辅助药物干预[33]:排尿障碍应给予利尿剂,便秘应给予泻药,以加速未与肿瘤组织结合的177Lu-PSMA的排泄;唾液腺冰敷以减少血流,直至注射后4 h,从而降低血池相177Lu-PSMA在唾液腺的吸收[37];给予镇吐药(如昂丹司琼);给予糖皮质激素类药物以降低脑、脊髓和其他转移灶的水肿和机械性梗阻的风险。
6.综合治疗。一项多中心研究发现,进行177Lu-PSMA的RLT患者有12%的概率发生严重的血液毒性相关不良事件[7]。因此,任何骨髓抑制疗法应在行RLT至少6周前停止[33]。对于mCRPC患者,推荐同时进行基础的雄激素剥夺治疗[38]。此外,临床前和临床研究均表明,抑制雄激素受体通路可能会增加PSMA的表达水平[39,40]。据文献报道,大多数进行177Lu-PSMA的RLT患者,都同步进行雄激素去势疗法,2种协同疗法的安全性相当可靠[7,8,12,14,15,16,17,41]。目前证据显示,RLT时患者可能停留在雄激素去势疗法的疗效水平;但RLT与其他疗法联合治疗的效果(尤其是与二线雄激素去势疗法或化疗)尚无评价。
7.安全性。多个课题组已评估177Lu-PSMA的RLT安全性[7,8,12,14,15,16,17,41]。最可靠的证据来自于一项多中心试验的回顾性研究,来自德国的12个核医学中心纳入了145例mCRPC患者,这些患者进行了平均2(1~4)个疗程的RLT[7],每个疗程中多数患者的治疗剂量为3.5~7.5(平均6.0) GBq。医师参照标准模板报道患者与治疗可能相关的或不相关的不良事件。此外,通过收集其中121例患者(83%,121/145)在治疗前和随访过程中的血肌酐水平、氨基转移酶水平、WBC计数、Hb和PLT等参数等,评价和报道RLT的毒性。其中,15例(10%)患者发生了3~4级贫血,5例(4%)患者发生了3~4级血小板减少症。
血细胞计数偏低以及弥散性骨髓病变表明可能存在严重的血液毒性风险[7,9,12]。但一项多中心研究显示,仅极少数患者在进行RLT之后血细胞计数下降1个数量级,而3~4级不良事件的发生率比其他疗法都要低(0~3例患者,0%~2%)[7]。其他小型临床试验也证实严重不良事件发生率极低[8,15,16]。经177Lu-PSMA治疗后,mCRPC患者严重血液不良反应的发生率(3%~10%)与安慰剂(1%~14%)或223Ra ALSYMPCA实验(3%~13%)的不良反应发生率基本相似[42]。回顾性数据表明,177Lu-PSMA治疗时,单个疗程给药剂量达7.5 GBq仍能保证较好的安全性,血液毒性仅发生在少数患者中,与177Lu-DOTATATE的RLT基本相似[2]。
8.疗效。Rahbar等[7]通过记录145例患者中的99例(68%)在治疗前及随访中前列腺特异抗原(prostate specific antigen, PSA)水平的变化,对177Lu-PSMA的RLT疗效进行了评估。通过患者血清PSA水平百分比变化确定对治疗的反应,即通过将治疗前的血清PSA水平与治疗后至少8周随访过程中血清最低PSA进行比较,这一变化被称为最大PSA响应。在整个随访过程中,45%患者的血清PSA水平下降了至少50%,此类患者为生化反应型;60%患者的血清PSA水平发生了不同程度的下降。大多数生化反应型患者在第1个疗程后PSA水平就下降了至少50%。肿瘤内脏转移或血清碱性磷酸酶水平≥220 U/L,预示骨转移患者预后较差。
Ahmadzadehfar等[43]最近进行的一项回顾性研究表明,在第1个疗程之后发生PSA水平任何程度的下降,都预示着患者有更长的生存期。另一项回顾性研究证明,与一组历史最佳的维持疗法患者相比,177Lu-PSMA治疗患者的总体生存期更长[18]。然而,关于生存率的前瞻性研究尚未见报道。
47例患者在随访时进行了68Ga-PSMA PET/CT显像,结果发现有45%患者对治疗有部分响应,28%患者处于稳定状态[7]。2个单中心研究证明在治疗之后,利用实体瘤疗效评价标准来进行评判时,患者的肿瘤负荷明显降低[12,17]。
4项回顾性试验评价了患者对于疗效的自述[8,15,16,17]。33%~70%的mCRPC患者自述177Lu-PSMA的RLT后疼痛减轻,60%患者的生活质量提升,74%患者的体力状态得到提升。
总之,超过半数患者在重复进行RLT后发生了生化响应,影像学检查显示超过1/3的患者发生了部分响应。
9.随访。每2~4周应进行临床检查和血液检查,以此来评价毒性和患者对治疗的响应[7]。常规血液检查应包括完整的血细胞计数、全面的代谢水平检查以及血肌酐或肌酐清除率检查。根据患者的合并症及危险程度,可视具体情况增加凝血筛查和试纸测试。
每一疗程后应检测PSA水平以评估患者对治疗的响应。影像学检查(如CT或PSMA PET/CT),应在每2个疗程后进行1次(图3)。177Lu-PSMA的RLT响应标准尚未明确界定。前列腺癌临床试验工作组3的标准可作为评价177Lu-PSMA的RLT响应的合理参考[44],但是否进行重复RLT应根据患者个体对治疗的响应(包括临床症状和生活质量)来决定[16,17]。
10.展望。多项回顾性研究已明确了治疗的剂量学、安全性、有效性以及用于患者分级的风险因素(NCT03042312,NCT03042468,ACTRN12615000912583)。这些研究将评价下列一些临床终点:PSA无进展生存期,放射影像无进展生存期、总生存率,疼痛和生活质量等。为了RLT的获批及临床推广应用,还需要进行类似于NETTER-1的Ⅲ期随机临床试验[45]。
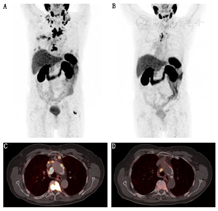

对于进行223Ra或者177Lu-PSMA治疗后疾病仍进展的患者,利用225Ac标记的PSMA-617行α粒子治疗可取得较好的治疗效果[46,47]。射程短、能量高的α粒子治疗可提高疗效并降低对于弥散性骨髓浸润患者的血液毒性。
11.总结。重复经静脉给予177Lu-PSMA进行RLT可以有效降低mCRPC患者的PSA水平以及肿瘤负荷。在极具前景的早期试验证据基础之上,RLT目前在世界范围内的多个中心进行临床试验,或在当地法规监管下成为了一种新的疗法。另外,目前正在进行的多项前瞻性研究也为177Lu-PSMA的RLT将来可能用于mCRPC患者的治疗提供了支持和依据。



























