
炎症性肠病大多于中青年发病,会面临生育问题,故加强妊娠前咨询、优化妊娠期管理可改善不良妊娠结局,提高患者生命质量。本共识基于循证医学依据和Delphi方法,在妊娠前指导和管理、妊娠期管理、分娩方式、哺乳期管理与婴儿疫苗接种共5个方面达成初步共识,为临床工作提供指导。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一类慢性非特异性肠道炎性疾病,主要包括克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)。IBD大多于中青年发病,患者会面临妊娠问题,故妊娠前指导并优化治疗、妊娠期管理对保障患者和胎儿安全具有重要意义。为此,中华医学会消化病学分会炎症性肠病学组组织专家撰写、讨论并投票通过下述共识内容。
本共识意见制定采用Delphi程序,专家组由IBD学组及顾问组成员、产科专家与药剂科专家共同组成。根据共识内容模块分成4个研究小组,由各组专家分别进行文献检索、筛选、评价,以确定共识意见需阐明的问题及推荐方案,再经专家讨论、修改,进行投票并由第3方计票。根据投票结果,专家再次讨论、修改后,进行第2轮投票。最终经各组专家审阅后定稿,达成本共识意见。投票等级分为:a完全赞成(必不可少);b部分赞成,但有一定保留;c赞成,但有较大保留;d不赞成,但有一定保留;e完全不赞成。本共识意见中的推荐等级根据投票结果分为A级指标(强烈推荐),即a得票数≥80%;B级指标(推荐),即a和b得票数相加≥80%;C级指标(建议),即a、b和c得票数相加≥80%;未达C级指标则删除。根据专家投票结果,本共识将推荐等级分为"强烈推荐"、"推荐"和"建议"3个等级。
1.有生育计划的女性育龄IBD患者,建议妊娠前咨询相关专家,以获取更好的妊娠结局。(强烈推荐)
(1)IBD患者的生育力:IBD疾病缓解期患者生育力及妊娠结局与普通人群相当[1,2]。IBD患者生育率减低多与患者主动不生育有关[3]。Meta分析显示,女性IBD患者主动不生育的比例为14% ~ 18%,明显高于普通女性人群(6%)[4]。但当IBD疾病活动时,尤其是活动期CD、穿透性疾病行为、有肠道及肛周手术史的患者,由于盆腔解剖结构改变、组织粘连、瘢痕形成等原因导致输卵管梗阻等,会对患者生育力造成较大的影响。其中回肠储袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)可使不孕风险增加2 ~ 3倍[5,6,7]。此外,男性IBD患者的疾病活动也与受孕困难相关[8]。
(2)IBD疾病的遗传性:IBD的遗传问题也是影响患者生育意愿的原因之一。研究报道IBD患者中约5.5% ~ 22.5%有IBD家族史[9,10]。阳性家族史是IBD发病风险的预测因素,国外资料显示,父母一方患IBD,其后代IBD发病风险较普通人群增加2 ~ 13倍[11,12]。如父母双方均患IBD,其后代IBD发病风险>30%[13,14]。尽管IBD具有遗传倾向,但总体发病率仍很低,不应成为患者主动不育的充分理由。
(3)妊娠前咨询对改善妊娠结局具有重要意义:女性IBD患者更多担心治疗药物对胎儿的不良影响,却很少能认识到妊娠期间IBD疾病活动对孕妇及胎儿的影响。纳入145例IBD女性患者的调查发现,1/4患者认为药物对胎儿的影响比疾病复发更需要关注;1/3患者相信所有治疗IBD的药物均对胎儿有害;约一半患者担心不孕;3/4患者担心IBD会遗传给后代[15,16]。妊娠期患者治疗依从性常下降,研究报道UC和CD孕妇在妊娠期服药依从性分别为59%和72%[17,18]。妊娠前咨询可提高患者妊娠期服药依从性,减少疾病复发,督促患者更好地进行妊娠前管理(如服用叶酸、戒酒和戒烟等)[19,20]。
妊娠前咨询可通过增加IBD患者对生育相关知识的了解,从而减少对生育的顾虑、提高服药依从性、减少疾病复发,有生育计划的IBD患者均应接受妊娠前咨询,以优化妊娠前管理。对初次确诊IBD的患者,需告知患者在有生育计划时向医生咨询妊娠相关问题。
2. IBD患者在疾病缓解期,尤其是在内镜下黏膜愈合状态时妊娠可获得更佳的妊娠结局。因此,对计划妊娠的患者应全面评估病情,尽量在妊娠前进行优化疾病管理。(强烈推荐)
在疾病缓解期受孕的女性IBD患者,近80%在妊娠期维持缓解状态,疾病复发风险与非妊娠患者相似;而在疾病活动期受孕,1/3患者在妊娠期期间维持原来的疾病活动状态,1/3疾病活动有所改善,1/3病情加重[21,22]。在疾病活动期受孕,妊娠期疾病持续活动风险显著增加[23]。Miller[24]对超过1300例女性UC患者和700例CD患者的系统回顾研究显示,约83%CD和85%UC患者正常妊娠,畸形发生率、自然流产和死产的发生率均与健康人群相同。但若妊娠合并IBD疾病活动,妊娠不良结局发生率显著增加,如早产(妊娠37周之前)、低出生体质量儿(low birth weight infant,LBW,<2500 g)、小于胎龄儿(smaller than gestational age,SGA)、新生儿Apgar评分低、入住重症监护室的风险、先天性畸形、孕妇血栓栓塞事件和急诊剖宫产等风险增加[25,26,27,28,29,30,31,32]。来自瑞典的47 110例新生儿登记研究发现,IBD女性患者早产和LBW的风险增加,孕期疾病活动的女性患者风险更高[33]。女性UC患者活动期流产发生风险是缓解期患者的4倍[34]。上述研究结果均提示,疾病缓解期是IBD女性患者妊娠的恰当时机,对计划妊娠的患者应进行全面客观的评估,在妊娠前取得疾病缓解对改善妊娠结局有重要意义[35]。目前较为一致的观点是,至少3个月的无糖皮质激素缓解应作为妊娠前的目标。此外,内镜下黏膜愈合是临床结局的重要预测因素[36],妊娠前达到内镜下黏膜愈合有助于改善妊娠结局[37]。
3.计划妊娠的IBD患者如服用的是含有邻苯二甲酸二丁酯(dibutyl phthalate,DBP)的5-氨基水杨酸(5-aminosalicylic acid,5-ASA),建议更换为不含DBP的5-ASA药物。(强烈推荐)
动物实验显示,DBP和邻苯二甲酸二(2-乙基己基)酯能够抑制子宫发育,影响神经发育及生长发育[38]。个案报道及小样本研究均显示,使用含DBP的5-ASA制剂的患者体内邻苯二甲酸盐代谢物显著升高[39]。鉴于含DBP的5-ASA制剂理论上存在致畸可能,建议受孕前尽量使用不含DBP的5-ASA。更换不同制剂时应保证有足够的调整药物及观察疗效的时间,以确保受孕前持续缓解。对在使用含DBP的5-ASA情况下怀孕的妇女,需个体化处理,是否更换5-ASA应考虑患者的意见、胎龄(如在妊娠前3个月已用药,更换药物可能已不影响发生畸形的风险)和疾病特点等。
4.使用甲氨蝶呤(methotrexate,MTX)维持治疗并有妊娠计划的IBD患者(包括男性),建议妊娠前至少停用MTX 3 ~ 6个月,以将致畸风险降至最低。(推荐)
药代动力学数据显示,MTX的细胞内代谢物甲氨蝶呤多谷氨酸半衰期的中位数为1.2 ~ 4.3周,检测不到代谢物的中位数为10周[40]。尽管有使用MTX妊娠结局正常的报道[41],但暴露于MTX,尤其是妊娠前3个月,可发生流产、生长迟缓、死胎和先天性畸形,包括颅面畸形、肢体缺损和中枢神经系统异常等[42]。系统回顾研究显示,妊娠前3个月内有MTX(5 ~ 25 mg/周)暴露史的女性类风湿性关节炎患者,23%流产,5%新生儿轻微畸形,66%活产[43]。女性和男性患者均应在计划怀孕前至少3 ~ 6个月停用MTX。如在使用MTX期间意外怀孕并希望继续妊娠者,应立即停用MTX并补充大剂量叶酸以降低MTX相关不良反应的风险,并同时转诊产科进行咨询和随访[44]。
5.目前尚无关于受孕前沙利度胺洗脱所需时间的研究证据,根据该药的药代动力学特征,建议妊娠前至少停用沙利度胺6个月以上(包括男性)。(推荐)
沙利度胺对人与动物的一般毒性极低,服用14 g并不使人死亡,但对胎儿具有强烈的致畸作用,对人胚胎的致畸剂量为1 mg/kg体质量,与四肢、耳、眼和神经管缺陷等主要胎儿畸形有关,新生儿死亡率为40%[45]。近期有研究报道,沙利度胺是育龄女性IBD患者发生卵巢储备功能下降的独立危险因素,但停药后可逆转[46]。
6.男性IBD患者备孕期间建议避免使用柳氮磺吡啶(sulfasalazine,SASP)。备孕期间可继续使用5-ASA、抗肿瘤坏死因子(tumor necrosis factor,TNF)-α单克隆抗体、硫唑嘌呤治疗。(强烈推荐)
SASP可引起男性精子活力和计数的下降,该不良反应不能通过补充叶酸得以纠正,但停药后可逆[47]。英夫利西单克隆抗体(infliximab,IFX)治疗对男性IBD患者精液质量的影响报道不一,Mahadevan等[48]的研究显示IFX降低精子活力,而Villiger等[49]则报道接受抗TNF-α治疗的强直性脊柱炎男性患者精子质量更好。小样本研究显示,接受IFX治疗的男性患者其配偶不良妊娠结局无增加[50]。接受AZA治疗的男性IBD患者,精子质量和配偶妊娠结局均不受影响[51,52]。近期研究显示,硫嘌呤类药物维持治疗的40例男性IBD患者的精液分析包括精液量、精子浓度、精子形态和精子DNA片段化水平与健康对照者均无显著差异,但精子的总活力和前进活力较低[53]。该研究的结果进一步支持男性患者在备孕期间可继续服用硫嘌呤类药物。
7.采用SASP或5-ASA维持疾病缓解的女性患者,妊娠期可继续口服和(或)局部直肠用药。SASP干扰叶酸吸收,推荐备孕和妊娠期女性患者补充叶酸(2 mg/d)。(推荐)
病例报道、以人群为基础的队列研究和Meta分析均显示氨基水杨酸类药物不增加妊娠相关不良事件,如异位妊娠、流产等,且无胎儿致畸风险[54,55,56]。Meta分析显示,2200例使用5-ASA的女性妊娠患者发生胎儿先天畸形、死产、自发流产和早产风险并未增高[55]。UC患者妊娠期停用5-ASA的疾病复发率为56.3%,而持续用药的疾病复发率为26.5%(OR = 3.6)[34]。目前尚无明确直肠用药导致早产、流产的报道。
8.采用硫嘌呤类药物维持缓解的IBD患者,妊娠期可继续口服硫嘌呤类药物。(推荐)
对照研究和Meta分析显示,妊娠期IBD患者继续服用硫嘌呤类药物与未用该类药物的患者比较,LBW、先天畸形风险没有增加,但早产风险可能增加[57,58,59]。早期的研究显示,疾病的活动程度而非使用硫嘌呤类药物与妊娠相关不良事件如早产、LBW和先天发育异常相关[60]。近期报道的一项前瞻性队列研究纳入荷兰自2008年至2016年共232例IBD女性患者,期间共有311次妊娠,35%(108次)的妊娠暴露于硫嘌呤类药物,研究结果显示,硫嘌呤类药物未增加自发流产、不良分娩以及出生后1年内婴儿的感染风险[61]。硫嘌呤类药物可通过胎盘,一项纳入30例服用硫嘌呤类药物的妊娠患者的药代动力学研究显示,妊娠时6-甲基巯基嘌呤(6-mercaptopurine,6-MMP)的代谢途径增强,但未发现增加骨髓或肝脏毒性;代谢产物6-巯鸟嘌呤(6-thioguanine,6-TG)在婴儿出生时脐血中的浓度约是母体浓度的一半;该研究还发现60%的新生儿存在贫血,提示对于新生儿需常规检测外周血细胞计数[62]。孕期暴露于硫唑嘌呤的婴幼儿长期随访未发现感染风险增加[63]。
9.采用抗TNF-α单克隆抗体维持缓解的IBD患者,妊娠期可继续维持该药治疗。对于IBD复发风险较低的妊娠女性,建议妊娠22 ~ 24周应用最后一次抗TNF-α单克隆抗体治疗;对于停药后不能维持缓解的妊娠患者,必要时考虑在30 ~ 32周末次使用,并于产后重新开始使用。对于抗TNF-α单克隆抗体与免疫抑制剂联合治疗的患者,建议妊娠期根据患者的个体情况转换为单药治疗。(推荐)
抗TNF-α单克隆抗体包括IFX和阿达木单克隆抗体(adalimumab,ADA)等,抗TNF-α药物作为IgG1型抗体,在妊娠中晚期可通过胎盘[64]。研究显示,宫内暴露于抗TNF-α药物的新生儿出生时血液中及脐血中的药物浓度明显高于母体药物浓度,抗TNF-α药物在婴儿出生后约6个月内均可被检测出[65]。药物对于婴儿的免疫系统发育、疫苗接种效果的影响和感染风险等问题临床广泛关注。2010年1例病例报道,宫内全程暴露于抗TNF-α药物的婴儿出生后3个月时接种卡介苗,4.5个月时死于播散性卡介苗感染[66]。由于孕晚期药物胎盘通过率增高,以及药物潜在的对于疫苗接种免疫反应的影响,多倾向于孕晚期避免使用抗TNF-α药物。较大样本量的PIANO登记研究的初步结果显示,使用免疫抑制如硫嘌呤类、抗TNF-α药物的患者与未使用上述药物的妊娠患者比较,婴儿先天畸形和其他短期不良妊娠结局均无显著差异。然而,宫内暴露于硫嘌呤类药物和抗TNF-α联合治疗的婴儿出生后1年内的感染风险增高[67]。因此,妊娠期尽可能避免抗TNF-α药物与免疫抑制剂的联合使用。
关于妊娠期母亲和胎儿安全的另一项前瞻性研究显示,对比IBD患者妊娠中期停用抗TNF-α药物(孕25周前)和妊娠晚期继续用药(孕30周后)的临床结局,两组患者的复发率、产后继续使用抗TNF-α药物治疗的过敏反应或继发失效率、分娩相关结局均无显著差异;婴儿在出生后1年内的生长发育、感染风险、过敏、疫苗的不良反应发生率均无显著差异。研究提示,为减少胎儿宫内的抗TNF-α药物暴露,妊娠女性IBD患者在妊娠中期停用药物是安全的;对于未能实现持续缓解的患者,妊娠期持续应用抗TNF-α药物未发现额外增加胎儿的风险[68]。抗TNF-α的不同药物之间在妊娠期的药代动力学存在差异。2018年一项单中心前瞻性队列研究显示,妊娠期IBD女性患者应用抗TNF-α药物治疗,包括IFX和ADA,结果在131例次妊娠中脐血IFX的血药浓度增加幅度明显高于ADA,提示妊娠晚期IFX的胎盘通过率高于ADA,如IBD病情需要,妊娠期可考虑适当延长ADA的治疗时间[69]。
10.抗整合素α4β7单克隆抗体在妊娠期应用的证据尚不足,仅在充分权衡女性妊娠患者的获益高于风险的前提下考虑使用。(推荐)
维多珠单克隆抗体(vedolizumab,VDZ)是抗整合素α4β7的IgG1型人源化单克隆抗体,理论上该药物可通过胎盘,目前VDZ对妊娠和胎儿影响的证据报道尚少,仅有小样本临床数据[70,71],未提示VDZ对于妊娠和胎儿存在严重的安全性问题,但仍需更多证据支持。因此,妊娠期使用VDZ仅在充分权衡妊娠患者的获益高于风险的前提下使用。
11.妊娠期IBD的药物治疗需综合患者病情活动程度、既往治疗经过及药物疗效进行调整。妊娠期UC患者如在5-ASA维持治疗期间出现轻中度疾病活动,可考虑口服5-ASA至足量,并联合直肠局部5-ASA治疗以诱导病情缓解。如在足量5-ASA或硫嘌呤类药物维持治疗期间出现病情中重度活动,应考虑系统性糖皮质激素或抗TNF-α药物诱导病情缓解。(推荐)
不同形式给药(静脉、口服、局部)的糖皮质激素均可通过胎盘,但胎盘可迅速将其转化为活性较低的代谢产物,使胎儿血液中的药物浓度降低。其中,泼尼松、泼尼松龙和甲基泼尼松龙可以有效地被胎盘代谢,可作为糖皮质激素妊娠期用药的首选[21,72]。有报道,妊娠早期接受糖皮质激素治疗,胎儿唇腭裂的风险增加[73]。一项基于人群的大样本研究显示,妊娠早期暴露于糖皮质激素的51 973例次妊娠中未发现胎儿颌面部畸形的风险增加[74]。但是,妊娠期间糖皮质激素的长期使用可能增加高血压、糖尿病和先兆子痫等并发症的发生风险[75]。综合考虑,妊娠期病情中重度活动对妊娠结局的影响超出系统性糖皮质激素、抗TNF-α药物的潜在风险,应尽早稳定病情,需结合疾病活动程度、既往治疗经过和所处的妊娠阶段,个体化选择糖皮质激素或抗TNF-α药物治疗。糖皮质激素起效迅速,但不能用于长期维持治疗;抗TNF-α药物可诱导缓解也可维持缓解,但妊娠晚期胎盘通过率明显增高。
12.妊娠期IBD病情中重度活动且糖皮质激素抵抗的患者,推荐采用抗TNF-α药物诱导病情缓解。糖皮质激素抵抗的重度活动性UC也可考虑环孢素治疗。(推荐)
如前所述,妊娠期病情活动的风险超出应用抗TNF-α药物的潜在风险。值得注意的是,妊娠期应用抗TNF-α药物可能出现起效慢、作用弱的表现,与妊娠期药物的分布容积、免疫耐受等机制可能有关。如妊娠超过37周出现病情活动且激素抵抗建议提早启动分娩,避免妊娠晚期胎儿暴露于抗TNF-α药物。一项Meta分析纳入15项研究共410例妊娠期应用环孢素的患者,结果显示环孢素不增加胎儿先天畸形的发生风险[76]。IBD妊娠期应用环孢素的报道仅限于重度活动性UC,安全性同非妊娠患者。但UC病情的重度活动,仍存在早产、LBW等风险[77]。
13.妊娠期IBD病情活动经糖皮质激素治疗诱导病情缓解后,对于5-ASA不能维持缓解的患者,不建议妊娠期初次使用硫嘌呤类药物,可考虑抗TNF-α药物维持缓解。抗TNF-α药物诱导IBD病情缓解后推荐继续该药物进行维持治疗。(推荐)
对于既往无硫嘌呤类药物服用史的患者,妊娠期初次使用硫嘌呤类药物存在潜在的药物不良反应的发生风险。尤其是一些具有个体特异性的不良反应如骨髓抑制、急性胰腺炎等,可能对妊娠带来严重的不良后果。对于既往曾服用硫嘌呤类药物有效且无不良反应的患者,妊娠期可根据患者具体情况考虑加用该药,同时还需考虑硫嘌呤类药物的起效时间。如UC患者妊娠早期病情中重度活动,在糖皮质激素诱导缓解后,可考虑采用美沙拉嗪维持,如美沙拉嗪不能维持病情缓解,可考虑予抗TNF-α药物维持缓解。不推荐在妊娠期初次使用硫嘌呤类药物治疗。
14.妊娠期CD合并肛周病变必须使用抗生素治疗的患者,建议与产科、药剂科共同协商,选择适当的抗生素治疗。(强烈推荐)
甲硝唑、喹诺酮类药物治疗非妊娠期IBD合并活动性肛周病变有效。甲硝唑不增加自发流产、先天畸形风险,既往有妊娠第2 ~ 3个月暴露于甲硝唑的胎儿出现唇裂的报道[78,79]。一项纳入922例妊娠女性在孕期不同阶段甲硝唑治疗的队列研究显示,不良妊娠结局如先天畸形等风险没有增加[79]。孕早期使用新型喹诺酮类药物在小样本(35例)回顾性研究中显示不增加自发流产、先天畸形等风险[80]。动物实验显示,氟喹诺酮类药物增加骨骼肌肉系统异常的发生风险[81],该类药物具有骨组织和软骨亲和性,可引起儿童的关节病变。对于妊娠期合并肛周病变的抗生素治疗选择,建议妊娠早期避免使用甲硝唑,尽量避免妊娠期使用喹诺酮类药物。与产科、药剂科医生共同协商,选择适当的抗生素治疗,并充分与患者沟通。
15.妊娠期IBD住院患者需评估静脉血栓栓塞(venous thromboembolism,VTE)的发生风险。对于妊娠期出现因病情活动住院治疗、计划性剖宫产或存在其他发生血栓栓塞的高危因素患者,建议考虑采用低分子肝素进行预防性抗凝治疗。(推荐)
妊娠期静脉血栓栓塞风险增高4 ~ 6倍,且产后6周内的发生风险最高[82,83]。病情活动入院也是IBD患者发生VTE的危险因素,IBD患者剖宫产是VTE的独立危险因素。《中国住院炎症性肠病患者静脉血栓栓塞症防治的专家共识意见》推荐行剖宫产的妊娠IBD患者在住院期间使用抗凝药物预防VTE,产后出血者慎用[84]。低分子肝素抗凝治疗在妊娠人群是安全有效的[85]。
16.妊娠期IBD患者如需急诊手术控制IBD并发症,不应单纯考虑妊娠而延误手术。(强烈推荐)
妊娠期IBD患者的手术指征与非妊娠期相同。存在急诊手术指征的情况下,无论妊娠所处阶段,都需尽早手术。择期手术治疗的患者可考虑尽量避免妊娠早期和晚期,降低流产和早产风险。对于重度活动性UC药物治疗无效的患者,妊娠期可根据患者的具体情况选择临时回肠造口,并根据子宫的大小、结肠病变程度等具体情况选择适宜的方案处理结肠,避免一期吻合带来的术后并发症发生风险[86]。
17.妊娠期疑诊IBD或IBD病情复发患者,病情评估的影像检查手段首选肠道超声或无钆造影剂的MRI检查。妊娠中晚期,由于胎儿影响肠道超声观察,可考虑行MRI检查;如妊娠期确实需行CT检查,建议充分权衡利弊后决定。(推荐)
女性妊娠IBD患者应尽可能减少放射线接触,仅在放射性检查给患者所带来获益明显高于接触射线、高磁场和对比剂对胎儿可能造成的风险时,才推荐行CT或MRI[87]。Meta分析和系统综述指出,肠道超声、MRI、CT对于诊断IBD有相同的准确性[88,89]。与CT检查比较,肠道超声和MRI检查无放射线暴露,但对于难以评估的解剖结构,肠道超声准确性稍差[89,90]。在妊娠28 ~ 30周后,由于胎儿影响肠道观察,不宜行肠道超声检查。病例对照研究中,无钆造影剂的MRI检查在IBD妊娠女性患者中具有较可靠的诊断准确性[91,92]。尽管MRI与胎儿不良结局并不明确相关,但接触静电磁场、射频脉冲的组织热效应和高噪声水平对胎儿的影响尚不完全确定[87]。另使用钆作为对比造影剂在动物研究中,可能对妊娠产生不良预后[93]。因此,建议在妊娠期尤其是妊娠早期尽量避免使用钆造影剂。如妊娠期间充分权衡利弊确实需要行CT检查,国外相关共识建议累积放射剂量低于100 mGy,单次检查放射剂量不超过50 mGy[94]。
18.妊娠期疑诊IBD或IBD病情复发患者,如病情评估确实需要,可在妊娠期行结肠镜检查,首选乙状结肠镜检查,必要时可考虑全结肠镜检查。如临床情况允许,建议尽可能在妊娠中期进行。(推荐)
借鉴欧洲克罗恩和结肠炎组织(European Crohn′s and Colitis Organization,ECCO)和美国消化内镜协会指南,如指征明确,妊娠期女性可以行消化道内镜检查,如临床情况允许,建议尽可能在妊娠中期进行[95,96]。IBD患者妊娠期进行结肠镜检查时,尽量避免仰卧,宜采取左侧卧位,以避免胎儿压迫主动脉和下腔静脉。同时应尽量缩短检查时间。研究表明,胃镜检查是安全有效的,不增加早产风险[97]。一项前瞻性队列研究纳入42例IBD妊娠女性行结肠镜检查,内镜相关的母体及胎儿不良预后的风险无增加[98]。近期女性妊娠期大宗队列研究显示,内镜检查可能增加早产、小于胎龄儿,不增加先天畸形、死产风险,且与所处妊娠阶段无明确相关性[99]。全结肠镜检查较乙状结肠镜增加早产风险,但不增加小于胎龄儿和先天畸形风险[99]。系统综述表明,妊娠早、中、晚期结肠镜检查是相对安全的[100]。在病情评估需要的前提下,可考虑在妊娠期行结肠镜检查,不应因为妊娠而盲目拖延和拒绝结肠镜检查,延误诊断和治疗。
19. IBD患者在妊娠期进行结肠镜检查时,如需麻醉镇静,建议尽量避免苯二氮 类药物,必要时可考虑使用咪达唑仑,并严密监测胎心。(强烈推荐)
类药物,必要时可考虑使用咪达唑仑,并严密监测胎心。(强烈推荐)
IBD妊娠女性行结肠镜如需要麻醉镇静,哌替啶和芬太尼在妊娠期可安全使用[95,96]。一项Meta分析共包括超过100万例妊娠患者,显示苯二氮 类药物不增加致畸风险,但病例对照研究显示腭裂风险增高2倍[101],因此建议尽量在妊娠早期避免使用苯二氮
类药物不增加致畸风险,但病例对照研究显示腭裂风险增高2倍[101],因此建议尽量在妊娠早期避免使用苯二氮 类药物。如哌替啶及芬太尼不足以满足镇静要求,权衡利弊的情况下,可选择短效药物如咪达唑仑,优于其他苯二氮
类药物。如哌替啶及芬太尼不足以满足镇静要求,权衡利弊的情况下,可选择短效药物如咪达唑仑,优于其他苯二氮 类药物[96]。应用上述镇静药物时需密切监测胎儿心率。
类药物[96]。应用上述镇静药物时需密切监测胎儿心率。
20.对于女性妊娠IBD患者,推荐基于产科考量,并由产科、消化内科及胃肠外科等组成的多学科团队讨论共同决定分娩方式(强烈推荐)。
影响妊娠IBD女性分娩方式的因素众多,包括疾病活动度、既往手术史、是否合并肛周病变、药物使用等病情评估,产科考量,以及患者意愿等。目前,多数基于人群的队列研究及系统综述发现,IBD女性妊娠剖宫产的比例是非IBD患者的1 ~ 2倍[26,29,102,103]。部分患者或医师因担心经阴道分娩可能导致肛周损害而主动选择剖宫产术,但目前尚无足够证据证明经阴道分娩导致肛周病变或影响疾病自然病程[104,105,106]。一项问卷调查发现,在对IBD女性患者妊娠特殊性的认识上,胃肠专科医生和妇产科医生之间亦存在差异[107]。因此,参考国外相关共识推荐通过基于产科考量的多学科综合评估决定分娩方式[94,95]。
21.对于伴有活动性肛周疾病或直肠受累的妊娠女性CD患者,推荐剖宫产,以降低肛周损伤风险。对于接受回肠储袋肛管吻合术(IPAA)或回肠-直肠吻合术的妊娠女性IBD患者,建议在咨询产科和外科医生的情况下,考虑行剖宫产手术,以降低肛门括约肌损伤风险。(强烈推荐)
近期一项研究分析了IBD女性患者剖宫产的指征,其中UC合并IPAA史、CD合并肛周病变是最常见的需剖宫产手术的危险因素[108]。多项回顾性研究发现,与剖宫产相比,经阴道分娩并未增加肛周病变的发生[105,109]。近期的一项系统综述也发现,经阴道分娩未明显增加肛周病变新发及复发率,但约2/3的活动性肛周病变患者阴道分娩后肛周病变加重[103]。2项小样本研究分析了肠道存在活动性病变患者产后预后情况,发现产后疾病进展,但2年随访期内经阴道分娩及剖宫产患者之间无显著差异[109,110]。
国外指南推荐IPAA是剖宫产的相对指征之一,建议在多学科讨论后慎重决定分娩方式。回肠-直肠吻合术可能导致直肠功能不全,且鉴于复发及再次手术风险较高,也推荐其作为剖宫产的相对指征,但目前尚无临床证据明确该类患者可从剖宫产术获益。对于分娩后有较高IPAA手术风险的患者是否需行剖宫产术以避免可能的括约肌损伤尚无研究,建议基于临床实际情况慎重决定。以上推荐基于较低级别临床证据,需要进一步研究证实。
22.目前尚无足够的证据表明剖宫产增加IBD患者产后并发症以及胎儿患IBD的风险。(强烈推荐)
关于剖宫产是否增加IBD女性产后并发症尚缺乏证据。一项基于人群的研究发现,CD患者产后不良分娩结局发生率高于非IBD患者,包括早产、LBW及产后出血。UC患者早产及LBW发生率也有增加。但这些不良结局与剖宫产无明确相关性[102]。一项基于人群的大样本研究探讨剖宫产是否增加胎儿患IBD的风险,结果发现剖宫产并非IBD的危险因素[111]。
23.大部分IBD治疗药物在母乳中可少量检出,但影响甚微。推荐哺乳期IBD患者继续使用常规剂量5-ASA,慎用SASP。(强烈推荐)
氨基水杨酸类药物能够进入母乳,但是并不会引起严重不良反应,这类药物在哺乳期使用是安全的[112],仅有个别案例报道婴儿出现暂时性腹泻[113]。近期研究发现,接受药物治疗的哺乳期IBD患者,其母乳中含有低浓度的药物,未导致婴儿感染及发育迟缓风险增加[114]。SASP的代谢产物之一是磺胺嘧啶,磺胺可引起药物不良反应。如婴儿存在早产、高胆红素血症或患有葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G-6-PD)缺乏症等情况时,应避免在服用SASP期间母乳喂养。服用SASP期间需监测婴儿腹泻情况。
24.糖皮质激素在母乳中亦可检出,常规剂量分泌到乳汁浓度低,对婴儿影响小,较安全。对于糖皮质激素服用剂量超过40 mg/d者,可在服用糖皮质激素4 h后哺乳。(推荐)
多项研究及共识指出,虽然糖皮质激素在母乳中可检出,但对婴儿影响小,哺乳期妇女应用糖皮质激素较为安全[115,116]。泼尼松是哺乳期妇女可选择的最安全的口服糖皮质激素。对于摄入泼尼松剂量40 mg/d以上者,推荐服药4 h后哺乳,错开药物在乳汁的浓度高峰。另有研究发现,即使服用80 mg的泼尼松,分泌至乳汁中的药物量也仅约0.1%,含量不及婴儿内源性激素的10%,不会导致明显的不良反应[117,118]。泼尼松的清除半衰期是2 ~ 4 h,乳汁中药物的清除较血清中更快,且血清-乳汁药物浓度的平衡建立迅速[119],故服药后4 h哺乳,乳汁中激素浓度将低于检测下限,随着时间的延长,乳汁中的药物浓度会进一步减少。
25.哺乳期使用硫嘌呤类药物,建议结合患者的哺乳意愿,谨慎选择母乳喂养,倾向人工喂养。(推荐)
哺乳期应用AZA在风湿病、器官移植方面的研究较多,IBD的研究较少。专家对哺乳期使用硫嘌呤类药物的安全性存在分歧。传统观点认为,AZA可通过乳汁进入婴儿体内,可能增加新生儿骨髓抑制和感染的风险[120,121]。检测乳汁及婴儿血清中AZA代谢产物(6-MMP、6-TGN)含量极低,几乎检测不到,而且婴儿血红蛋白、白细胞、血小板等多项指标均无变化。因此认为,哺乳期应用AZA是安全的[122,123],但尚缺乏高级别循证医学证据的支持[124]。鉴于上述原因综合考虑,越来越多的专家倾向于减少对服用AZA患者母乳喂养的限制[125,126]。结合当前中国社会对于母乳喂养的认识,以及年轻母亲对于母乳喂养的强烈意愿,故推荐意见为"谨慎选择母乳喂养,倾向人工喂养"。如患者坚持母乳喂养,建议开始母乳喂养后10 ~ 15 d监测婴儿血细胞计数。
26.甲硝唑、环丙沙星可经乳汁分泌,没有证据表明在哺乳期使用绝对安全,建议哺乳期尽量避免使用。如必需抗生素治疗,建议更改为人工喂养。(强烈推荐)
口服或静脉注射甲硝唑可进入母乳,长期接触甲硝唑对婴儿有潜在的毒性[126],因此母乳喂养期间一般不推荐使用[112,127]。如果病情需要,美国儿科学会推荐女性接受单剂量(2 g)的甲硝唑,在12 ~ 24 h后再母乳喂养。环丙沙星可经乳汁分泌,研究发现10例产妇口服环丙沙星750 mg,q12h,第3次用药后的24 h,血清浓度与乳汁浓度比例为0.85[128]。环丙沙星治疗期间母乳喂养的安全性证据有限,建议尽可能避免使用环丙沙星,如病情需要,可短期治疗[95]。建议在单次剂量环丙沙星使用后,48 h后再恢复母乳喂养。
27.甲氨蝶呤和环孢素对婴儿免疫系统有抑制作用,并有致肿瘤发生风险,哺乳期禁用。(强烈推荐)
动物实验和自身免疫病患者长期应用甲氨蝶呤和环孢素的观察发现,两者均有致肿瘤发生风险[129,130]。研究及共识认为,大剂量甲氨蝶呤抗肿瘤治疗期间,母乳喂养是禁忌的,建议甲氨蝶呤最后一次剂量治疗后至少停止哺乳1周[131]。有病例报道,口服甲氨蝶呤治疗癌症的哺乳期妇女,可在母乳中检测出低剂量甲氨蝶呤[132]。甲氨蝶呤在婴儿组织中可能存在积累效应[133]。甲氨蝶呤在哺乳期应用的数据很少,多伦多共识组建议哺乳期尽量避免选择该药。哺乳期妇女需服用环孢素时,因母乳中环孢素浓度较高,建议人工喂养[134]。
28. IFX分泌入乳汁量很少,且与其他大分子蛋白质一样会在消化道内被分解破坏,哺乳期应用IFX治疗对婴儿是安全的,但仍需研究证据支持。(推荐)
IFX哺乳期用药的证据有限,是否能通过母乳对新生儿产生影响目前仍存在争议。研究报道IFX可以分泌入乳汁中,其浓度很低(低于其血清水平的1/200)[135]。使用对照母乳样本校准标准曲线的研究发现,母乳中IFX的检测水平明显低于血清中的阈值,影响母乳中微量IFX的检出。此外,这部分微量的IFX在摄食后还会在胃肠内发生蛋白水解,因此它对全身免疫系统的影响可能微乎其微。未发现母亲哺乳期继续采用IFX治疗造成婴儿发生不良事件的报道。目前,仍需要远期的研究来探讨接受IFX治疗的产妇母乳喂养是否对儿童的免疫系统产生影响。
29.妊娠期接受抗TNF-α药物治疗的IBD患者,建议其婴儿接种活疫苗应至少推迟至出生后6个月。(推荐)
TNF-α对免疫系统的发育有重要作用。近期的研究显示,宫内暴露于抗TNF-α药物的婴儿存在部分B细胞亚群和T细胞亚群的减少趋势[136,137]。抗TNF- α药物的宫内暴露在一定程度上会影响疫苗接种后的免疫应答,也与疫苗接种相关的不良反应有关。如前述案例报道宫内暴露于抗TNF-α药物的新生儿在3个月接种卡介苗后死于卡介苗播散性感染[66]。宫内暴露于抗TNF-α的新生儿脐血药物浓度与妊娠期停药时间明显相关,停药时间越晚,脐血中药物浓度越高[138]。有专家意见认为,推迟婴儿活疫苗接种至出生后12个月,或至婴儿体内药物浓度检测不到来指导疫苗接种时间[139]。结合我国国情,对于婴儿出生后定期监测血药浓度不切实际。如妊娠中晚期已停用抗TNF-α药物,建议推迟活疫苗接种至出生后至少6个月。对于妊娠晚期持续用药的患者,婴儿活疫苗接种可酌情延长至出生后12个月,有条件者可考虑检测婴儿血药浓度以指导接种时间。婴儿接种灭活疫苗的时间不受限制,与其他婴儿的接种程序一致。消化科、产科医生需于妊娠期做好孕产妇的宣教工作,与儿科医生共同对患者和婴儿进行管理。
婴儿活疫苗或减毒活疫苗包括卡介苗、麻疹-腮腺炎-风疹疫苗(measles,mumps and rubella vaccine,MMR)、口服脊髓灰质炎疫苗、轮状病毒疫苗。卡介苗为减毒活疫苗,建议由出生时接种推迟至出生后6 ~ 12个月后接种,或检测婴儿体内的药物清除之后。延迟接种卡介苗的婴儿接种前需行结核菌素试验(purified protein derivative,PPD),结果阴性者予接种卡介苗。口服脊髓灰质炎疫苗为减毒活疫苗,建议改为注射灭活脊髓灰质炎疫苗(inactivated poliovirus vaccine,IVP)或灭活五联(百白破-灭活脊髓灰质炎-b型流感嗜血杆菌)疫苗,我国主要使用的是五联疫苗。推荐IBD患者的婴儿使用IVP以及包括IVP的联合灭活疫苗。麻疹疫苗的首次计划免疫时间是8个月,MMR的首次计划免疫时间是18个月。轮状病毒为减毒活疫苗,目前为非计划内免疫,面向6个月至3岁以内儿童,需避免出生后6个月内接种。
执笔者:"妊娠前指导和管理"由何瑶(中山大学附属第一医院消化科)执笔,"妊娠期IBD的疾病管理"由李玥(北京协和医院消化科)执笔,"妊娠期IBD的影像和内镜评估"由谭蓓(北京协和医院消化科)执笔,"分娩方式的选择"由高翔(中山大学附属第六医院消化科)执笔,"哺乳期药物治疗选择、婴儿疫苗接种"由梁洁(空军军医大学西京医院消化科)执笔
参与共识投票专家(按姓氏汉语拼音排序):曹倩(浙江大学医学院附属邵逸夫医院消化科),陈旻湖(中山大学附属第一医院消化科),陈宁(北京大学人民医院消化科),陈焰(浙江大学医学院附属第二医院消化科),董卫国(武汉大学人民医院消化科),窦艳(中国人民解放军总医院消化科),杜奕奇(海军军医大学第一附属医院消化科),韩玮(安徽医科大学附属第一医院消化科),高翔(中山大学附属第六医院消化科),何瑶(中山大学附属第一医院消化科),胡品津(中山大学附属第六医院消化科),胡益群(厦门大学附属中山医院消化科),黄梅芳(武汉大学中南医院消化科),李瑾(武汉大学中南医院消化科),李俊霞(北京大学第一医院消化科),李延青(山东大学齐鲁医院消化科),李毅(东部战区总医院普通外科),李玥(北京协和医院消化科),梁洁(空军军医大学西京医院消化科),刘小伟(中南大学湘雅医院消化科),刘玉兰(北京大学人民医院消化科),刘占举(同济大学附属上海市第十人民医院消化科),牛俊坤(昆明医科大学第一附属医院消化科),缪应雷(昆明医科大学第一附属医院消化科),欧阳钦(四川大学华西医院消化科),钱家鸣(北京协和医院消化科),冉志华(上海交通大学医学院附属仁济医院消化科),施嫣红(同济大学附属上海市第十人民医院消化科),孙菁(上海交通大学医学院附属瑞金医院消化科),田德安(华中科技大学同济医学院附属同济医院消化科),汪芳裕(东部战区总医院消化科),王化虹(北京大学第一医院消化科),王晓艳(中南大学湘雅三医院消化科),王英德(大连医科大学附属第一医院消化科),王玉芳(四川大学华西医院消化科),魏艳玲(陆军军医大学陆军特色医学中心消化科),吴开春(空军军医大学西京医院消化科),吴小平(中南大学湘雅二医院消化科),杨红(北京协和医院消化科),张红杰(江苏省人民医院消化科),张虎(四川大学华西医院消化科),张晓岚(河北医科大学第二医院消化科),张晓琦(南京大学医学院附属鼓楼医院消化科),张亚历(南方医科大学南方医院消化科),郑长青(中国医科大学附属盛京医院消化科),郑鹏远(郑州大学第五附属医院消化科),郑青(上海交通大学医学院附属仁济医院消化科),郅敏(中山大学附属第六医院消化科),钟捷(上海交通大学医学院附属瑞金医院消化科),朱维铭(东部战区总医院普通外科),朱良如(华中科技大学同济医学院附属协和医院消化科)
妇产科专业审阅者:高劲松(北京协和医院妇产科)
药剂科专业审阅者:胡扬(北京协和医院药剂科)
儿科专业审阅者:李正红(北京协和医院儿科)
所有作者均声明不存在利益冲突
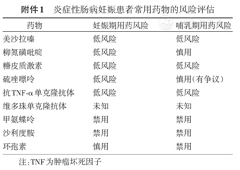
炎症性肠病妊娠患者常用药物的风险评估
炎症性肠病妊娠患者常用药物的风险评估
| 药物 | 妊娠期用药风险 | 哺乳期用药风险 |
|---|---|---|
| 美沙拉嗪 | 低风险 | 低风险 |
| 柳氮磺吡啶 | 低风险 | 慎用 |
| 糖皮质激素 | 低风险 | 低风险 |
| 硫唑嘌呤 | 低风险 | 慎用(有争议) |
| 抗TNF-α单克隆抗体 | 低风险 | 低风险 |
| 维多珠单克隆抗体 | 未知 | 未知 |
| 甲氨蝶呤 | 禁用 | 禁用 |
| 沙利度胺 | 禁用 | 禁用 |
| 环孢素 | 慎用 | 禁用 |
注:TNF为肿瘤坏死因子



























