
应用二代测序技术(NGS)分析急性髓系白血病(AML)患者的突变基因谱,讨论基因突变在疾病预后分层中的价值。
分析2014年1月1日到2017年12月31日间在上海7家综合性医院血液科收治的新诊断的AML(除外急性早幼粒细胞白血病)患者的临床资料。抽取患者的骨髓液,提取RNA和DNA后,应用白血病融合基因和髓系相关基因突变组套进行检测。分析白血病融合基因和基因突变检测结果,比较不同年龄组和不同染色体核型组的患者情况。Kaplan-Meier曲线用于患者生存分析。
共纳入453例初诊AML患者,男女比例1.2∶1,中位年龄49.5(11~85)岁。其中289例患者共检测到了540个突变/融合基因,132例(29.1%)患者存在2个及以上的突变/融合基因。发生频率在10%以上的突变/融合基因有:NPM1突变12.8%,ETO 11.92%,TET2突变11.04%,以及WT1过表达者占10.6%。50岁以上的患者发生与表观遗传修饰相关的基因突变频率较高,ASXL1 11.93%,DMNT3A 13.99%,IDH1/IDH2 6.58%,TET2 13.17%。其中DMNT3A突变发生频率是50岁以下患者的3倍以上(P=0.017)。本研究中,低危核型组患者基因突变发生比例低。中危核型组中,NPM1、TET2、FLT3-ITD、DNMT3A、ASXL1、CEBPA双突变等都有较高的发生频率。高危核型组中ASXL1、TET2、DNMT3A、PHF6突变发生频率在10%以上,其中ASXL1和PHF6突变率明显高于低危和中危核型组(P<0.05)。正常核型AML(NK-AML)患者254例(占56%),其中伴有表观遗传修饰相关基因突变的患者56例,该组患者中位总生存期(OS)较无相关基因突变组患者短,中位无白血病生存期(LFS)差异无统计学意义。年龄大于50岁且有表观遗传修饰基因突变的NK-AML患者,其中位OS 12个月,中位LFS 10个月,而无相关基因突变的患者中位OS和LFS分别为18个月和12个月。
不同年龄组和不同核型分组的AML患者基因突变发生频率有差异。>50岁的AML患者表观遗传修饰基因发生突变的频率高于≤50岁者。年龄>50岁且伴表观遗传修饰基因突变者总生存期短,预后差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一种异质性疾病。目前临床上对该疾病的危险度分层系统主要依赖于患者的细胞遗传学特征,将AML患者分为低危、中危和高危。但在临床实践中发现,同一危险分层中的患者,疾病的生物学特征、患者对治疗的反应、疾病的转归等都不尽相同。随着高通量基因测序技术的发展,国外学者研究了急性白血病相关的基因突变及其在疾病发生中的机制,并已明确了一些特殊类型的突变或融合基因用于指导治疗方案的制定[1,2,3],国内也有单中心报道[4]。
本研究分析了上海7家综合性医院4年的数据,应用二代测序技术(NGS),检测初诊AML[除外急性早幼粒细胞白血病(APL)]患者的突变基因,了解AML相关突变在患者中的分布情况,分析其与发病年龄、遗传学异常等的相关性,讨论基因突变在疾病诊断和预后分层中的价值。
本研究为回顾性多中心临床研究,共收集了2014年1月到2017年12月期间在上海7家综合性医院(上海市第一人民医院、上海长海医院、上海交通大学医学院附属瑞金医院、复旦大学附属中山医院、上海交通大学医学院附属仁济医院、上海市同济医院、上海长征医院)血液科收治的新诊断的AML(除外APL)患者的临床资料。所有患者均经过骨髓细胞形态学、细胞免疫表型检测、染色体核型分析、融合基因检测以及髓系相关基因突变NGS,符合AML相关诊断标准和世界卫生组织(WHO)关于髓系白血病分型标准(2008版)。本课题通过上海市第一人民医院医学伦理委员会科研项目伦理审批(批件编号2019KY007)。
抽取患者骨髓液4~6 ml,EDTA抗凝,分离并收集骨髓单个核细胞,柱式抽提试剂盒分别提取RNA和DNA。RNA用于实时定量PCR检测,筛查急性白血病融合基因如AML-ETO、BCR-ABL、CBFβ-MYH11等。DNA用于AML相关基因突变的NGS检测(上海源奇生物医药科技有限公司),涵盖了ASXL1、FLT3、NPM1、KIT、CEBPA、DNMT3A、IDH、TET2、EZH2、RUNX1、PHF6、TP53、SF3B1、SRSF2、U2AF1、RAS、JAK等基因的热点突变区域,测序深度3 000×。用实时定量PCR技术,在患者接受初始治疗前以及每一疗程化疗后评估等时间节点进行WT1基因表达量检测,以WT1/ABL 2%为阳性界值。
所有纳入本研究的患者,≤60岁者,给予基于DA 3+7方案(去甲氧柔红霉素8~12 mg/m2×3 d+阿糖胞苷100 mg/m2×7 d)诱导化疗,>60岁者,予DA 3+7方案或CAG(阿克拉霉素10~14 mg/m2×4 d+阿糖胞苷10 mg/m2,2次/d×14 d+集落刺激因子300 μg/d)等预激方案诱导化疗。AML患者经诱导化疗获完全缓解(CR)后进入巩固治疗阶段,给予中、大剂量阿糖胞苷单药应用共4个疗程。具备移植条件、有合适供者的、在细胞遗传学分型基础上结合分子生物学标记划分为高危组的患者进行异基因造血干细胞移植。
应用SPSS软件分析本研究相关数据。Kaplan-Meier曲线用于患者生存分析。总生存期(OS)定义为从诊断到患者死亡或随访终止的时间;无白血病生存期(LFS)定义为从完全缓解到疾病复发或患者死亡或随访终止的时间。本研究相关数据应用SPSS软件分析,计数资料的比较应用χ2检验,生存曲线的比较应用Log-rank检验,以P<0.05为差异有统计学意义。
共收集453例初诊的AML(非APL)患者骨髓标本。其中男247例,占54.5%;女206例,占45.5%;男女比例1.2∶1。患者中位年龄50岁(范围:11~85岁),其中≤60岁患者329例(72.6%),>60岁患者124例(27.4%)。按WHO(2008)髓系白血病分型标准,453例入组患者中,AML伴重现性遗传学异常患者54例,其中伴t(8;21)/RUNX1T1 31例(6.84%),伴inv(16)/CBFβ- MYH11 14例(3.09%),伴t(9;11)/MLLT3-KMT2A 3例(0.66%);AML伴BCR-ABL1 6例(1.32%);AML伴基因突变19例,其中伴NPM1突变10例(2.21%),伴CEBPA双等位基因突变9例(1.99%);AML伴与骨髓增生异常相关的特征17例(3.75%);治疗相关的AML 2例(0.44%);髓细胞肉瘤1例(0.22%);非特指类型AML 337例,其中M0 12例(2.65%)、M1 12例(2.65%)、M2 78例(17.22%)、M4 120例(26.49%)、M5 108例(23.84%)、M6 5例(1.10%)、M7 2例(0.44%);未分类的23例(5.08%)。诊断时的白细胞计数(32±34)×109/L,血红蛋白(80±19)g/L,血小板(62±46)×109/L,骨髓原始细胞比例(58±19)%。
按患者核型进行分组,预后良好核型组患者48例(10.6%);预后中等核型组299例(66%),其中正常核型患者254例(56.1%),其他核型45例(9.9%),高危核型组57例(12.6%)。未做核型分析的病例数49例(10.8%)。
453例患者中,164例未检测到本次研究涉及的突变/融合基因,289例患者共检测到了540个突变/融合基因,其中132例(29.1%)患者存在2个及以上的突变/融合基因。发生频率在10%以上的突变/融合基因有4个,分别为:NPM1突变12.8%,ETO融合基因11.92%,TET2突变11.04%,WT1过表达10.6%。其他常见的包括:CEBPA双突变9.49%,DNMT3A突变9.49%,FLT3-ITD突变9.27%,ASXL1突变8.83%,其余的基因突变检出率在5%以下。
年龄>60岁组突变/融合基因检出的频率与年龄≤60岁的AML患者不同(图1)。年龄≤60岁组最常出现的是ETO(14.59%)、NPM1(13.07%)、WT1过表达(10.94%)、CEBPA双突变(10.64%)、TET2(10.63%)、FLT3-ITD(9.42%)、ASXL1(8.51%)、DNMT3A(7.29%),而年龄>60岁组常出现的是DNMT3A(15.32%)、NPM1(12.1%)、TET2(12.1%)、ASXL1(9.68%)、WT1过表达(9.68%)、FLT3-ITD(8.87%)、CEBPA双突变(6.45%)、IDH2(6.45%)。两组比较,年龄≤60岁组ETO阳性比例高于年龄>60岁组(14.59%比4.84%,P=0.02)。而后者发生DNMT3A和IDH突变比例较高,但差异无统计学意义(分别为15.32%比7.29%,P=0.07;8.87%比3.04%,P=0.08)。
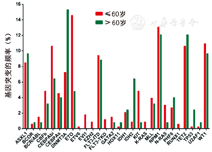

按照患者发病的年龄段做进一步分析,发现年龄越大,DNMT3A、ASXL1等与表观遗传修饰相关的基因突变发生的频率越高。50岁是年龄的分界点,>50岁的患者DNMT3A突变发生频率是≤50岁AML患者的3倍以上(13.99%比4.29%,P=0.017)。
按照患者染色体核型组进行分析。本研究中低危核型组患者共48例,均为AML1-ETO阳性(36例,75%)或CBFβ-MYH11阳性(12例,25%),该组患者其余基因突变的发生频率均低于10%。预后中等核型组患者299例,突变频率在10%以上的为NPM1 15.72%、CEBPAbi 11.37%、FLT3-ITD 10.37%、TET2 10.36%,WT1过表达者占11.37%;高危核型组共57例,突变发生频率在10%以上的有ASXL1 17.54%、TET2 14.04%、DNMT3A 14.04%、PHF6 12.28%。其中ASXL1和PHF6突变发生频率明显高于低危和中危核型组(表1)。
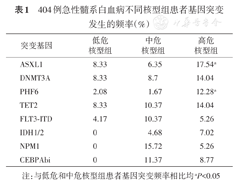
404例急性髓系白血病不同核型组患者基因突变发生的频率(%)
404例急性髓系白血病不同核型组患者基因突变发生的频率(%)
| 突变基因 | 低危核型组 | 中危核型组 | 高危核型组 |
|---|---|---|---|
| ASXL1 | 8.33 | 6.35 | 17.54a |
| DNMT3A | 8.33 | 8.7 | 14.04 |
| PHF6 | 2.08 | 1.67 | 12.28a |
| TET2 | 8.33 | 10.37 | 14.04 |
| FLT3-ITD | 4.17 | 10.37 | 5.26 |
| IDH1/2 | 0 | 4.68 | 7.02 |
| NPM1 | 0 | 15.72 | 5.26 |
| CEBPAbi | 0 | 11.37 | 8.77 |
注:与低危和中危核型组患者基因突变频率相比均aP<0.05
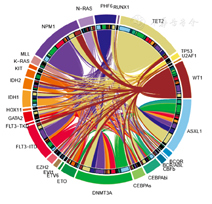
本研究中,29.1%(132/453)患者存在2个及以上的突变,其中51.5%(68/132)患者存在的突变达3个或更多。本研究中最常被检出的NPM1突变和RUNX1-ETO,不会同时表达于同一患者。而58例NPM1突变患者有20例(34.5%)同时存在FLT3-ITD突变,19例(32.8%)伴DNMT3A,13例(22.4%)伴TET2。其他突变共存的现象也很普遍,以ASXL1突变为例,存在该突变的患者共48例,其中有18例(37.5%)同时存在DNMT3A突变,24例(50%)伴TET2,10例(20.8%)伴PHF6。对DNMT3A突变而言,ASXL1、TET2、NPM1和FLT3-ITD是最常见的共存突变。TET2突变最常与ASXL1同时存在,其次是DNMT3A和NPM1(图2)。

本研究中,NK-AML患者共254例,114例(44.9%)未检测到本研究涉及的融合基因/突变,140例(55.1%)患者检测到融合基因/突变共291个。254例NK-AML患者经诱导化疗后,147例(57.87%)获CR,43例(16.93%)PR,48例(18.9%)NR,有2例未完成诱导化疗,14例化疗后30 d内死亡。按患者伴有突变的不同,比较了各组间的治疗反应率(表2)。伴CEBPA双等位基因突变患者的CR率明显高于其他组(P<0.01)。

伴不同突变基因的正常核型急性髓系白血病患者对诱导化疗的反应率
伴不同突变基因的正常核型急性髓系白血病患者对诱导化疗的反应率
| 基因突变/过表达 | 总例数 | 完全缓解(%) | 部分缓解(%) |
|---|---|---|---|
| NPM1突变 | 46 | 50 | 21.7 |
| CEBPA双突变 | 33 | 79 | 12.0 |
| FLT3-ITD突变 | 26 | 50 | 19.2 |
| 表观遗传修饰相关基因a突变 | 56 | 52 | 9.0 |
| WT1过表达 | 27 | 48 | 16.0 |
注:a指DNMT3A、ASXL1、TET2、IDH、EZH2
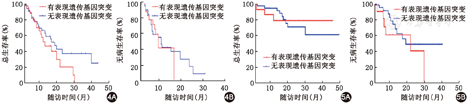
254例NK-AML中共有176例追踪了随访数据,中位随访时间10.8(0.3~47.0)个月。患者的中位OS为21个月,中位LFS为18个月。56例(56/254,22%)存在和表观遗传修饰相关的基因突变,包括ASXL1、IDH、DNMT3A、TET2、EZH2等。这组患者中位年龄53.8(20~73)岁。随访53例患者,中位OS 19个月,中位LFS 18.5个月。比较表观遗传修饰基因突变组和无此类基因突变患者的OS、LFS(图3),不伴相关基因突变患者的中位生存时间28个月,优于突变组的19个月,中位LFS差异无统计学意义。
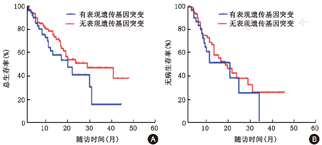

进一步分层分析,观察表观遗传修饰基因突变对不同年龄组患者预后的影响。>50岁且有表观遗传修饰基因突变的患者,其中位OS 12个月,中位LFS 10个月,而无相关基因突变的患者中位OS和LFS分别为18个月和12个月,前者预后较差(图4)。≤50岁的患者无论是否伴有表观遗传修饰基因突变,在随访期间均未达到中位OS,中位LFS分别为23个月和20个月,差异无统计学意义(图5)。

随着分子生物学水平研究的不断进步,对AML的认识也在逐步深入。基于染色体发生的断裂、易位、缺失、倒位、重复等异常,将患者进行危险度分层。而针对AML患者基因水平的研究则进一步发现了患者基因的改变或修饰,如:单核苷酸插入、甲基化、突变等,这些可能是急性白血病发生的关键机制[5],或将成为急性白血病的独立生物学标志并可作为新的治疗靶点[6]。2016年WHO对AML分类再次做了更新,NPM1、CEBPA、RUNX1等突变均已被纳入AML诊断参考,为AML做进一步的精细分层。本研究利用RT-PCR和NGS技术对AML(除外APL)患者初诊时的骨髓样本进行白血病融合基因检测和基因突变分析,报道了上海地区不同年龄组和不同染色体核型分组的患者情况,并与国内外中心的数据进行比较。
应用NGS技术探索AML患者基因突变谱的大样本研究数据有限,样本量较多的报道来自于欧洲的多中心数据[7],共纳入1 540例AML患者;美国癌症基因谱研究网络报道的病例数为200例[8];我国多个研究中心,包括上海交通大学医学院附属瑞金医院、浙江大学附属第一医院、苏州大学附属第一医院等也发表了各自的数据[9,10,11]。虽然各个中心检测的目标基因略有不同,但都基本覆盖了AML中常见的基因,包括FLT3、NPM1、DNMT3A、IDH、TET2、RUNX1、TP53、RAS、CEBPA、WT1、KIT、EZH2等。检测方法包括全基因组/全外显子测序、基因突变PANEL等。本研究共收集了453例AML患者资料,并剔除了临床预后相对良好的APL患者,应用白血病融合基因和髓系相关基因突变panel进行筛查,覆盖了AML中常见的突变。入组患者的中位年龄50(11~85)岁,年龄构成与其他中心数据接近。从遗传学特征看,高危组患者12%,低于美国的数据(高危核型组占22%)。从基因突变结果看,本研究中AML伴NPM1突变的患者占13%,与国内其他中心数据相似,但明显低于欧洲人群(28%)和美国人群(27%)。而RUNX1-ETO AML患者比例则远高于欧美(12%比4%)。产生这些差异的原因尚不明确,患者的种族、生活环境、生活方式等是否与此相关还期待更多的数据支持。
本研究中伴DNMT3A突变的患者占9%,国内其他中心的数据分别为:苏医一附院6%,瑞金和浙医一附院12.3%,均低于美国的多中心数据(26%)。研究证实,DNMT3A突变与诊断时的高白细胞、老年和不良预后有关[12]。而本研究对入组患者进行年龄分层后的数据也显示,50岁以上患者DNMT3A突变发生频率是50岁以下患者的3倍以上(13.99%比4.29%,P=0.017)。苏医一附院入组患者中位年龄42岁,而美国患者中位年龄55岁。各中心患者中位年龄的不同可能是造成数据差异的原因之一。
TP53突变在欧美AML患者中更多见,目前认为该突变与复杂核型有关且是独立的预后不良因素[13]。国内患者TP53突变比例不高,Yin等[11]报道,117例患者中仅1例NK-AML患者阳性(0.9%),而15例复杂核型的患者均未检出TP53突变。本研究中伴有TP53突变的4例患者,3例为正常核型,中位年龄63(59-85)岁,1例伴GATA2、TET2突变,1例伴IDH2、NPM1、WT1,1例伴ASXL1、EZH2、RUNX1。另1例TP53突变患者为复杂核型、83岁、伴TET2突变。本研究发现,这4例患者除了TP53突变外,都伴随了一些可能与不良预后相关的其他突变,如TET2、ASXL1、IDH2等[12,14,15,16]。这些突变"共存"是否决定了AML患者的临床转归仍待探索。
本研究还根据染色体核型的不同,分析了不同组别间AML相关基因突变的发生频率,发现不同核型组患者的突变基因存在差异。低危核型组患者中,基因突变的发生频率低。高危核型组患者中,ASXL1、TET2、DNMT3A、PHF6突变的发生频率较高,其中ASXL1和PHF6与其他组别比较差异有统计学意义。本研究中高危核型组患者的中位年龄为56.7岁,或许是该组患者表观遗传修饰基因突变发生率高的原因之一。
NK-AML约占AML患者的50%~60%,如何对这组患者进行危险度再分层是学者们研究的热点。本研究发现,正常染色体核型组以及其他中危核型组中,NPM1、TET2、FLT3-ITD、DNMT3A、ASXL1、CEBPA双等位基因突变等都有较高的发生频率。本研究数据显示,NK-AML中22%的患者存在有与表观遗传修饰相关的基因突变,该组患者中位OS为19个月,短于不伴表观遗传修饰基因突变者的28个月,而两组中位LFS差异无统计学意义。基于本研究结果,年龄>50岁的患者,与表观遗传修饰相关的基因突变比例即有明显升高。而本研究的患者中,存在表观遗传修饰基因突变的患者中位年龄54岁,而无表观遗传修饰基因突变组患者中位年龄49岁。患者的年龄分布也是造成两组间的生存差异的原因。本研究进一步分层分析,讨论表观遗传修饰基因突变对不同年龄组患者预后的影响。50岁以上且有表观遗传修饰基因突变的患者,其中位OS 12个月,中位LFS 10个月,而无相关基因突变的患者中位OS和LFS分别为18个月和12个月,前者预后较差。50岁以下的患者无论是否伴有表观遗传修饰基因突变,在随访期间均未达到中位OS,中位LFS分别为23个月和20个月,差异无统计学意义。提示>50岁的NK-AML患者,伴表观遗传修饰基因突变者总体生存时间短,预后较差,而该组基因突变对年轻NK-AML预后意义不大。从OS曲线趋势上看,似乎年轻且伴表观修饰基因突变的患者预后更好些,这组患者共15例,有12例患者尚同时伴NPM1、CEBPA突变以及CBFβ、ETO等融合基因,这些AML的预后良好因子是否共同参与影响了患者的生存,还期待更多的病例和更长的随访来验证。
对NK-AML患者而言,在没有更多遗传学证据的情况下,基因突变的发生可能会对患者的预后产生影响。根据突变情况将患者进行危险度再分层,将有助于指导我们制定个体化的治疗方案,同时也为患者后续的治疗选择提供依据,并可作为治疗后MRD监测参考[17]。也有学者提出,随着对白血病相关基因的深入研究,患者的危险分层也许会更依赖于基因突变/融合基因,而染色体核型分析在危险分层中的地位将被弱化。
NGS检测在AML患者中的应用还面临很多的挑战。研究发现,同一个AML患者常被检出多个突变或融合基因,数据的解读还需考虑基因之间所存在的复杂关系网络。国外学者报道,NPM1突变患者约75%伴有和DNA甲基化或羟甲基化基因突变(DNMT3A、IDH1、IDH2、TET2),40%伴有FLT3-ITD突变,20%伴NRAS突变[18]。CEBPA双突变常与GATA2、NRAS、WT1等相关,但一般不伴有FLT3-ITD突变[7]。国内学者的研究结果也发现了NPM1突变患者常伴有IDH突变[9]和DNMTA突变[19]。本研究的结果也显示了AML患者基因突变的复杂性。这些基因-基因之间的"互斥"或"共存"现象与急性白血病的发生和患者的临床特征以及预后之间是否相关,还需要进行更深入、更专业的分析和解读,才能更好地理解这些基因突变在AML患者中的作用,并有可能对AML进行更细化的分层。
所有作者均声明不存在利益冲突



























