
探索针对前列腺癌高危人群进行前列腺癌精准筛查的方法和意义。
2017年4月至2018年8月间,对来自上海13个社区服务站和上海、江苏3个筛查基地的2 159例高危男性进行了基于血清前列腺特异性抗原(PSA)检测的前列腺癌筛查。PSA ≥4.0 μg/L者建议行前列腺穿刺活检。收集流行病学相关资料,分析其与前列腺癌发病风险的相关性。
PSA异常者271例(12.6%),中位PSA值9.1 μg/L(4.0~25.0 μg/L)。其中57例PSA异常者接受了前列腺穿刺活检,穿刺意愿率为21.0%。34例经穿刺证实为前列腺癌,穿刺阳性率59.6%,总体前列腺癌检出率1.57%。来自于筛查基地和来自于社区服务站的两组人群PSA水平异常率和穿刺阳性率差异均无统计学意义(P=0.578和0.735)。PSA水平异常与高龄(OR:2.63;95%CI:1.84~3.75,P<0.001)和有前列腺炎病史(OR:2.02;95%CI:1.55~2.63,P<0.001)等因素有关,前列腺癌发病风险与高龄(OR:4.04;95%CI:1.71~9.59,P=0.002)、服用降脂药物有关(OR:3.09;95%CI:1.25~7.69,P=0.015)。随着年龄的增长,PSA水平异常和前列腺癌发生率都逐渐升高。
针对高危人群的前列腺癌精准筛查是可行且有效的。年龄和他汀类药物使用可能与中国人群前列腺癌发病风险增加相关。进一步推广在高危人群中的前列腺癌筛查将有望改善我国前列腺癌分期偏晚、总体预后差的现状。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着我国经济和人民生活水平的不断提高,人均寿命延长,前列腺癌发病率呈现逐年上升的趋势,业已成为影响我国中老年男性健康的首要问题。据2015年中国肿瘤年报数据显示,前列腺癌是我国男性癌症发病率升高的6种癌症之一,位居男性恶性肿瘤的第6位,据测算2015年我国新增前列腺癌患者数为6.03万人[1]。此外,我国初诊前列腺癌患者的临床分期与欧美国家相比具有显著差异[2]。以美国为例,在初诊前列腺癌患者中以临床局限性病例为主(81%),远处转移病例仅为4%[3]。而我国的多中心研究资料显示,仅1/3的初诊前列腺癌患者为临床局限性,多数患者就诊时已属于中晚期,导致我国前列腺癌患者的总体预后远远差于西方发达国家[2]。因此,对高危人群进行筛查、早期诊断和治疗是提高我国前列腺癌患者总体生存率最有效的手段。2017年中国抗癌协会泌尿男生殖系统肿瘤专业委员会前列腺癌学组发布了《前列腺癌筛查专家共识》[4]。本研究以该专家共识为原则,自2017年4月开始,采用社区服务站和筛查基地两种模式对高危人群开展前列腺癌精准筛查,现将初步结果报道如下。
筛查对象来自于上海市月浦社区、北新泾社区等13个社区服务站和复旦大学附属肿瘤医院、江苏省老年医院等3个筛查基地。前列腺癌筛查的人群:(1)身体状况良好,且预期寿命10年以上的男性;(2)血清前列腺特异性抗原(PSA)检测每2年进行1次,根据患者的年龄和身体状况决定PSA检测的终止时间;(3)高危人群包括:年龄>50岁的男性;年龄>45岁且有前列腺癌家族史的男性;年龄>40岁且基线PSA>1 μg/L的男性。
根据筛查对象来源分为社区服务站模式和筛查基地模式,以社区服务站模式为例,进行筛查前准备工作。
依托现有的预防保健科的家庭健康档案,在辖区男性中筛选高危人群;另一方面提前通过微信平台、传统媒体、小区宣传等途径宣传前列腺癌筛查相关知识,招募参与筛查的意向人群。
媒体宣传(报纸等)、医院平台宣传、自媒体宣传(微信、微博、微视频等)、小区布告栏、居委会宣传等。
(1)组成由医生、护士、检验和志愿者组成的筛查团队;(2)在约定的时间、地点由医生进行科普讲座,对筛查对象解释并签署知情同意书;(3)志愿者指导筛查对象填写前列腺癌发病风险流行病学问卷;(4)护士采集血样,检验技师处理后使用便携式PSA快速检测仪器现场检测PSA;(5)现场反馈PSA检测结果,医生指导筛查对象进一步诊治。
筛查基地模式中筛查对象的招募由基地负责,余流程基本相同。
采取基于血清PSA检测的筛查方法。采用天津中新科炬生物制药股份有限公司提供的微流控免疫荧光总PSA检测试剂盒及荧光免疫分析仪(FREND™ System,美国)配套使用,检测血清中PSA浓度。室温下取1 ml全血800 r/min离心5 min;取50 μl血清于PSA试剂盒上反应5 min;将试剂盒插入机器检测(约1 min)后读数。参考值范围0.10~25.00 μg/L。PSA异常的患者建议至泌尿肿瘤专科就诊,并行前列腺穿刺活检。
计数资料采用χ2检验。采用多元Logistic回归模型对可能的危险因素进行校正,计算比值比(OR)和95%可信区间(95%CI)来评估各种危险因素与PSA水平异常和前列腺发病风险的相关性。P<0.05为差异有统计学意义。所有统计分析使用SAS 9.1软件完成。
截止2018年8月,共有来自于上海市13个社区服务站和上海、江苏3个筛查基地的2 159例男性接受了筛查。总体中位年龄70.0岁(45~85岁),中位PSA值1.21 μg/L(0.01~25.0 μg/L)。其中PSA异常者271例(12.6%),中位PSA值9.1 μg/L(4.0~25.0 μg/L)。
57例PSA异常者接受了前列腺穿刺活检,穿刺意愿率为21.0%(57/271)。其中34例经穿刺证实为前列腺癌,穿刺阳性率59.6%。总体前列腺癌检出率1.57%(34/2 159),每检出1例前列腺癌需筛查人数为63.5。来自于筛查基地和来自于社区服务站的两组人群PSA水平异常率和穿刺阳性率差异均无统计学意义(表1)。
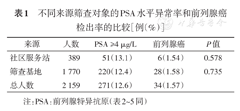
不同来源筛查对象的PSA水平异常率和前列腺癌检出率的比较[例(%)]
不同来源筛查对象的PSA水平异常率和前列腺癌检出率的比较[例(%)]
| 来源 | 人数 | PSA ≥4 μg/L | 前列腺癌 | P值 |
|---|---|---|---|---|
| 社区服务站 | 389 | 51(13.1) | 6(1.54) | 0.578 |
| 筛查基地 | 1 770 | 220(12.4) | 28(1.58) | 0.735 |
| 总人数 | 2 159 | 271(12.6) | 34(1.57) |
注:PSA:前列腺特异抗原(表2~5同)
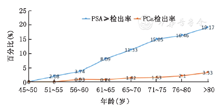
进一步分析危险因素与PSA水平异常以及前列腺癌发生的关系,3组人群之间年龄、降脂药物和前列腺炎病史等因素的分布差异有统计学意义(表2)。将这些危险因素进行多因素分析后发现,PSA水平异常与高龄和有前列腺炎病史等因素有关(表3),前列腺癌的发生与高龄、服用降脂药物有关(表4)。随着年龄的增高,PSA水平异常和前列腺癌发生率都逐渐升高(表5,图1)。
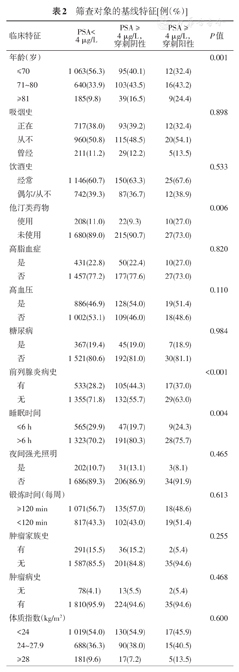
筛查对象的基线特征[例(%)]
筛查对象的基线特征[例(%)]
| 临床特征 | PSA<4 μg/L | PSA ≥4 μg/L,穿刺阴性 | PSA ≥4 μg/L,穿刺阳性 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | 0.001 | ||||
| ≤70 | 1 063(56.3) | 95(40.1) | 12(32.4) | ||
| 71~80 | 640(33.9) | 103(43.5) | 16(43.2) | ||
| ≥81 | 185(9.8) | 39(16.5) | 9(24.4) | ||
| 吸烟史 | 0.898 | ||||
| 正在 | 717(38.0) | 93(39.2) | 12(32.4) | ||
| 从不 | 960(50.8) | 115(48.5) | 20(54.1) | ||
| 曾经 | 211(11.2) | 29(12.2) | 5(13.5) | ||
| 饮酒史 | 0.533 | ||||
| 经常 | 1 146(60.7) | 150(63.3) | 25(67.6) | ||
| 偶尔/从不 | 742(39.3) | 87(36.7) | 12(38.9) | ||
| 他汀类药物 | 0.006 | ||||
| 使用 | 208(11.0) | 22(9.3) | 10(27.0) | ||
| 未使用 | 1 680(89.0) | 215(90.7) | 27(73.0) | ||
| 高脂血症 | 0.820 | ||||
| 是 | 431(22.8) | 50(22.4) | 10(27.0) | ||
| 否 | 1 457(77.2) | 177(77.6) | 27(73.0) | ||
| 高血压 | 0.110 | ||||
| 是 | 886(46.9) | 128(54.0) | 19(51.4) | ||
| 否 | 1 002(53.1) | 109(46.0) | 18(48.6) | ||
| 糖尿病 | 0.984 | ||||
| 是 | 367(19.4) | 45(19.0) | 7(18.9) | ||
| 否 | 1 521(80.6) | 192(81.0) | 30(81.1) | ||
| 前列腺炎病史 | <0.001 | ||||
| 有 | 533(28.2) | 105(44.3) | 17(37.0) | ||
| 无 | 1 355(71.8) | 132(55.7) | 29(63.0) | ||
| 睡眠时间 | 0.004 | ||||
| ≤6 h | 565(29.9) | 47(19.7) | 9(24.3) | ||
| >6 h | 1 323(70.2) | 191(80.3) | 28(75.7) | ||
| 夜间强光照明 | 0.465 | ||||
| 是 | 202(10.7) | 31(13.1) | 3(8.1) | ||
| 否 | 1 686(89.3) | 206(86.9) | 34(91.9) | ||
| 锻炼时间(每周) | 0.613 | ||||
| ≥120 min | 1 071(56.7) | 135(57.0) | 18(48.6) | ||
| <120 min | 817(43.3) | 102(43.0) | 19(51.4) | ||
| 肿瘤家族史 | 0.255 | ||||
| 有 | 291(15.5) | 36(15.2) | 2(5.4) | ||
| 无 | 1 587(85.5) | 201(84.8) | 35(94.6) | ||
| 肿瘤病史 | 0.468 | ||||
| 无 | 78(4.1) | 13(5.5) | 2(5.4) | ||
| 有 | 1 810(95.9) | 224(94.6) | 35(94.6) | ||
| 体质指数(kg/m2) | 0.600 | ||||
| <24 | 1 019(54.0) | 130(54.9) | 17(45.9) | ||
| 24~27.9 | 688(36.3) | 90(38.0) | 15(40.5) | ||
| ≥28 | 181(9.6) | 17(7.2) | 5(13.5) | ||
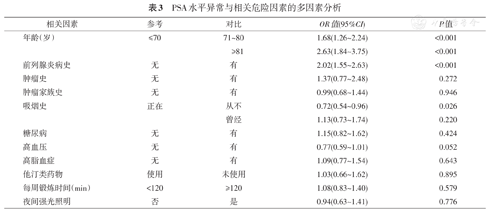
PSA水平异常与相关危险因素的多因素分析
PSA水平异常与相关危险因素的多因素分析
| 相关因素 | 参考 | 对比 | OR值(95%CI) | P值 |
|---|---|---|---|---|
| 年龄(岁) | ≤70 | 71~80 | 1.68(1.26~2.24) | <0.001 |
| ≥81 | 2.63(1.84~3.75) | <0.001 | ||
| 前列腺炎病史 | 无 | 有 | 2.02(1.55~2.63) | <0.001 |
| 肿瘤史 | 无 | 有 | 1.37(0.77~2.48) | 0.272 |
| 肿瘤家族史 | 无 | 有 | 0.99(0.68~1.44) | 0.946 |
| 吸烟史 | 正在 | 从不 | 0.72(0.54~0.96) | 0.026 |
| 曾经 | 1.13(0.73~1.74) | 0.220 | ||
| 糖尿病 | 无 | 有 | 1.15(0.82~1.62) | 0.424 |
| 高血压 | 无 | 有 | 0.77(0.59~1.01) | 0.052 |
| 高脂血症 | 无 | 有 | 1.09(0.77~1.54) | 0.643 |
| 他汀类药物 | 使用 | 未使用 | 1.03(0.66~1.62) | 0.895 |
| 每周锻炼时间(min) | <120 | ≥120 | 1.08(0.83~1.40) | 0.579 |
| 夜间强光照明 | 否 | 是 | 0.94(0.63~1.41) | 0.776 |
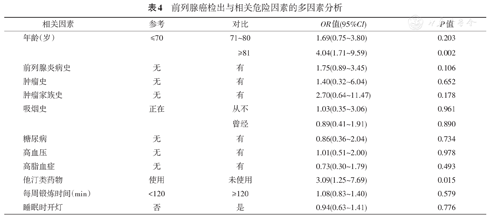
前列腺癌检出与相关危险因素的多因素分析
前列腺癌检出与相关危险因素的多因素分析
| 相关因素 | 参考 | 对比 | OR值(95%CI) | P值 |
|---|---|---|---|---|
| 年龄(岁) | ≤70 | 71~80 | 1.69(0.75~3.80) | 0.203 |
| ≥81 | 4.04(1.71~9.59) | 0.002 | ||
| 前列腺炎病史 | 无 | 有 | 1.75(0.89~3.45) | 0.106 |
| 肿瘤史 | 无 | 有 | 1.40(0.32~6.04) | 0.652 |
| 肿瘤家族史 | 无 | 有 | 2.70(0.64~11.47) | 0.178 |
| 吸烟史 | 正在 | 从不 | 1.03(0.35~3.06) | 0.961 |
| 曾经 | 0.89(0.41~1.91) | 0.890 | ||
| 糖尿病 | 无 | 有 | 0.86(0.36~2.04) | 0.734 |
| 高血压 | 无 | 有 | 1.01(0.51~2.00) | 0.978 |
| 高脂血症 | 无 | 有 | 0.73(0.30~1.79) | 0.493 |
| 他汀类药物 | 使用 | 未使用 | 3.09(1.25~7.69) | 0.015 |
| 每周锻炼时间(min) | <120 | ≥120 | 1.08(0.83~1.40) | 0.579 |
| 睡眠时开灯 | 否 | 是 | 0.94(0.63~1.41) | 0.776 |
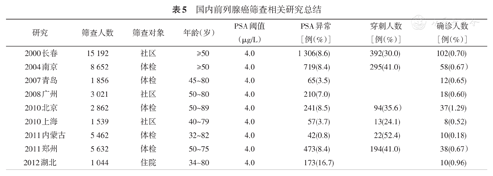
国内前列腺癌筛查相关研究总结
国内前列腺癌筛查相关研究总结
| 研究 | 筛查人数 | 筛查对象 | 年龄(岁) | PSA阈值(μg/L) | PSA异常[例(%)] | 穿刺人数[例(%)] | 确诊人数[例(%)] |
|---|---|---|---|---|---|---|---|
| 2000长春 | 15 192 | 社区 | ≥50 | 4.0 | 1 306(8.6) | 392(30.0) | 102(0.70) |
| 2004南京 | 8 652 | 体检 | ≥50 | 4.0 | 719(8.4) | 295(41.0) | 58(0.67) |
| 2007青岛 | 1 856 | 体检 | 45~80 | 4.0 | 65(3.5) | 12(0.65) | |
| 2008广州 | 3 021 | 社区 | 50~80 | 4.0 | 210(7.0) | 18(0.60) | |
| 2010北京 | 2 862 | 体检 | 50~89 | 4.0 | 241(8.5) | 94(35.6) | 37(1.29) |
| 2010上海 | 1 539 | 社区 | 40~79 | 4.0 | 57(3.7) | 13(24.1) | 8(0.52) |
| 2011内蒙古 | 5 462 | 体检 | 32~82 | 4.0 | 42(0.8) | 22(52.4) | 10(0.18) |
| 2011郑州 | 5 632 | 体检 | 50~75 | 4.0 | 473(8.4) | 194(41.0) | 38(0.67) |
| 2012湖北 | 1 044 | 住院 | 34~80 | 4.0 | 173(16.7) | 10(0.96) |

近年来,随着美国PLCO和欧洲ERSPC两项大型随机对照研究结果的公布,PSA筛查引起了一些争议。2014年,ERSPC公布了最新的随访数据,结果显示PSA筛查使前列腺癌死亡率降低了27%[5]。因此现阶段在无症状男性中有选择地进行PSA检测有助于降低前列腺癌特异性死亡率。通过恰当的临床决策,筛选出高危人群后,大量无谓的前列腺穿刺是可以避免的。2018年美国预防服务工作组也更新了推荐,建议55~69岁男性在充分知情后根据个体情况进行前列腺癌筛查[6]。
国内已有前列腺癌筛查的相关报道(表5),基于血清PSA检测是最常用的筛查手段,PSA≥4 μg/L定义为异常阈值具有较高的阳性预测值[7,8,9,10,11]。直肠指检对于早期前列腺癌的诊断价值低,尤其是作为筛查试验时的敏感度很不理想。此外,以直肠指检作为筛查手段需要医生的大量工作,难以应用于大规模人群的筛查。与出现临床症状而就诊患者相比,筛查检出的前列腺癌患者PSA水平更低(55.2%与22.4%,P<0.01),Gleason评分较低(<7:0.3%与34.1%,P<0.01),病变范围更为局限(7.9%与26.8%,P<0.01),得到根治性治疗的概率更高[11]。提示在我国人口中进行PSA筛检对于早期发现前列腺癌是有效的,前列腺癌筛查对早期诊断有重要意义。然而既往的筛查研究往往以体检或者社区人群为筛查人群,缺乏针对高危人群的精准筛查,存在过度诊断的可能。检测手段为常规检验科检测,用时较长,缺乏快速简便的筛查方式。以横断面研究为主,缺乏随访数据,无法系统评估发病率和死亡率。以回顾性分析为主,筛查设计存在固有缺陷,未形成可推广的筛查模式。
本次筛查的前列腺癌检出率低于PLCO(11.1%)和ERSPC研究(10.2%)的报道,原因一方面可能与种族和环境有关。前列腺癌的发病率有明显的地域和种族差异,黑人发病率最高,其次是白种人,亚洲人种发病率最低,提示遗传因素是前列腺癌发病的最重要因素之一[12]。流行病学资料显示亚洲裔人群移居美国后前列腺癌发病率会明显升高,证实地理环境及饮食习惯等外源性因素也影响前列腺癌的发病[12]。另一方面,本次筛查的穿刺意愿率也显著低于上述研究的报道,有接近80%的PSA异常患者未接受穿刺,因此本次筛查的前列腺癌检出率可能远远被低估。PSA异常率和前列腺癌检出率高于此前国内的研究,穿刺阳性率高于国内外相关研究报道,显示确认高危人群后进行筛查,筛查最有可能获益的群体,可以显著降低过度诊断的可能,达到精准筛查的目的。此外,社区来源与筛查基地来源的高危人群的PSA异常比例和前列腺癌检出率差异无统计学意义,提示这两种模式都是有效可行的。
本研究显示随着年龄和PSA水平异常与前列腺癌发生率呈现相关性。前列腺体积随着年龄增长而增大,50~80岁为快速生长期,导致分泌的PSA增加;高龄也是前列腺肿瘤发生的明确危险因素。从发病年龄来看,我国城市地区自60岁开始出现前列腺癌的发病高峰。他汀类药物与前列腺癌发病风险的研究结果尚无定论。一项病例对照研究显示服用他汀类药物可将前列腺癌发病风险降低6%(相对危险度0.94;95%CI:0.91~0.97),高级别前列腺癌发病风险降低20%(相对危险度0.8;95%CI 0.70~0.90)[13]。但也有一些研究结果表明服用他汀类药物后前列腺癌发病风险增加[14]。这可能是因为服用他汀类药物后总生存延长造成的幸存者偏差。更重要的是,服用他汀类药物者往往存在肥胖以及伴发的相关疾病如高血压、高脂血症和高血糖等代谢综合征状态。代谢综合征引起的胰岛素抵抗,可以调节前列腺癌细胞中的脂质和类固醇生成,类似于去雄激素抵抗前列腺癌(CRPC)细胞所展示的功能。高胆固醇血症可通过释放脂质炎症介质如二十烷酸、前列腺素和白三烯改变前列腺癌细胞的生物学行为。脂肪组织释放的炎症因子创造了缺氧环境,诱导环境能量改变,从而影响肿瘤细胞生物学行为[15]。
筛查在本阶段尚无长期随访的数据,穿刺意愿偏低,后续需要进一步观察和改进。总之,在《前列腺癌筛查专家共识》的指导下,本次筛查是国内首个针对前列腺癌高危人群筛查的务实探索。初步结果显示,采用社区服务站和筛查基地模式两种模式的前列腺癌精准筛查是可行且有效的,较以往研究显著提高了前列腺癌检出率,但本轮筛查的前列腺癌检出率可能远远被低估,实际前列腺癌检出率可能超过预期。年龄和他汀类药物使用可能与中国人群前列腺癌发病风险增加相关。进一步推广在高危人群中的前列腺癌筛查将有望改善我国前列腺癌分期偏晚、总体预后差的现状。
所有作者均声明不存在利益冲突



























