
观察盆腔肿瘤患者放疗后肠道菌群的变化,探讨放射性肠炎与肠道菌群的相关性及益生菌干预对肠道菌群及腹泻的影响。
选取2018年3月至11月南京医科大学附属苏州医院确诊的盆腔肿瘤患者22例,包括直肠癌5例、子宫颈癌15例及子宫内膜癌2例,子宫颈癌患者中5例在放疗同时使用益生菌干预。选取同期健康体检者10名作为对照组。患者放疗前后各收集一次粪便标本,运用16S rDNA检测粪便菌群,分析放疗对肠道菌群的影响。
健康对照组粪便标本中主要菌门为厚壁菌门(39.86%)、拟杆菌门(37.77%)、分类不明确菌门(15.96%)、变形菌门(5.03%),盆腔肿瘤患者粪便标本中主要菌门与健康对照组一致,但在丰度上有所区别。患者肠道菌群放疗前后存在差异,放疗后患者肠道菌群多样性、丰度下降,且腹泻严重患者下降幅度大。放疗后患者肠道菌群厚壁菌门/拟杆菌门丰度比下降。腹泻严重患者志贺菌属及梭杆菌属丰度在放疗后上升。口服益生菌可维持患者肠道菌群多样性和丰度稳定,减轻腹泻症状。
盆腔肿瘤患者放疗后肠道菌群多样性、丰度下降,尤其是腹泻严重患者,口服益生菌可减轻腹泻症状。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
放疗在肿瘤患者的治疗中发挥了越来越重要的作用,而放射性肠炎(RE)极大影响了患者的生命质量[1]。肠道菌群在RE的发展中起一定作用。在人体消化道内存在的细菌种类多达1 000余种[2]。饮食改变、肠道感染、抗生素的使用等会导致肠道菌群失调,促使消化道不良反应甚至恶性肿瘤的发生。近年来,菌群失调与糖尿病、自身免疫病、肥胖和精神疾病的关系也有报道[3,4,5,6,7],而对放疗引起的RE中肠道菌群的变化及作用机制的研究较少。本研究分析了放疗对肠道菌群的影响,及益生菌干预对症状的影响,可能为RE患者的预防和治疗提供新的思路。
选取2018年3月至11月在南京医科大学附属苏州医院行调强放疗的盆腔肿瘤患者37例,其中15例因在放疗过程中使用抗生素等原因被排除,最终纳入直肠癌5例、子宫颈癌15例及子宫内膜癌2例;选取同期10名健康体检者作为对照组。所有患者均第1次接受放疗,剂量为1.8~2.0 Gy/d,5次/周(总剂量45~50 Gy)。其中5例子宫颈癌患者在放疗同时给予双歧杆菌乳杆菌三联活菌片(金双歧,规格0.5 g/片,国药准字:S19980004,呼和浩特双奇药业有限公司)口服,2 g/次,3次/d。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。
收集患者放疗前后清晨粪便各1次,收集体检者清晨粪便1次。留取粪便标本1~2 g,使用专用保存管并置于-80 ℃冰箱保存。
ZR Fecal DNA MiniPre购自美国Zymo Research公司,Qubit dsDNA HS分析试剂盒、Invitrogen Platinum Multiplex PCR Master Mix购自美国Thermo Fisher Scientific公司,16S Primer Mix-FLK(V3-V4 region)购自苏州艾达康医疗科技有限公司,MiSeq Reagent Kit v3(600-cycle)购自美国Illumina公司。
充分涡旋混匀保存液处理的粪便样品,转移至试管中,加入600 μl Lysis solution,用涡旋仪最大涡旋速率涡旋5 min。将试管置于离心机内,17 000×g离心1 min。将Zymo-Spin Ⅳ Spin Filter置于2 ml离心管上,并向其中转移500 μl试管中的上清液,7 000×g离心1 min,然后加入1 500 μl的Fecal DNA Binding Buffer,充分混匀并瞬时离心。转移800 μl混合液至Zymo-Spin ⅡC柱子中,10 000×g离心1 min。转移柱子至2 ml收集管中,重复上述步骤,直至所有混合液全部通过柱子。转移柱子至2 ml收集管中,向Zymo-Spin ⅡC柱子中加入200 μl的DNA Pre-Wash Buffer,10 000×g离心1 min。向Zymo-Spin ⅡC柱子中加入500 μl的Fecal DNA Wash Buffer,10 000×g离心1 min。转移Zymo-Spin ⅡC柱子至2 ml收集管中,10 000×g离心3 min。转移Zymo-Spin ⅡC柱子至1.5 ml收集管中,向其中加入50 μl的DNA Elution Buffer,室温培养5 min,10 000×g离心1 min。打开Zymo-Spin ⅡC柱子,将离心管中液体吸出,并加入柱子中,室温培养5 min,10 000×g离心1 min。将Zymo-Spin Ⅳ-HRC Spin Filters折断底部,匹配在收集管上,8 000×g离心3 min。将洗脱下的DNA转移至Zymo-Spin Ⅳ-HRC Spin Filter,下接洁净的1.5 ml离心管,8 000×g离心1 min,收集到的洗脱液中即包含DNA。采用Qubit dsDNA HS分析试剂盒测定DNA浓度。
灭菌消毒后文库制备。聚合酶链反应(PCR)扩增后吸取5 μl PCR产物,在1.0%的琼脂糖凝胶上行凝胶电泳,120 V电压,电泳20 min(凝胶电泳条带应在550 bp左右),再行文库纯化。
瞬时离心PCR管,将PCR产物转移至1.5 ml离心管中,每管加入60 μl(0.8×)Ampure XP beads,用移液器吸打混匀10次。室温培养5 min,置于磁力架上培养2 min(或直至上清变得澄清)。保持离心管处于磁力架上,转移上清至新的1.5 ml离心管中,每管加入60 μl(0.8×)Ampure XP beads,用移液器吸打混匀10次,室温培养5 min,置磁力架上,培养2 min(或直至上清变澄清)。保持离心管处于磁力架上,用移液器移去上清,保留沉淀。于磁力架上向每管中加入200 μl新配置的80%乙醇溶液(不要使沉淀悬浮),在磁力架上培养30 s,小心移走上清。重复上述步骤一次。用10 μl移液器去除多余液体。离心管置于磁力架上,打开管盖,沉淀风干3 min以去除残留乙醇。向每管中加入50 μl Buffer EB,拿下离心管,移液器吸打混匀10次,室温培养2 min。离心管置于磁力架上,培养3 min,至溶液澄清,吸取上清液到新离心管中,即得到收集好的文库。
测序试剂盒准备,待测序文库变性和稀释后加入样品文库到测序试剂盒。MiSeq上机操作,确认无误后开始运行测序。
对原始数据行过滤处理,进一步去除嵌合体序列,得到有效序列后,进行聚类分析,把每一个聚类归为一个物种操作单元(OTU)。将OTU和数据库进行比对,得到各样本菌落信息。基于OTU分析结果,运用Vsearch(1.9.6)及Qiime(1.9.1)等分析软件对样本行α多样性指数等分析,得到菌群丰度和多样性等信息;基于分类学信息在各个水平对样本进行群落结构分析。
群落生态学中,α多样性主要关注单样本的多样性分析,可以反映微生物群落中物种的数目,采用ACE及Chao1指数反映菌群丰度,Shannon指数反映菌群多样性,这3个指数和样品的菌群丰度及多样性呈正相关。
患者在放疗持续2~3周及结束时各完成一份问卷,统计腹泻次数,确定RE严重程度。根据通用不良事件术语标准(CTCAE 5.0)将腹泻等级分为5级:1级,与基线相比每天大便增加<4次;2级,与基线相比每天大便增加4~6次;3级,与基线相比每天大便增加≥7次;4级,危及生命;5级,死亡。
采用SPSS 25.0统计软件分析数据。计量资料符合正态分布,用均数±标准差( ±s)表示,组间比较用配对或非配对t检验;计数资料比较用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
±s)表示,组间比较用配对或非配对t检验;计数资料比较用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
肿瘤患者组22例中,男性4例,女性18例,年龄(58±12)岁,体质量指数(BMI)(23.1±2.7)kg/m2;健康对照组10名中,男性2名,女性8名,年龄(55±12)岁,BMI(23.5±2.4)kg/m2。两组年龄、性别和BMI等一般情况比较,差异均无统计学意义(均P>0.05),具有可比性。
22例患者放疗后,采用金双歧治疗组腹泻等级2级发生率为0(0/5),低于未用金双歧治疗组的58.8%(10/17),差异有统计学意义(χ2=5.392,P=0.02)。
将子宫肿瘤组中腹泻等级1级的6例患者分入腹泻症状轻组,腹泻等级2级的6例患者分入腹泻症状重组,行后续分析。
与放疗前相比,放疗后患者肠道菌群丰度及多样性指数均下降,与健康对照组相比差异均有统计学意义(均P<0.05)(图1)。放疗前直肠癌组和腹泻症状重组肠道菌群的丰度及多样性指数均比健康对照组低,差异均有统计学意义(ACE指数:直肠癌组t=2.458,P=0.029;腹泻症状重组t=3.682,P=0.002。Chao1指数:直肠癌组t=2.386,P=0.033;腹泻症状重组t=3.711,P=0.002),放疗前腹泻症状轻组和金双歧治疗组与健康对照组比较,差异均无统计学意义(均P>0.05)(表1),提示ACE、Chao1和Shannon指数可能预测患者放疗后腹泻严重程度。放疗后金双歧治疗组ACE指数升高,放疗前后Chao1和Shannon指数无明显差异,提示服用金双歧可减少放疗后肠道菌群的丰度及多样性下降幅度,患者腹泻症状减轻可能与此相关。
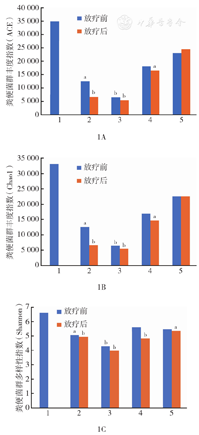

注:1为对照组;2为直肠癌组;3为腹泻症状重组;4为腹泻症状轻组;5为金双歧治疗组;与健康对照组比较,aP<0.05,bP<0.01
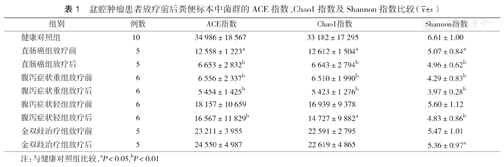
盆腔肿瘤患者放疗前后粪便标本中菌群的ACE指数、Chao1指数及Shannon指数比较( ±s)
±s)
盆腔肿瘤患者放疗前后粪便标本中菌群的ACE指数、Chao1指数及Shannon指数比较( ±s)
±s)
| 组别 | 例数 | ACE指数 | Chao1指数 | Shannon指数 |
|---|---|---|---|---|
| 健康对照组 | 10 | 34 986±18 567 | 33 182±17 295 | 6.61±1.00 |
| 直肠癌组放疗前 | 5 | 12 558±1 223a | 12 612±1 504a | 5.07±0.84a |
| 直肠癌组放疗后 | 5 | 6 653±2 832b | 6 643±2 794b | 4.96±0.62b |
| 腹泻症状重组放疗前 | 6 | 6 556±2 337b | 6 510±1 990b | 4.29±0.83b |
| 腹泻症状重组放疗后 | 6 | 5 454±1 425b | 5 423±1 276b | 3.97±0.28b |
| 腹泻症状轻组放疗前 | 6 | 18 157±10 659 | 16 939±9 378 | 5.60±1.12 |
| 腹泻症状轻组放疗后 | 6 | 16 567±11 829b | 14 727±9 882a | 4.83±0.86b |
| 金双歧治疗组放疗前 | 5 | 23 211±3 955 | 22 591±2 795 | 5.47±1.01 |
| 金双歧治疗组放疗后 | 5 | 24 550±4 987 | 22 619±4 865 | 5.36±0.97a |
注:与健康对照组比较,aP<0.05,bP<0.01
健康对照组粪便标本中主要菌门为厚壁菌门(39.86%)、拟杆菌门(37.77%)、分类不明确菌门(15.96%)、变形菌门(5.03%),盆腔肿瘤患者粪便标本中主要菌门与健康对照组一致,但在丰度上有所区别。放疗后患者粪便菌门中厚壁菌门丰度减少,拟杆菌门丰度增加。健康对照组厚壁菌门/拟杆菌门丰度比值为1.06,放疗后腹泻症状轻组由1.94下降为0.76,金双歧治疗组由1.32下降为0.44,直肠癌组由0.83下降为0.54,腹泻症状重组由0.63下降为0.54。放疗前直肠癌组和症状重组的厚壁菌门/拟杆菌门丰度比<1,此两组患者腹泻均较严重,提示厚壁菌门/拟杆菌门丰度比值可能预测放疗后腹泻严重程度。直肠癌组和腹泻症状重组放疗后变形菌门与放疗前丰度比为1.73和1.31,腹泻症状轻组及金双歧治疗组为0.95和0.53,表明腹泻严重患者放疗过程中变形菌门丰度升高;其他菌门丰度在放疗前后呈现不一致的增加或减少变化(图2)。提示患者放疗后的肠道菌群在菌门水平上与放疗前不同。
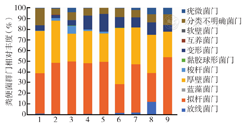

注:1为健康对照组;2为直肠癌组放疗前;3为直肠癌组放疗后;4为腹泻症状重组放疗前;5为腹泻症状重组放疗后;6为腹泻症状轻组放疗前;7为腹泻症状轻组放疗后;8为金双歧治疗组放疗前;9为金双歧治疗组放疗后
健康对照组粪便标本中主要菌属为拟杆菌属、分类不明确菌属及粪杆菌属。直肠癌组普雷沃菌属及副杆菌属丰度较高,腹泻症状重组普雷沃菌属及萨特菌属丰度较高,腹泻症状轻组副杆菌属丰度较高,金双歧治疗组副杆菌属菌属及阿克曼菌属丰度较高。
志贺菌属丰度放疗后与放疗前的比值在直肠癌组为3.24,腹泻症状重组为7.98,腹泻症状轻组为1.19,金双歧治疗组为1.27,提示放疗后腹泻严重患者的志贺菌属丰度大幅上升。直肠癌组及腹泻症状重组梭杆菌属丰度高于其余各组,放疗后进一步升高。志贺菌属及梭杆菌属均为病原菌,其丰度上升可能导致患者腹泻次数增加(图3)。
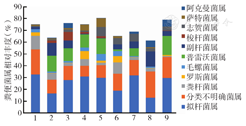

注:1为健康对照组;2为直肠癌组放疗前;3为直肠癌组放疗后;4为腹泻症状重组放疗前;5为腹泻症状重组放疗后;6为腹泻症状轻组放疗前;7为腹泻症状轻组放疗后;8为金双歧治疗组放疗前;9为金双歧治疗组放疗后
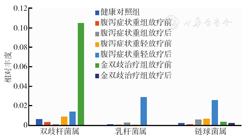
本研究所用金双歧中所含菌种属于双歧杆菌属、乳杆菌属和链球菌属,但与放疗前相比,金双歧组这3种菌属放疗后下降,而症状轻组这3种菌属放疗后上升(图4)。金双歧未对患者肠道菌群产生预期效果,可能原因是例数过少造成误差,或是患者放疗期间未足量服用金双歧。

人体肠道细菌的数量约为体细胞的10倍,可分为共生型细菌、条件致病菌及病原菌3种[8,9,10]。大多数研究者认为梭杆菌属是病原菌,且梭杆菌属与炎性肠病密切相关[11,12]。健康人群肠道菌群在菌门水平最常见的是厚壁菌门、拟杆菌门、放线菌门及变形菌门,其他菌门所占比例相对较小[13,14]。虽然最常见的菌门种类是相同的,但每个人的肠道菌群都是各种细菌种类和菌株的独特组合。一项研究表明,超过20%的肠道菌群组成改变与饮食、药物等因素有关,而宿主基因在这方面反而起着次要作用,或许能通过改变环境和饮食来影响肠道菌群[15]。与不肥胖人群相比,肥胖人群肠道菌群多样性低,在菌门水平上肥胖人群厚壁菌门丰度高,而拟杆菌门丰度低。在健康个体中有3种肠型,分别以3种菌属之一为主:肠型1富含拟杆菌属,肠型2富含普氏菌属,肠型3富含疣微菌属,但这种分类有一定争议。且研究发现肠型分布与性别、年龄、体质量指数甚至国籍无显著相关性[14]。
研究表明,放疗会导致机体肠道菌群发生显著变化[16],可能有某些特定菌群与癌症患者放疗后发生腹泻的风险相关。由于每个人肠道菌群都有所不同,机体与环境因素之间复杂的相互作用,目前尚无准确结论。Nam等[17]选取9例妇科肿瘤放疗患者,将患者放疗过程中不同时间段的肠道菌群与6名健康受试者进行比较,发现癌症患者放疗前肠道菌群与对照组相比,丰度最大的几个菌门是相同的,但每个菌门丰度明显不同。癌症患者的放线菌门丰度是对照组的30倍,而癌症患者的拟杆菌门、梭杆菌门和变形杆菌门丰度相对较低。放疗后患者拟杆菌门丰度下降10%,梭杆菌门丰度增加3%。Wang等[18]选取11例盆腔放疗患者,根据患者放疗后有无腹泻,将患者分为腹泻组和非腹泻组,结果显示腹泻组和非腹泻组的肠道菌群多样性均降低,且腹泻组降低更明显,放疗后厚壁菌门/拟杆菌门丰度比均与放疗前有差异,腹泻组差异更为明显。腹泻组与非腹泻组相比,放疗前肠道菌群即存在差异,腹泻组放疗前拟杆菌属、小杆菌属、韦荣球菌属丰度大,而梭菌属、粪杆菌属、普氏菌属丰度小。这些研究为放疗引起的肠道菌群变化与放疗后腹泻的相关性提供了重要证据,但未阐明肠道菌群与RE的机制关系,也未通过肠镜等方式对RE进行确诊。且这些研究样本量过小,需更大规模研究来进一步验证。近年来,有小鼠实验证明放疗会导致小鼠肠道菌群失调,并探讨肠道菌群和RE的关系及其可能机制,但没有完全明确,需要更多研究来推动RE的预防和治疗。
肠道菌群变化可能是肠道炎症的原因,有研究显示受到射线辐射后无菌小鼠比普通小鼠的肠炎症状轻[19]。Gerassy-Vainberg等[20]研究表明,肠道菌群在辐射诱导的改变中具有潜在致病作用。在此研究中,小鼠被暴露于局部的内部辐射,并发生RE,导致其肠道菌群发生显著变化。将放射性直肠炎小鼠与对照组小鼠粪便细菌悬液分别口服给药至无菌小鼠,将无菌小鼠暴露在辐射下。结果接受来自RE小鼠粪便细菌悬液的无菌小鼠肠道损伤更严重。这一发现为辐射引起的肠道菌群失调加重肠道损伤提供了证据。
迄今为止,对肠道菌群影响肠道生理功能已提出了许多不同机制。肠道菌群可降解多糖,合成维生素,通过发酵生成丁酸、丙酸等短链脂肪酸,而短链脂肪酸是结肠上皮细胞等的重要能量来源。在黏膜免疫中肠道菌群也有一定地位,肠道菌群通过与病原菌争夺营养物质来抑制病原菌增殖。有研究表明,无菌动物的黏膜免疫存在明显缺陷,证明了肠道菌群的重要性[21]。有研究报道了肠道菌群对于肠道运动也有重要作用[22]。在小鼠中,脂多糖(革兰阴性菌外膜的组成部分)在受辐射小鼠中可能起着放射性保护剂的作用[23,24]。
益生菌为对宿主有益的活性微生物,能改善宿主微生态平衡、发挥有益作用[25]。有实验表明益生菌可在艰难梭菌感染、严重坏死性小肠结肠炎的预防中发挥作用[26,27]。早在1988年就有报道益生菌对改善放疗后胃肠道不良反应有益[28]。有研究显示以乳酸菌为基础的益生菌在预防放疗引起的急性腹泻方面有益[29]。但由于患者癌种不同、放疗方式不同及化疗的使用,益生菌预防放疗后腹泻的益处尚有争议[30,31]。益生菌发挥其有益作用的潜在机制可能包括抑制炎症通路,维持肠道通透性和黏液分泌,防止细胞凋亡和氧化损伤,及通过重建肠道菌群来预防病原菌定植[32]。益生菌也可能通过激活Toll样受体对辐射损伤起到预防作用。复方CBLB502(entolimod)是TLR5配体,在受辐射前注射复方CBLB502已被证明可降低小鼠和灵长类动物肠道隐窝细胞及固有层细胞的凋亡率[33]。若能明确益生菌预防放疗后胃肠道不良反应的机制,则可开展更有针对性的研究。随着运用益生菌预防放疗损伤研究的升温,将可能利用肠道菌群对某些疾病进行治疗或预防。
本研究的不足之处在于样本数少,不能排除偏倚,且有其他可能的混淆因素,如饮食、既往手术治疗、个体差异等。16S rDNA测序不能识别所有细菌,也存在一定局限性。有必要继续开展大样本、多中心、多种分组、多阶段的研究,进一步探索RE患者肠道菌群改变。
所有作者均声明不存在利益冲突



























