
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨髓增生异常综合征(MDS)是一种高度异质性的髓系肿瘤。近年来随着高通量测序技术的应用,对MDS遗传本质的了解也逐渐加深。目前,50%~80%的MDS患者中存在至少一种突变[1,2],其中如TP53、SF3B1等已有明确独立预后价值的异常基因,可用于疾病的诊疗和预后评估[3,4]。然而,绝大部分基因突变临床价值尚未明确,但是基因突变位点的等位基因频率(VAF)可以提供克隆多样性的线索[5]。本研究中,我们根据165例MDS患者的二代测序数据,对基因突变位点VAF进行分析,结合临床信息,进一步评估MDS克隆多样性特点,并总结其与预后的关系。
以2016年1月至2018年12月于河南省肿瘤医院血液科就诊的165例MDS患者为研究对象,其中男85例,女80例,中位年龄54(12~87)岁。诊断符合"骨髓增生异常综合征中国诊断与治疗指南(2019年版)"[6],其中MDS伴单系血细胞发育异常(MDS-SLD)20例(12%),MDS伴多系血细胞发育异常(MDS-MLD)48例(29%),MDS伴环状铁粒幼细胞(MDS-RS)10例(6%),MDS伴单纯del(5q)1例(1%),MDS伴原始细胞增多(MDS-EB)79例[MDS-EB-1 45例(27%),MDS-EB-2 34例(21%)],MDS不能分类(MDS-U)7例(4%)。
初诊时采集患者骨髓,EDTA抗凝,采用天根生化科技(北京)有限公司血液基因组DNA提取试剂盒提取DNA,经微量分光光度计NanoDrop 2000定量,用于后续检测。
使用PCR引物扩增目的基因热点区域(65种MDS相关基因),采用Ion Torrent PGM测序平台进行测序。测序后数据利用人基因组数据库(HG19),COSMIC、1000 genomes和dbSNP等数据库进行分析。平均基因覆盖率大于99%,平均测序深度为1 500×,目标区域测序深度超过500×,检测灵敏度5%。
通过基因突变位点的VAF值判断克隆属性,不同基因突变位点的VAF差异>10%,标记为不同克隆。反之,VAF差异≤10%,标记为同一克隆。
骨髓细胞经过24 h培养,收集细胞制片,采用常规R显带技术进行核型分析,根据《人类细胞遗传学国际命名体制(ISCN2013)》进行描述。
139例患者于我院进行治疗,结合IPSS-R预后分层、年龄、依从性等进行综合评价,选择治疗方案。其中,单纯支持治疗22例(16%),免疫调节剂或抑制剂治疗43例(31%),去甲基化药物治疗20例(14%),化疗39例(28%),中药治疗1例(1%),造血干细胞移植14例(10%)。
对139例接受治疗的患者进行随访,随访截止日期为2018年12月31日。随访资料来源于住院病历,对随访期间死亡的病例,依病历记录或电话随访确认。失访33例(24%),中位随访时间8.5(1~36)个月。总生存(OS)期按确诊至死亡的时间或随访截止日期计算。无进展生存(PFS)期为确诊至疾病进展、复发或死亡的时间。
采用SPSS 20.0软件进行统计分析。数据用均值或中位数描述,不同组间分类资料的比较采用χ2检验或Fisher精确检验,多样本定量资料的比较采用方差分析。生存分析采用Kaplan-Meier法,并采用Log-rank检验进行单因素分析。P<0.05为差异有统计学意义。
165例MDS患者中,HGB中位数为73(18~175)g/L,ANC中位数为1.1(0.1~7.1)×109/L,PLT中位数为60(3~583)×109/L。其中,152例患者诊断时具有可供分析的染色体核型结果,其中染色体核型正常93例(61%),异常59例(39%)。IPSS-R预后分组:极低危组16例(11%)、低危组54例(36%)、中危组41例(27%)、高危组26例(17%)、极高危组15例(10%)。
128例(78%)MDS患者中检出52种异常基因,包含177个突变位点。其中,52例(32%)患者携带1个突变,41例(25%)携带2个突变,18例(11%)携带3个突变,17例(10%)携带4个及以上突变。根据检出突变基因功能分类:主要为转录调节相关基因(占45%,包括BCOR、CALR、CEBPA、CREBBP、EP300、ETV6、GATA2、IKZF1、PHF6、PML、RUNX1和WT1)、表观遗传相关基因(占41%,包括ASXL1、ATRX、DNMT3A、EZH2、IDH1/2、SETBP1和TET2)、剪切子相关基因(占38%,包括SF3B1、SRSF2、U2AF1和ZRSR2)、信号传导相关基因(占34%,包括CBL、CDKN2A、CSF1R、CSF3R、FLT3、JAK1/2、KIT、KRAS、NOTCH1/2、NRAS、PTPN11、ROBO2和SH2B3)、细胞增殖或凋亡相关基因(占18%,包括BCL2、MPL、NPM1、TNFAIP3、TP53和TTN)(图1)。
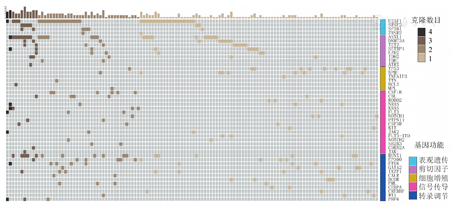

根据基因突变信息进行克隆数分析,37例(22%)患者未检出克隆存在,83例(50%)患者携带1个克隆,35例(21%)携带2个克隆,8例(6%)携带3个克隆,2例(1%)携带4个及以上克隆。MDS患者突变数和克隆数分布,差异有统计学意义(χ2=23.28,P<0.001)。
检出的MDS相关突变基因中,突变频率最高的为U2AF1(38例,23%),其他突变检出率高于5%的依次为ASXL1(25例,15%)、RUNX1(17例,10%)、TP53(12例,7%)、EP300(10例,6%)、TET2(10例,6%)、NPM1(10例,6%)、ETV6(9例,6%)、DNMT3A(9例,6%)。携带上述突变基因的MDS患者中,67例(48%)伴随2个及以上克隆,其中ASXL1(15例,60%)、RUNX1(11例,65%)和EP300(7例,70%)突变阳性的MDS患者携带2个及以上克隆的比例较高,而TP53(2例,17%)和NPM1(1例,10%)突变阳性的患者所含克隆个数较少。
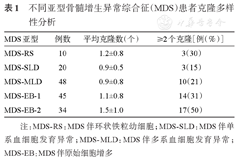
不同MDS亚型的平均克隆数及含有≥2个克隆的比例见表1,不同亚型之间差异有统计学意义,MDS-EB-2型患者平均克隆数最高,≥2个克隆所占比例也最高。克隆多样性与核型的关系显示,异常核型与正常核型患者间,克隆个数未见显著差异。依据IPSS-R染色体核型标准,152例有核型信息的患者中,极好核型3例(2%),好核型99例(65%),中等核型36例(24%),差核型6例(4%),极差核型8例(5%)。
不同亚型骨髓增生异常综合征(MDS)患者克隆多样性分析
不同亚型骨髓增生异常综合征(MDS)患者克隆多样性分析
| MDS亚型 | 例数 | 平均克隆数(个) | ≥2个克隆[例(%)] |
|---|---|---|---|
| MDS-RS | 10 | 1.2±0.8 | 3(30) |
| MDS-SLD | 20 | 0.9±0.5 | 3(15) |
| MDS-MLD | 48 | 0.9±0.8 | 10(21) |
| MDS-EB-1 | 45 | 1.1±0.8 | 14(31) |
| MDS-EB-2 | 34 | 1.5±1.0 | 17(50) |
注:MDS-RS:MDS伴环状铁粒幼细胞;MDS-SLD:MDS伴单系血细胞发育异常;MDS-MLD:MDS伴多系血细胞发育异常;MDS-EB:MDS伴原始细胞增多
纳入预后分析的106例患者中,依据克隆数目,将MDS患者分为未检出克隆23例,1个克隆53例,2个克隆23例,≥3个克隆7例,其OS期分别为30.2(95%CI 28.8~31.6)、25.6(95%CI 22.7~28.5)、28.1(95%CI 20.2~35.9)、29(95%CI 25.1~32.9)个月(χ2=2.551,P=0.466)(图2A)。而PFS期分别为29(95%CI 25.8~32.2)、23.2(95%CI 20.6~25.7)、22.1(95%CI 16.3~27.9)、6.3(95%CI 4.8~7.8)个月(χ2=12.621,P=0.006),其中携带3个及以上克隆组PFS期显著缩短(图2B)。
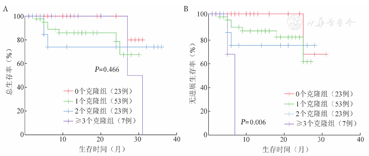

根据携带不同克隆数目进行分组,分为0个克隆组,1个克隆组,2个克隆组和≥3个克隆组
2013年Papaemmanuil等[7]发现,驱动基因突变数目的增加与MDS患者的无疾病生存时间缩短密切相关。国内李冰等[2]也报道基因突变数目多的患者OS较差。但在高通量测序的检测结果中,不同的基因突变位点的VAF值可能差异较大。Walter等[1]通过对157例MDS和继发急性髓系白血病患者进行高通量测序,发现基因突变位点的VAF值存在高度差异性,提示存在克隆多样性[1]。Papaemmanuil等[7]也报道,MDS患者中检出的多个基因突变可能位于同一主克隆,也可能位于不同的主克隆和亚克隆。本研究我们通过对165例MDS患者高通量测序数据进行分析,发现MDS患者中突变数和克隆数分布存在显著差异,患者所携带的多个基因突变可能存在于单一克隆,也可能存在于多个克隆。与上述研究结果一致,也进一步证实了MDS的发生是一个多步打击的过程,克隆异质性是其发生和发展的驱动机制,而这些克隆的增殖、自我更新、分化以及对治疗的反应直接导致了疾病的发生和进展[8,9]。
本研究我们发现克隆多样性所伴随的异常基因也存在差异,在突变频率高于5%的基因中,RUNX1、EP300和ASXL1伴随克隆多样性比例较高,而TP53和NPM1常伴随单个克隆存在。RUNX1、EP300和ASXL1分属转录调控和表观遗传学修饰相关基因,主要发挥转录调节、组蛋白修饰、造血细胞分化等功能[10,11,12]。MDS前驱疾病潜质未定的克隆性造血中常伴有一些表观遗传学修饰相关基因,属于MDS多步打击过程中的早期分子学事件,如:DNMT3A、SF3B1、SETBP1、FAT1、CREBBP和TET2等[13,14]。而与此相关的NRAS、KRAS、FLT3、TP53和NPM1等,可能与MDS或白血病转化的关系更加密切,属于晚期分子学事件,其作用可加剧、加速克隆的恶性演变[15,16]。结合上述研究,本研究结果提示,转录调控和表观遗传学修饰等基因异常在疾病早期出现,可能会造成个体基因转录调控的不稳定性,易伴随多个基因异常,导致克隆多样性。但其异常基因个体与克隆多样性的关系,还需进一步研究。
基因突变的克隆多样性与MDS分型关系的研究发现,MDS-EB-1型和MDS-EB-2型所携带的克隆数较多。以往研究也证实,基因突变数目随疾病演进不断增多,符合克隆异质性驱动疾病的发生和进展[2]。而与染色体核型间的关系研究发现,异常染色体核型与正常染色体核型患者含≥2个克隆比例差异无统计学意义。这与王凯等[17]研究相近,异常染色体核型的MDS患者基因突变数目与正常染色体核型患者无明显差异。本研究结果提示,染色体的不稳定可能是导致克隆多样性的因素之一。
既往研究证实基因突变数目与预后相关,突变数目越多提示预后越差[2,7]。本组病例中携带≥3个克隆的患者PFS期显著缩短。由于本研究最长随访时间仅为36个月,且≥3个克隆的样本量较低(7例),尚待扩大样本量进一步验证。
综上所述,基因突变的克隆数分析是在高通量测序检出基因突变的基础上,利用VAF值进行进一步分析。但基因突变检测得到的信息仍是细胞群体的混合信息,依旧存在较大的异质性,无法准确辨别单个克隆的特征与演变。基因突变的克隆数分析与突变本身密切相关,但同时也能从不同角度分析MDS的发生及发展,描绘突变的克隆属性及MDS的克隆演变进程,可以作为高通量测序现有基因突变分析的有益补充,具有一定的临床价值。


























