
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
系统性红斑狼疮(systemic lupus erythematosus,SLE)是我国最常见的系统性自身免疫性疾病,人群发病率为30.13~70.41/10万人。肾脏是SLE最常累及的器官,40%~60%的SLE患者起病初即有狼疮肾炎(lupus nephritis,LN)。在我国,近半数SLE患者并发LN,高于白种人[1,2,3],是我国最常见的继发性免疫性肾小球疾病[4,5,6]。LN主要由循环或原位免疫复合物沉积引起肾脏损伤所致,少部分SLE通过非免疫复合物途径(如狼疮间质性肾炎),或肾血管病变损伤肾脏。遗传因素在SLE和LN的发生和发展中起着重要的作用,并影响治疗反应和远期预后[7]。同时,我国LN的发生存在地域差异,LN在SLE肾脏损伤中的比例随着纬度的降低而增加[8],表明环境因素在LN的发生中发挥重要作用。
我国LN的10年肾存活率81%~98%[3],是终末期肾脏病(ESRD)的常见病因之一[9,10],也是导致SLE患者死亡的重要原因[11,12]。近十多年来,我国LN治疗方案的选择更加个体化,新型免疫抑制方案,尤其多靶点疗法的推广应用,显著提高了LN治疗缓解率[13,14]。
近年来,多个国际组织,包括改善全球肾脏病预后组织(KDIGO)[15]、美国风湿病学会(ACR)[16]、欧洲抗风湿病联盟/欧洲肾脏病学会-透析移植学会(EULAR/ERA-EDTA)[17]、拉丁美洲狼疮研究小组/泛美风湿病联盟(GLADEL/PANLAR)[18]及亚洲LN协作组[19]等陆续推出了SLE及LN的治疗指南。这些指南引用的证据基本都来自欧美国家在白人和黑人的临床研究,而中国汉族及亚洲国家SLE和LN的基因背景、流行病学、临床特征及对免疫抑制治疗的反应性与西方国家间存在差异[3],因此需要制定我国LN诊治指南。近20年来,我国风湿病学领域推出了SLE诊断及治疗指南[20],他克莫司(Tac)在LN应用的中国专家共识[21]。在肾脏病学领域,完成了大量LN临床研究和前瞻性随机对照临床试验(RCT)以及大样本队列研究[3, 13,14, 22],为制定我国LN治疗指南提供了有力的证据。为促进我国LN临床诊断和治疗规范化,更符合我国的临床实践,在借鉴现有国内外SLE及LN指南基础上制定了本指南。
推荐意见:SLE患者应早期识别肾脏是否受累,有LN的临床表现且既往未行肾活检者,均推荐行肾活检病理检查(除非有肾活检绝对禁忌证)。
高危肾脏损伤发生的SLE患者(男性,青少年及血清学指标活动)应严密监测(至少3个月1次),以尽早发现肾脏损伤[23,24,25]。SLE患者出现以下一项临床和实验室检查异常时,即可诊断为LN,包括:(1)蛋白尿持续>0.5 g/24 h,或随机尿检查尿蛋白+++,或尿蛋白/肌酐比>500 mg/g(50 mg/mmol);(2)细胞管型包括红细胞管型、血红蛋白管型、颗粒管型、管状管型或混合管型;(3)活动性尿沉渣(除外尿路感染,尿白细胞>5个/HPF,尿红细胞>5个/HPF),或红细胞管型,或白细胞管型。肾活检病理显示为免疫复合物介导的肾小球肾炎则进一步确定LN的诊断。
LN的临床表现轻重不一,轻者仅有少量蛋白尿和(或)血尿,重者出现肾病综合征,或快速进展性肾小球肾炎。肾脏病理改变更加多样化,病变轻者可为肾小球病变轻微,重者可表现为弥漫增生性肾炎,甚至新月体性肾炎[26,27]。LN的临床表现与肾组织病理类型间缺乏紧密的联系,因此LN患者均推荐行肾活检病理检查。肾活检病理改变是LN免疫抑制治疗方案选择的基础。
及早识别SLE患者的肾脏损伤和肾活检病理检查是保证患者预后良好的关键。
推荐意见:LN病理类型推荐2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)的分型标准(表1)[28],并采纳2018年RPS工作组对LN病理类型和美国国立卫生研究院(NIH)肾组织活动性(AI)和慢性指数(CI)评分标准提出的部分修订意见[29]。建议增加狼疮足细胞病和狼疮血栓性微血管病(TMA)两个特殊病理类型。

狼疮肾炎的病理分型[28]
狼疮肾炎的病理分型[28]
| 病理分型 | 分型标准 |
|---|---|
| Ⅰ型(轻微系膜病变LN) | 肾小球形态学正常,免疫荧光系膜区可见免疫复合物沉积,不伴肾损伤的临床症状。 |
| Ⅱ型(系膜增生性LN) | 系膜细胞增生或基质增加,伴系膜区免疫沉积物;电镜或免疫荧光可见孤立性上皮下或内皮下沉积物。 |
| Ⅲ型(局灶增生性LN) | 50%以下肾小球表现为毛细血管内或血管外节段或球性细胞增生,通常伴有节段内皮下,伴或不伴系膜区免疫沉积物。 |
| Ⅳ型(弥漫增生性LN) | 50%以上肾小球表现为毛细血管内或血管外节段或球性细胞增生,伴弥漫内皮下,伴或不伴系膜区免疫沉积物。 |
| Ⅴ型(膜性LN) | 光镜和免疫荧光或电镜检查显示球性或节段上皮下免疫沉积物,伴或不伴系膜病变。 |
| Ⅵ型(晚期硬化性LN) | 90%以上肾小球球性硬化,残余肾小球无活动性病变。 |
注:LN:狼疮肾炎;Ⅲ型或Ⅳ型LN如果光镜、免疫荧光或电镜提示肾小球上皮侧有广泛(>50%血管袢)免疫沉积物,诊断为Ⅲ+Ⅴ型LN或Ⅳ+Ⅴ型LN
对Ⅳ型LN不再区分Ⅳ-G和Ⅳ-S两个亚型,但需注意球性和节段性肾小球病变的数量和比例。同时需注意肾小管-间质的急性或慢性病变,对所有类型LN进行肾组织AI和CI评分(评分标准见表2)。

修订版NIH狼疮肾炎活动性及慢性指数评分标准
修订版NIH狼疮肾炎活动性及慢性指数评分标准
| 病变指标 | 定义 | 计分(分) | |
|---|---|---|---|
| 活动性(AI)指数 | |||
| 毛细血管内细胞增多 | 毛细血管内细胞增多:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 中性粒细胞浸润/核碎裂 | 中性粒细胞浸润和(或)核碎裂:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 纤维素样坏死 | 肾小球纤维素样坏死:<25%(1+),25%~50%(2+),>50%(3+) | (0~3)×2 | |
| 内皮下沉积物 | 肾小球白金耳病变和(或)透明血栓:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 细胞/纤维细胞新月体 | 细胞和(或)纤维细胞性新月体:<25%(1+),25%~50%(2+),>50%(3+) | (0~3)×2 | |
| 间质炎细胞浸润 | 皮质区间质白细胞浸润:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| AI总分 | 0~24 | ||
| 慢性(CI)指数 | |||
| 肾小球硬化 | 球性和(或)节段硬化肾小球:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 纤维性新月体 | 纤维性新月体的肾小球:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 肾小管萎缩 | 皮质区肾小管萎缩:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| 间质纤维化 | 皮质区间质纤维化:<25%(1+),25%~50%(2+),>50%(3+) | 0~3 | |
| CI总分 | 0~12 | ||
注:表中%指肾小球病变指标占肾小球的比例,或肾小管间质指标占肾小管/间质的比例。纤维素样坏死和新月体的评分加倍。NIH:美国国立卫生研究院
狼疮足细胞病,或足细胞病型LN是SLE通过非免疫复合物沉积途径介导,以足细胞广泛损伤为特征的一类SLE相关的肾小球疾病,以往多归入Ⅱ型LN。该型患者临床表现为肾病综合征,组织学特征为足细胞广泛足突融合,系膜区无或仅少量免疫沉积物,无内皮下或上皮侧电子致密物沉积。我国制定的狼疮足细胞病诊断标准见表3[30,31]。

狼疮足细胞病诊断标准
狼疮足细胞病诊断标准
| 项目 | 诊断标准 |
|---|---|
| 临床表现 | 满足SLE诊断,表现为肾病综合征,常伴急性肾损伤;起病前无NSAID等药物使用史。 |
| 光镜 | 肾小球病变轻微或系膜增生,或局灶节段肾小球硬化,无内皮下或上皮侧免疫沉积物。节段硬化者需与增生型LN遗留的疤痕鉴别。 |
| 免疫荧光 | 血管袢无免疫沉积物,伴或不伴系膜区免疫球蛋白和补体沉积。 |
| 电镜 | 足细胞足突融合≥70%,可伴系膜区电子致密物沉积而无内皮下或上皮侧电子致密物沉积。 |
注:SLE:系统性红斑狼疮;NSAID:非甾体抗炎药;LN:狼疮肾炎
SLE的肾脏损伤可直接由TMA所致,称为狼疮TMA。狼疮TMA的发病机制不明,可能与SLE的抗磷脂抗体(antiphospholipid antibody,aPL)、ADAMTS13的抗体或抑制物导致ADAMTS13酶活性缺乏(类似于血栓性血小板减少性紫癜,TTP)或补体调节蛋白功能异常等因素相关。绝大多数狼疮TMA与免疫复合物性LN并存(如Ⅳ型和Ⅳ+Ⅴ型LN),少部分可仅表现为肾脏TMA而无免疫复合物性LN。
狼疮TMA可累及肾间质小动脉(入球动脉、小叶间动脉)和肾小球。血管TMA急性病变表现为肾间质小动脉内皮细胞增生、内膜黏液样水肿、血栓形成、管腔狭窄或闭锁,可有血管壁坏死,免疫荧光示血管壁无免疫沉积物。肾小球TMA表现为血管袢内皮细胞增生肿胀、微血栓形成,袢内可见破碎红细胞;电镜检查见内皮下疏松、增宽,内见无定形物质,内皮下无电子致密物。在TMA慢性期,间质小动脉出现内膜纤维性增生,内皮呈"葱皮样"改变,管腔狭窄或闭锁;肾小球呈球性或节段硬化,毛细血管袢基膜增厚,呈"双轨"征[32]。肾小球TMA与LN并存时容易漏诊,需要光镜结合电镜检查加以鉴别。
TMA与LN并存时,肾功能损伤重,半数以上需要肾脏替代治疗,远期预后差[33,34],需联合血浆置换等特殊治疗才能改善肾功能,提高远期人肾存活率[35]。借助外周血涂片检测红细胞碎片,或肾活检病理检查可以明确TMA的诊断。
推荐意见:LN的治疗需要从诱导到维持连续的长期治疗。诱导治疗应个体化,在获得完全缓解后的维持治疗时间应至少3年。治疗过程中需要定期随访,以调整药物剂量或治疗方案、评估疗效和防治合并症。提高人和肾脏长期存活率,改善生活质量是治疗LN的最终目标。
诱导治疗的目的是尽快控制肾脏的急性炎性损伤,力求达到完全缓解。治疗获得完全缓解及早期获得治疗反应的LN患者,远期肾脏预后良好[36,37]。诱导治疗3个月内如果肾脏损伤加重[蛋白尿增多,血清肌酐(SCr)升高]需及时更换治疗方案。治疗6个月获得部分缓解时可继续原方案维持直至完全缓解。治疗12个月仍未获得完全缓解的LN,应通过重复肾活检病理检查调整治疗方案[15]。
在制定LN治疗方案时,需重视LN患者全身脏器和组织损伤的评估(包括中枢神经系统、心脏、胃肠道、肺、血液和甲状腺等)。重型LN活动期常合并其他器官损伤,严重者可能危及生命,如狼疮脑病、狼疮性心肌炎、狼疮性肠炎和狼疮危象等,在治疗上需要优先处理[20]。
狼疮患者的aPL与血栓和产科并发症相关,增加器官损害发生的风险,每个LN患者应检测血清aPL及评估aPL致血栓的风险。高危aPL类型指狼疮抗凝物(LA)阳性伴中-高滴度抗心磷脂抗体(ACL)-IgG或抗β2-糖蛋白Ⅰ抗体(抗β2-GPI)-IgG/IgM(滴度>40 GPL/MPL)。中危指LA阴性,中-高滴度ACL-IgG或抗β2-GPI-IgG/IgM(滴度>40 GPL/ MPL)。SLE伴高危aPL类型,尤其合并其他动脉粥样硬化或血栓的风险因素者,在权衡出血风险后,应使用小剂量阿司匹林预防血栓[38]。在血栓发生的高危期(如妊娠或术后),aPL阳性的LN患者也可使用其他抗凝药物,如低分子肝素。除了aPL外,部分LN患者血清抗中性粒细胞胞质抗体(ANCA)阳性,与肾小球袢坏死和新月体形成有关[39,40,41]。
LN的复发率高(33%~40%)[42,43],复发是导致器官损害加重和预后不良的重要因素[44],因此,LN需要有效的维持治疗。维持治疗需要多长时间尚无确切定论,绝大多数维持期治疗的临床研究时间为3年。中国LN队列研究发现,维持治疗时间<3年是SCr倍增、ESRD或死亡的独立危险因素[45]。因此,LN治疗获得完全缓解后,维持治疗时间建议至少3年。如果仅获得部分缓解或复发的LN,需要更长时间的维持治疗。
LN治疗相关合并症(包括感染、股骨头坏死、糖尿病、骨髓抑制、卵巢功能衰竭等)的发生率>50%,是造成SLE患者致残、致死、生活质量下降的主要原因[46]。LN的治疗方案应个体化,并定期随访,及早发现和处理合并症。
推荐意见:LN治疗期间需要定期随访,评估肾脏及SLE的治疗反应和复发。
在评估肾脏治疗反应时,尿蛋白指标比血尿更重要[17]。临床研究普遍采用的疗效评估标准如下:完全缓解指尿蛋白正常(尿蛋白定量<0.5 g/24 h,或尿蛋白/肌酐比值<500 mg/g或<50 mg/mmol),无活动性尿沉渣,血清白蛋白≥35 g/L,SCr正常或升高不超过基础值的10%。部分缓解指尿蛋白下降较基线值下降超过50%且尿蛋白定量<3.0 g/24 h,血清白蛋白>30 g/L,SCr升高不超过基础值的10%。治疗无反应(no response)是指治疗未达完全缓解或部分缓解。
治疗后尿蛋白快速下降(6个月时≤1 g/24 h,或12个月时≤0.8 g/24 h)是远期肾脏预后良好的标志[17]。除24 h尿蛋白定量外,时间-平均尿蛋白水平更能预测远期肾脏预后[27]。
LN的治疗反应还应评估SLE的疾病活动性,后者可采用SLE-DAI(SLE疾病活动性评分)和英国狼疮评估组(BILAG)评分。SLE要达到完全缓解的标准,即临床无疾病活动且停用糖皮质激素(以下简称激素)及免疫抑制剂难以做到。替代的目标是达到低疾病活动性(low disease activity,LDA),即在使用抗疟药的情况下SLE-DAI≤3分,或使用泼尼松剂量≤7.5 mg及可耐受的免疫抑制剂的情况下SLE-DAI≤4分和医师总评分(physician global assessment,PGA)≤1分[47]。
复发是指疾病活动性指数增加并需要调整药物的剂量或种类的一种状态。LN肾脏复发(renal relapse)的定义和分类采用KDIGO指南标准[14]。发病年龄轻、未使用抗疟药、持续狼疮活动和血清学活动(ds-DNA阳性、低补体血症和抗C1q抗体阳性)、肾组织AI评分高、单用激素维持、停药过早、患者依从性差等是LN复发的高危因素[48,49,50]。对复发高危患者应加强随访,根据临床症状和免疫学指标变化决定是否需要调整治疗,但不推荐仅根据血清学指标活动而给予升级治疗。
推荐意见:除非存在禁忌证,激素和硫酸羟氯喹(HCQ)应作为治疗LN的基础用药。
激素的剂量及用法取决于肾脏损伤的类型、活动性、严重程度及其他器官损伤的范围和程度。活动增生性LN(Ⅲ型、Ⅳ型、Ⅲ/Ⅳ+Ⅴ型)及伴有TMA的LN,先给予大剂量甲泼尼龙静脉冲击治疗(500 mg/d或750 mg/d,静脉滴注,连续3 d),后续口服泼尼松(或甲泼尼龙)0.5~0.6 mg·kg-1·d-1[19]。病变特别严重的患者(如新月体比例超过50%),甲泼尼龙静脉冲击治疗可重复一个疗程。其他类型LN可口服泼尼松,剂量为0.5~1.0 mg·kg-1·d-1,4~6周后逐步减量。长期维持激素最好能减量至7.5 mg/d以内,如果条件允许则停用。
目前关于激素的剂量和疗程尚缺乏强有力的临床试验证据,应根据病理类型、激素治疗反应性及是否存在合并症进行选择。
HCQ具有免疫调节和抑制肾脏损伤进展的作用,能预防SLE患者肾损害的发生,预防LN复发,延缓肾脏损害的进展并减少ESRD的发生[51,52]。HCQ能抑制aPL对内皮细胞的损伤,预防SLE患者血栓,减少产科并发症及降低心血管病的发生[52,53]。aPL阳性的LN,或合并抗磷脂抗体综合征(APS)的患者,如无禁忌证,应常规使用HCQ。HCQ的最大治疗剂量不超过5 mg·kg-1·d-1,缓解期可以减量为0.2 g/d。HCQ的安全性较高,不良反应主要为色素沉着、头痛、胃肠道症状。严重不良反应如心肌毒性和视网膜病变的发生率非常低,但在HCQ治疗过程中仍应定期筛查视网膜病变。HCQ治疗前及治疗5年应检查视网膜病变,此后每年检查眼底一次。年龄>60岁、HCQ剂量>6.5 mg·kg-1·d-1、疗程超过5年、有肝肾基础疾病、视网膜疾病及肥胖为视网膜病变发生的高危患者,应每年检查眼底[17, 54,55]。一旦发现视网膜病变,应停用HCQ。
推荐意见:肾脏病理类型及病变活动性是选择LN治疗方案的基础,不同病理类型LN优先选择的诱导和维持治疗方案见表4。治疗方案和药物剂量还应根据患者的年龄、营养状态、肝功能、感染风险、肾脏损伤指标(如尿蛋白定量、尿沉渣和SCr水平)、肾外脏器损伤、生育意愿、合并症和既往免疫抑制剂的治疗反应等情况进行个体化选择。

狼疮肾炎病理类型与治疗方案
狼疮肾炎病理类型与治疗方案
| 病理类型 | 诱导方案 | 维持方案 |
|---|---|---|
| Ⅰ型 | 激素,或激素联合免疫抑制剂控制肾外狼疮活动 | 激素,或激素联合免疫抑制剂控制肾外狼疮活动 |
| Ⅱ型 | 激素,或激素联合免疫抑制剂 | MMF,或AZA |
| 狼疮足细胞病 | 激素,或激素+MMF或CNI | MMF,或CNI |
| Ⅲ型和Ⅳ型 | MMF,IV-CYC,或多靶点 | MMF,或多靶点 |
| Ⅲ+Ⅴ型和Ⅳ+Ⅴ型 | 多靶点、CNI,或MMF | 多靶点,或MMF |
| Ⅴ型 | 多靶点,或CNI,或TW | MMF,或AZA |
| Ⅵ型 | 激素,或激素联合免疫抑制剂控制肾外活动 | 激素 |
| 狼疮TMA | 如肾功能损伤严重,IV-CYC联合血浆置换或双重血浆置换 | MMF,或多靶点,或AZA |
注:TMA:血栓性微血管病;MMF:吗替麦考酚酯;CNI:神经钙调蛋白抑制剂;IV-CYC:静脉注射环磷酰胺;TW:雷公藤多苷;AZA:硫唑嘌呤
LN的诱导和维持治疗是连续、序贯的治疗过程,两个阶段的治疗方案可以一致,也可以不同。
推荐意见:对无蛋白尿的Ⅱ型LN,激素剂量和其他免疫抑制药物的使用根据其他器官损伤和狼疮活动性而定。蛋白尿>0.5 g/24 h,但<3.0 g/24 h的Ⅱ型LN,采用口服激素(0.5~0.6 mg·kg-1·d-1),或激素联合免疫抑制剂诱导,缓解后激素联合免疫抑制剂[硫唑嘌呤(AZA)、吗替麦考酚酯(MMF)]维持。
有关Ⅱ型LN治疗的临床研究较少。一项1 810例LN的远期预后研究发现Ⅱ型LN的远期肾脏预后并不乐观,首次肾活检为Ⅱ型LN的10年肾脏存活率甚至低于Ⅴ型[27],预后差的原因可能与复发后病理转型有关。Ⅱ型LN采用激素或激素联合免疫抑制剂治疗,90%患者尿蛋白转阴。但随访4年,约30%肾脏复发,其中80%复发后发生病理转型为Ⅴ型、Ⅳ型或Ⅲ/Ⅳ+Ⅴ型LN。因此,Ⅱ型LN应加强维持期治疗,建议采用激素联合AZA或MMF预防复发[56]。复发的患者应接受重复肾活检,明确是否发生病理转型。
Ⅱ型LN患者如果蛋白尿>3.0 g/24 h,按狼疮足细胞病治疗。
推荐意见:肾小球病理改变轻微或系膜增生的狼疮足细胞病推荐激素单药诱导,或激素联合免疫抑制剂诱导缓解;激素单药诱导未获缓解,或肾小球病变为局灶节段肾小球硬化(FSGS)者,应联合其他免疫抑制剂治疗。狼疮足细胞病获得缓解后推荐采用激素联合免疫抑制剂维持。反复复发者建议联合CD20单克隆抗体治疗。
个案报道或小样本研究显示狼疮足细胞病对激素治疗敏感。我国一项53例狼疮足细胞病的研究显示激素单药或激素联合免疫抑制剂诱导治疗的完全缓解率均可达80%[57]。肾小球病变轻微或系膜增生的狼疮足细胞病,激素单药与激素联合免疫抑制剂治疗的缓解率相似,但肾小球病变为FSGS的患者,激素单药治疗的完全缓解率低(仅为16.7%),激素联合免疫抑制剂治疗可提高缓解率。
狼疮足细胞病的肾脏复发率高,激素单药维持治疗的复发率高达90%。即使采用激素联合免疫抑制剂维持治疗,复发率仍较高[30]。对反复复发的狼疮足细胞病,个案报道抗CD20单克隆抗体(利妥昔单抗,RTX)能预防复发[58]。狼疮足细胞病反复复发后可发生肾脏病理转型,建议对复发的患者进行重复肾活检明确是否发生病理转型。
推荐意见:Ⅲ型和Ⅳ型LN,推荐MMF方案、静脉注射环磷酰胺(IV-CYC)或多靶点方案作为初始诱导治疗。MMF和IV-CYC方案诱导缓解后优先选择MMF维持,多靶点诱导缓解后继续多靶点维持治疗。Ⅲ+Ⅴ型和Ⅳ+Ⅴ型LN,优先选择多靶点方案诱导和维持。
增生性LN和增生性LN伴Ⅴ型LN的治疗方案选择和流程见图1。
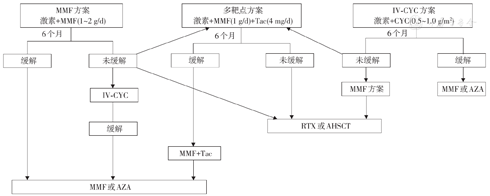

注:MMF:吗替麦考酚酯;Tac:他克莫司;IV-CYC:静脉注射环磷酰胺;CYC:环磷酰胺;AZA:硫唑嘌呤;RTX:利妥昔单抗;AHSCT:自体外周造血干细胞移植
推荐意见:Ⅲ型和Ⅳ型LN,尤其伴有新月体或有生育需求的LN,首选MMF诱导,缓解后继续MMF维持。MMF总疗程超过2年后可切换为AZA维持。
国内外临床研究证明MMF方案诱导治疗Ⅲ型和Ⅳ型LN的疗效不劣于或甚至优于IV-CYC方案[59,60]。MMF方案维持治疗的疗效优于AZA[61,62]。多个LN治疗指南(KDIGO、ACR、EULAR/ERA-EDTA、亚洲)推荐MMF作为Ⅲ和Ⅳ型LN的一线诱导和维持治疗方案[15,16,19,63]。
我国两项对照研究均发现MMF诱导治疗Ⅳ型LN疗效优于IV-CYC[60, 64]。一项研究显示MMF治疗6个月的缓解率高于IV-CYC,重复肾活检显示MMF逆转肾小球袢坏死和新月体的比例高于IV-CYC[60]。但MMF治疗Ⅳ+Ⅴ型LN,6个月完全缓解率仅为20%~27.8%[42, 65],延长治疗时间缓解率也无明显提高。MMF治疗Ⅳ+Ⅴ型LN的10年复合肾脏终点事件[包括终末期肾病,SCr倍增或估算肾小球滤过率(eGFR)下降超过基线50%]的发生率也显著高于其他类型LN[42]。因此,不建议MMF方案作为Ⅳ+Ⅴ型LN的首选治疗方案。
MMF治疗LN的国际多中心RCT(ALMS试验)[59],发现MMF与IV-CYC治疗6个月的治疗反应率相当(分别为56%和53%),但MMF治疗组卵巢衰竭、脱发和白细胞减少的风险低于IV-CYC。因此,对有生育要求的患者,应优先选择MMF方案。
MMF治疗严重Ⅳ型LN的临床研究较少,大部分LN临床试验不纳入SCr>265.2 μmol/L(3 mg/dl)的患者。ALMS试验中,对基线eGFR<30 ml·min-1·(1.73 m2)-1的32例严重LN的亚组分析,以及另2项MMF治疗严重LN的对照研究,发现MMF与IV-CYC治疗反应无明显差异[66,67,68]。我国一项MMF治疗52例新月体型LN的临床对照研究,发现MMF组12个月完全缓解率显著高于IV-CYC(53.8%比26.1%,P=0.047)[22]。另一项研究显示MMF治疗20例Ⅳ型伴非炎症坏死性血管病变LN,治疗6个月的完全缓解显著高于IV-CYC[69]。以上研究的样本量均较小,但支持MMF用于治疗伴肾功能减退或新月体的LN。MMF治疗对严重LN远期肾脏预后的影响缺乏足够的研究。
ALMS试验维持期研究发现,在随访2.3年期间,MMF诱导-MMF维持组的主要疗效指标,即到达治疗失败(死亡、ERSD、持续SCr倍增、肾脏复发),或因LN加重或恶化而需要补救治疗(激素、血浆置换、静脉注射免疫球蛋白,或方案中未列入新的方案)的事件均优于AZA组[61]。荟萃分析表明,MMF预防LN复发的疗效优于AZA[62]。
增生性LN治疗的欧洲多中心研究,采用欧洲IV-CYC方案诱导后MMF或AZA维持治疗,两组肾脏和肾外复发、肾功能恶化及感染发生比例均无明显差异;随访10年,肾脏存活率和死亡率也无明显差异[37]。但该研究纳入的病例79%为白人。
MMF治疗LN的最佳疗程和远期预后的研究较少。两项国内研究支持MMF诱导-MMF维持的连续方案。中国香港地区一项研究发现Ⅳ型LN在MMF诱导缓解后继续MMF维持治疗,MMF总疗程不到2年组患者的复发率显著高于总疗程超过2年组[70]。国内另一项研究发现MMF诱导增生性LN缓解后继续MMF维持治疗,疗程不足18个月组患者的复发率升高[42]。因此,MMF诱导缓解后应继续MMF维持,总疗程达2年以上。无复发者可切换为AZA维持。
ALMS研究中MMF的治疗剂量较大(2~3 g/d),导致我国和其他亚洲国家患者严重感染的发生率增高。我国临床研究中使用的MMF剂量多为1.5~2.0 g/d,MMF的维持剂量通常为1.0 g/d或更低。
MMF血药浓度个体差异大,受基因类型、血清白蛋白、SCr水平和其他药物的影响。MMF血药浓度与疗效的关系尚未确定,但与不良反应相关。研究发现在MMF治疗3个月内,吗替麦考酚酸(MPA)药时曲线下面积(MPA-AUC)超过40 mg·h·L-1时,感染及其他不良反应的发生率显著增高。因此,在治疗初期MPA-AUC不要超过40 mg·h·L-1。低蛋白血症、贫血、肾功能不全和淋巴细胞减少的患者,MPA-AUC应更低[71]。如果无条件检测MMF血药浓度,治疗初期应降低MMF的剂量。
MMF治疗期间应动态观察外周血淋巴细胞的数量。淋巴细胞持续下降或CD4+T淋巴细胞<200/μl时,MMF应减量或暂停使用。对感染高危患者,在MMF治疗前3个月内,应预防性使用复方磺胺甲 唑(SMZ-CO)。
唑(SMZ-CO)。
4.AZA的维持剂量为1.5~2.0 mg·kg-1·d-1,开始使用时需要监测肝功能和血白细胞。
推荐意见:多靶点方案可作为Ⅲ型和Ⅳ型、Ⅲ/Ⅳ+Ⅴ型(尤其表现为肾病综合征)LN的首选诱导方案。
多靶点方案由激素、MMF和Tac组成,该方案每种药物作用于SLE及LN发病的多个环节,在抗炎、免疫抑制和足细胞保护等方面发挥协同作用,提高疗效[72]。
早期一项多靶点治疗LN的单中心临床研究,发现多靶点方案治疗Ⅳ+Ⅴ型LN的完全缓解率显著高于IV-CYC[73]。国内多中心RCT纳入了368例重型LN,发现诱导治疗24周,多靶点组的累积完全缓解率显著高于IV-CYC组(45.9%比25.6%,P<0.001),不良反应发生率与IV-CYC无明显差异[13]。纳入8项试验共801例LN的荟萃分析显示,与IV-CYC相比,多靶点方案诱导治疗的总体肾脏完全缓解率及Ⅳ型,Ⅴ型和Ⅳ+Ⅴ型LN完全缓解率更高[74]。另一项纳入53项研究共4 222例增生性LN的荟萃分析发现,与IV-CYC相比,多靶点诱导治疗缓解率最高,其次是钙调蛋白酶抑制剂和MMF[75]。
根据现有研究证据,多靶点方案适合于多种重型LN的诱导治疗。由于上述研究将SCr>265.2 μmol/L(3 mg/dl)和伴TMA的LN排除在外,因此多靶点方案对有严重肾功能不全和伴TMA的LN的疗效和安全性缺乏研究。
除MMF联合Tac外,也有报道MMF联合环孢素A(CsA)的多靶点方案用于治疗顽固性LN[76,77]。
多靶点方案维持:国内报道了两项多靶点维持治疗LN的研究[14, 78]。一项多中心研究纳入了206例LN,其中116例多靶点诱导6个月缓解后继续多靶点维持,90例IV-CYC诱导缓解后AZA维持,随访18个月。发现两组累积肾脏复发率无明显差异(5.47%比7.62%,P=0.74),但AZA维持组的不良事件发生率显著高于多靶点维持组(44.4%比16.4%,P<0.01),多靶点组退出治疗比例显著低于AZA(1.7%比8.9%,P=0.02)。多靶点诱导缓解后继续多靶点维持不良反应发生率低[14]。
多靶点维持治疗的疗程、多靶点诱导缓解后切换为MMF或Tac能否获得与多靶点维持相同的疗效,以及多靶点治疗对远期肾脏存活的影响需要进一步研究。
多靶点方案中的药物剂量和血药浓度:多靶点诱导方案,MMF治疗剂量为1.0 g/d,Tac剂量为4 mg/d,根据肾损伤程度、MMF和Tac血药浓度及患者耐受性调整药物的剂量。SCr升高,或血清白蛋白水平<20 g/L时,MMF剂量减为0.50~0.75 g/d。Tac谷浓度一般为5~8 μg/L,如超过10 μg/L,或出现不良反应,Tac应减量。治疗过程需监测淋巴细胞数量、SCr和肝功能。
多靶点方案维持时,MMF减为0.50~0.75 g/d,Tac剂量2~3 mg/d,根据患者血清学、不良反应等指标调整剂量[14]。
推荐意见:Ⅲ型、Ⅳ型LN,尤其SCr>265.2 μmol/L(3 mg/dl),或肾组织慢性指数高(CI>3分)时,可选择IV-CYC诱导方案,缓解后优先选择MMF维持。
CYC方案有3种:NIH大剂量静脉CYC冲击治疗(NIH-CYC方案,每个月CYC 0.5~1.0 g/m2体表面积,静脉滴注,疗程6个月)和小剂量CYC静脉冲击方案(欧洲CYC方案,每2周CYC 500 mg静脉滴注,共3个月)。另一种口服CYC方案,即CYC 1.0~1.5 mg·kg-1·d-1(最大剂量150 mg/d)口服2~4个月。目前国内主要采用NIH-CYC方案。
临床研究显示IV-CYC能显著改善LN的远期预后[79,80,81,82]。多个国际性LN治疗指南推荐IV-CYC作为Ⅲ和Ⅳ型LN的诱导治疗方案。对有严重肾功能不全或肾功能快速恶化LN,肾活检显示新月体或肾脏急性和慢性指数高的LN,用NIH-CYC方案能获得良好的远期肾脏存活率[83]。最近研究证明,3~6个月CYC方案后AZA或MMF维持与CYC长期维持同样能获得良好的长期预后[84]。由于长期使用CYC存在感染、白细胞减少、卵巢功能衰竭、出血性膀胱炎和肿瘤等不良反应,近年临床试验中NIH-CYC方案的诱导治疗时间定为6个月。CYC方案诱导缓解后MMF维持治疗的复发率和治疗失败率显著低于AZA维持治疗[61]。因此,CYC缓解后应优先选择MMF方案维持。
研究显示欧洲-CYC诱导治疗LN的疗效与NIH-CYC方案相当[85]。随访10年,两种方案的复发率、ESRD及SCr倍增比例相似[86],该方案并发严重感染的发生率低[85]。但欧洲-CYC方案中研究对象仅是白人及轻-中度LN,EULAR/ERA-EDTA和ACR指南推荐欧洲白人或有欧洲血统的白人应用欧洲-CYC方案。欧洲-CYC方案在我国或亚洲人群LN中缺乏对照研究。
中国香港地区一项研究发现口服CYC方案治疗弥漫增生性LN的缓解率高于NIH-CYC方案。由于CYC口服方案的累积剂量大,对卵巢的毒性更大,不建议作为首选治疗方案[45]。
多个临床试验证实,IV-CYC治疗Ⅳ+Ⅴ型的缓解率显著低于多靶点、MMF或Tac方案[65, 73, 87]。因此,Ⅳ+Ⅴ型LN不建议选择IV-CYC作为首选诱导方案。
推荐意见:肾功能正常或轻度受损伴有大量蛋白尿的Ⅲ型、Ⅳ型、或Ⅲ/Ⅳ+Ⅴ型LN,可选择Tac作为诱导治疗。
Tac治疗LN缺乏大样本RCT研究,纳入的病例SCr正常或SCr<265.2 μmol/L(3 mg/dl),缺乏对严重肾功能损伤LN的研究。
两项单中心研究发现Tac治疗Ⅳ型和Ⅳ+Ⅴ型LN的完全缓解率显著高于IV-CYC[87,88]。另一项单中心研究显示Tac诱导治疗增生性和Ⅴ型LN缓解率与MMF方案或IV-CYC方案无明显差异[89]。一项多中心RCT纳入81例重型LN,发现Tac与IV-CYC方案诱导治疗6个月的完全缓解率和总缓解率差异无统计学意义[90]。荟萃分析显示Tac诱导治疗LN的疗效优于IV-CYC,而且不良反应率低[91]。中国香港地区一项RCT共纳入150例LN,研究显示Tac(0.06 mg·kg-1·d-1)治疗6个月的完全缓解率与MMF(2~3 g/d)无明显差异[92]。
Tac维持治疗LN缺乏前瞻性对照研究。国内一项研究观察了70例LN在治疗获得缓解后随机接受Tac或AZA治疗,随访6个月两组复发率无差异,而AZA组白细胞减少发生率显著高于Tac,但该研究随访时间过短,Ⅲ型LN的比例过高(占77.1%)[93]。
推荐意见:蛋白尿≥2 g/24 h的Ⅴ型LN应进行免疫抑制治疗,选择多靶点方案或CNI(Tac/CsA)方案诱导,或雷公藤多苷(TW)短疗程治疗。维持期可采用激素联合MMF或CNI方案[19]。尿蛋白<2 g/24 h的Ⅴ型LN采用激素和肾素-血管紧张素系统抑制剂减少蛋白尿。治疗过程中如肾损伤加重(尿蛋白增加,或肾功能减退)应进行免疫抑制治疗。
大量蛋白尿的Ⅴ型LN自发缓解率低,持续蛋白尿是Ⅴ型LN发生ESRD、心血管疾病和血栓事件的高危因素[94],因此,需要免疫抑制治疗控制蛋白尿。IV-CYC、Tac/CsA、MMF和TW治疗Ⅴ型LN均有临床研究,但缺乏大样本的RCT研究。现有国际指南推荐Ⅴ型LN治疗的证据级别都较低[15,16, 19, 63]。
对多靶点治疗LN的多中心RCT研究[13]中的69例Ⅴ型LN进行亚组分析,发现多靶点组24周的完全缓解率显著高于IV-CYC(33.1%比7.8%)。
早期研究显示CsA治疗Ⅴ型LN缓解率高,但停药后复发率高。国内报道24例Ⅴ型LN,采用激素联合CsA治疗12个月,40%获得完全缓解,未见CsA肾毒性,但CsA停用后33.3%患者复发[95]。另有一组42例Ⅴ型LN,随机接受激素,激素联合IV-CYC或激素联合CsA。治疗12个月的累积完全或部分缓解率CsA组最高(83%),IV-CYC组其次(60%),激素组最低(27%),但停用CsA后复发率显著高于IV-CYC[96]。
目前缺乏Tac治疗Ⅴ型的对照研究。对一项Tac和MMF治疗LN对照研究中的28例Ⅴ型LN进行亚组分析,发现Tac降低Ⅴ型LN蛋白尿的疗效优于MMF[92]。
EULAR/ERA-EDTA指南和ACR指南将MMF作为Ⅴ型LN优先选择的治疗方案,但证据来自两项MMF与IV-CYC治疗LN研究的亚组分析。对40例肾病范围蛋白尿的Ⅴ型LN进行亚组分析,发现两组缓解率(MMF组41.2%,IV-CYC组39.1%)和尿蛋白下降率也无明显差异[97],可见MMF和IV-CYC治疗Ⅴ型LN的疗效相当,缓解率均较低。国内缺乏MMF治疗Ⅴ型LN的对照研究。
非对照研究发现激素联合TW治疗Ⅴ型LN能获得较高的缓解率。53例蛋白尿超过1 g/24 h的Ⅴ型LN患者接受泼尼松和TW(60 mg/d),治疗12个月的完全缓解率为71%,但62.8%的患者在TW治疗9个月时发生闭经。因此,未生育的Ⅴ型LN不建议长期使用TW[98]。
推荐意见:狼疮TMA患者,如果肾功能进行性减退,或严重肾功能不全需肾脏替代治疗,除传统大剂量甲泼尼龙静脉冲击和免疫抑制治疗外,应联合血浆置换或双重血浆置换(DFPP)治疗。血清aPL阳性,或伴有APS者,应使用抗凝剂和HCQ。
狼疮TMA的治疗缺乏临床研究证据,不同国际组织颁布的指南有不同建议。KDIGO指南建议SLE相关TTP采用血浆置换,ACR则推荐狼疮TMA采用血浆置换治疗,EULAR/ERA-EDTA指南则强调抗凝、免疫抑制和HCQ。
国内一组小样本病例对照研究,发现治疗初需要肾脏替代治疗的狼疮TMA伴LN患者,免疫抑制联合DFPP治疗后摆脱肾脏替代治疗的比例显著高于单用免疫抑制治疗组,而且肾脏存活率明显提高。但对不需肾脏替代治疗的患者,联合DFPP治疗3个月肾功能改善获益不明显。因此,对有严重肾功能损伤的狼疮TMA,联合应用DFPP能更好地改善肾功能[99]。另一项免疫抑制剂联合血浆置换治疗LN伴狼疮TMA的病例对照研究显示,缓解率显著提高,治疗失败率降低,复合终点事件减少[35]。
少数狼疮TMA患者体内存在ADAMTS13抗体或抑制物,导致ADAMTS13酶活性缺乏(类似于TTP),个案报道采用血浆置换及输注新鲜血浆能改善肾功能[100]。对血清aPL抗体阳性,或明确有APS的狼疮TMA患者,应采用APS的治疗方法,加强HCQ和抗凝(如华法林)治疗[33]。
狼疮TMA伴LN的免疫抑制治疗方案根据LN的病理类型和肾功能损伤程度来选择。肾功能损伤较重者优先选择IV-CYC方案作为初始诱导,根据治疗反应及肾功能状态后续可切换为MMF、多靶点或AZA。如果诱导治疗3个月后仍不能摆脱肾脏替代治疗,则给予激素维持治疗,停用其他免疫抑制药物,以减少治疗合并症。
推荐意见:对顽固性LN建议进行重复肾活检,根据病理改变、血清学和临床指标调整免疫抑制治疗方案。可调整为多靶点方案、自体干细胞移植、抗CD20单克隆抗体。
顽固性LN的定义国际上缺乏统一标准,通常认为活动性LN接受初始免疫抑制治疗任何时间肾损伤加重(SCr升高,蛋白尿增加),或诱导治疗6个月治疗无反应(未获得部分缓解标准)属于顽固性LN。顽固性LN应重复肾活检,了解病理类型是否转型、AI或CI指数,评估肾组织病变的可逆性。治疗上可采用以下补救治疗方案,但顽固性LN治疗的研究多为小样本观察性研究。
有报道对使用2种以上免疫抑制剂治疗未获缓解的LN(Ⅲ/Ⅳ、Ⅲ/Ⅳ+Ⅴ及Ⅴ型),在激素剂量不增加的情况下,改用多靶点方案治疗12个月,78%的患者获得完全缓解或部分缓解[101]。另一项研究在MMF治疗未获缓解或复发的LN,加用Tac作为补救治疗,发现70%患者获得治疗反应[102]。
对顽固性LN,或反复复发LN,可联合RTX。目前RTX治疗LN方案不统一,包括375 mg/m2体表面积(d1、d8、d15、d22),或1 000 mg(d1,d15)等[103,104]。尽管RTX治疗LN的RCT研究(LUNAR试验)未发现免疫抑制剂联合RTX治疗增加疗效[105],但事后分析发现B细胞完全清除、B细胞完全清除持续时间>71 d和B细胞完全清除快的患者完全缓解率显著增高[106]。一项研究对44例活动性LN患者采用RTX、MMF或IV-CYC治疗12个月,RTX治疗的完全缓解率(70.6%)与MMF(52.9%)和IV-CYC(65.0%)相当[107]。多项小样本开放性研究认为,RTX可以作为MMF或IV-CYC治疗无效的顽固性LN的补救治疗或复发患者的诱导和维持治疗。我国学者汇总分析了24项研究共940例LN使用RTX的疗效,RTX治疗12个月的完全缓解率为35.9%,总缓解率为73.4%。对照研究中,RTX治疗能显著增加总缓解率和完全缓解率[103]。RTX治疗抗C1q抗体和ANCA阳性的重症LN的RCT研究发现,RTX治疗的缓解率显著高于IV-CYC[108]。中国香港地区一项病例研究也显示,RTX诱导治疗LN有效[109]。RTX还被成功用于无激素方案治疗LN[108]。
重复肾活检病理为增生性LN,或增生性LN合并Ⅴ型,尤其血清学指标持续活动者,可使用自体外周造血干细胞移植(AHSCT)。欧洲和美国外周造血干细胞移植(HSCT)治疗指南均将AHSCT作为顽固性SLE的治疗指征[110,111]。
AHSCT治疗顽固性SLE的研究主要在欧洲和美国。一项研究汇总了欧洲35个中心85例顽固性SLE接受AHSCT治疗的患者资料,中位随访25个月,5年总生存率79%,无复发生存率为44%[112]。西北大学报道AHSCT治疗50例顽固性SLE(其中25例LN),中位随访29个月,5年生存率84%,无复发生存率50%[110]。
国内报道AHSCT治疗22例顽固性LN,随访中位72(60~80)个月,发现18例获得完全缓解,1例获得部分缓解;6例在随访期间复发,无复发肾存活率为53%,5年人存活率91%[113]。由于AHSCT需要特殊的医疗条件和技术,该治疗需要在有条件的医疗机构进行。
推荐意见:对于LN复发患者,建议再次使用原诱导和维持治疗方案。若重复使用原治疗方案将导致CYC过量,推荐使用不含CYC的诱导治疗方案。
若怀疑患者的肾脏病理发生转型,或不能确定SCr升高、蛋白尿恶化是活动性病变还是慢性病变所致,应考虑重复肾活检。
推荐意见:除免疫抑制药物外,应强调非免疫抑制措施在LN治疗中的应用。对尿蛋白持续存在,无法获得完全缓解的LN应加强抗肾脏纤维化的治疗。
非免疫抑制治疗措施包括控制高血压、应用肾素-血管紧张素系统抑制剂[血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)]、预防血栓、纠正营养不良和治疗代谢并发症(糖尿病、高脂血症、高尿酸血症、肥胖等)、应用活性维生素D3等。非免疫抑制治疗不仅可帮助提高疗效,而且能减少合并症的发生和防止肾脏损伤加重。
推荐意见:诱导治疗初期是感染的高危期,应加强感染的预防和监控。
LN并发感染的发生率高(17%~45%),尤其诱导治疗开始的前3个月内是感染的高发期[46]。感染是导致患者死亡的主要原因[11,12, 46]。大剂量激素和其他免疫抑制药物的应用、肾功能不全、营养不良、免疫防御能力低下(球蛋白丢失、皮肤和肠道水肿、淋巴细胞数量减少)是LN患者感染发生的主要危险因素。诱导期感染部位以皮肤软组织和肺最常见,病原体以病毒、细菌和真菌常见。维持期感染以泌尿系统和皮肤感染最常见,病原体以细菌最常见,其次为病毒、原虫等[46]。
免疫抑制治疗前应评估感染的风险及排除潜在的感染,把握免疫抑制药物使用时机和控制免疫抑制药物的剂量。感染高危患者可预防用抗生素(如SMZ-CO),治疗过程中应及时调整免疫抑制药物剂量。并发严重感染时,应停用免疫抑制药物。
推荐意见:LN患者妊娠管理参见中国SLE患者围产期管理建议[116]及慢性肾脏病患者妊娠管理指南[117]。LN患者妊娠应由多学科团队定期随访,评估LN活动性和妊娠合并症,调整治疗和决定是否继续妊娠。
LN(尤其活动期)患者妊娠时母体及胎儿不良事件发生的风险显著增加。所有LN患者孕前需评估妊娠时机、妊娠并发症风险和停用妊娠期禁忌药物。无狼疮活动、尿蛋白正常并停用妊娠禁忌药物(如MMF、CYC、来氟米特、MTX、生物制剂等)6个月以上、血压正常及肾小球滤过率(GFR)>60 ml/min可考虑妊娠[118]。
妊娠期间可使用泼尼松或甲泼尼龙联合HCQ维持。复发高危患者加用AZA或CsA/Tac维持。血清aPL阳性或有产科APS病史的患者,妊娠期应使用阿司匹林和(或)低分子肝素预防不良妊娠[119]。妊娠期LN复发时可增加激素剂量,或联合CsA/Tac、AZA控制狼疮活动。病情严重者可考虑甲泼尼龙冲击治疗、静脉注射人免疫球蛋白或血浆置换。如果狼疮活动导致肾脏损伤持续加重(蛋白尿增加,SCr升高及血压升高),或并发子痫前期,应尽早终止妊娠。
项目主持者:刘志红(东部战区总医院 国家肾脏疾病临床医学研究中心)
执笔者:胡伟新、陈樱花(东部战区总医院 国家肾脏疾病临床医学研究中心)
指南编写组成员(按姓氏汉语拼音排序):陈江华(浙江大学医学院附属第一医院);陈孟华(宁夏医科大学总医院);陈崴(中山大学附属第一医院);陈晓农(上海交通大学医学院附属瑞金医院);陈樱花(东部战区总医院 国家肾脏疾病临床医学研究中心);付平(四川大学华西医院);胡伟新(东部战区总医院 国家肾脏疾病临床医学研究中心);胡昭(山东大学齐鲁医院);李荣山(山西省人民医院);李雪梅(北京协和医院);刘必成(东南大学附属中大医院);刘章锁(郑州大学附属第一医院);刘志红(东部战区总医院 国家肾脏疾病临床医学研究中心);梅长林(海军军医大学附属长征医院);倪兆慧(上海交通大学医学院附属仁济医院);万建新(福州医科大学附属第一医院);王莉(四川省人民医院);谢红浪(东部战区总医院 国家肾脏疾病临床医学研究中心);邢昌赢(南京医科大学第一附属医院);曾彩虹、章海涛(东部战区总医院 国家肾脏疾病临床医学研究中心);周巧玲(中南大学湘雅医院)
编写组所有成员均声明不存在利益冲突

























