
通过联合检测D-二聚体(D-D)和纤维蛋白原(Fbg)水平,评价两者联合检测对恶性肿瘤患者合并深静脉血栓(DVT)的诊断价值。
选取2016年1月至2017年6月于天津医科大学附属肿瘤医院收治的99例肿瘤患者进行回顾性分析,其中DVT患者47例(DVT组)、非DVT患者52例(对照组)。分析比较静脉血中D-D和Fbg水平的差异。DVT的诊断以经彩色多普勒或经静脉造影检查阳性为标准。采用受试者工作特征曲线(ROC)评估D-D、Fbg以及两指标联合诊断肿瘤患者中DVT的诊断价值。
DVT肿瘤患者组和非DVT对照组血浆中D-D水平分别为7.17 μg/ml和4.25 μg/ml(均P<0.01),DVT肿瘤患者组和非DVT对照组血浆中Fbg水平分别为4.01 mg/ml和2.02 mg/ml(均P<0.01);D-D水平用于诊断肿瘤患者合并DVT的曲线下面积(AUC)、特异性和敏感性分别是0.728、62.50%和72.50%,Fbg水平用于诊断肿瘤患者合并DVT的曲线下面积(AUC)、特异性和敏感性分别是0.642、65.50%和58.80%,D-D和Fbg两项指标联合诊断肿瘤患者合并DVT的曲线下面积(AUC)、灵敏度和特异度分别为0.764、83.30%和59.00%。
D-D和Fbg在发生深静脉血栓的恶性肿瘤患者中显著升高,两者的联合检测对于肿瘤患者中发生DVT的早期诊断有重要的诊断价值,对临床早期采取干预治疗和提高患者预后有潜在应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
深静脉血栓(deep venous thrombosis,DVT)是血栓性疾病——深静脉血栓栓塞症(venous thromboembolism,VTE)的主要形式。DVT可发生于上肢深静脉、内脏静脉甚至腔静脉内,但其最常见于下肢和大腿的深静脉[1]。统计结果表明,DVT的发病率约为1/1 000,且逐年升高。DVT已经成为第三大心血管疾病[2]。DVT的发病机制复杂,由多种因素共同引发,如内皮损伤、血液凝固性增加和纤维蛋白溶解活性受损等。
DVT是肿瘤患者的常见并发症,约4%~20%的肿瘤患者并发DVT,是造成肿瘤患者死亡的重要因素之一。循证医学研究结果表明,在所有DVT患者中,癌症患者占比约20%;癌症患者DVT的发生风险是非肿瘤患者的4.1倍[3]。恶性肿瘤常并发DVT和肺栓塞(pulmonary embolism,PE),且DVT在恶性肿瘤发展的所有阶段均有可能发生,即使没有形成血栓,恶性肿瘤患者血液中的凝血成分也会有所改变。
目前,静脉造影是临床诊断DVT的最准确方法,但其价格昂贵且具有创伤性,也可能造成血栓形成。彩色多普勒血流显像因其成本较低且对DVT具有较高的确诊率而广泛使用,但其耗时长,往往丧失早期预测价值[4]。因此,选择一种DVT相关的生物标志物,对DVT的临床早期诊断、治疗及预后监控具有重要意义。本研究通过检测肿瘤患者血浆中D-二聚体(D-dipolymer,D-D)和纤维蛋白原(fibrinogen,Fbg),评估D-D和Fbg联合检测对恶性肿瘤合并DVT的诊断价值。
选择2016年1月至2017年6月天津医科大学附属肿瘤医院收治的肿瘤患者99例,其中,肺癌27例,肝癌26例,结直肠癌19例,淋巴癌14例,胃癌13例。DVT的诊断以彩色多普勒检查阳性或经静脉造影确诊为标准,并依据诊断结果将肿瘤患者分成DVT组和对照组,其中DVT组47例,对照组52例。DVT组中,男性21例,女性26例,年龄(60.6±13.2)岁;对照组中,男性29例,女性23例,年龄(53.1±9.6)岁。入组标准:患者临床资料完整,理化检测结果完整。排除标准:既往有高血脂、糖尿病、肝硬化等可能影响血浆中D-D和Fbg水平的因素。本研究获得天津医科大学附属肿瘤医院伦理委员会批准,所有入组患者均签署知情同意书。
VIDAS D-Dimer Exclusion D-D排除试验试剂盒(法国bioMerieux公司),Fbg测定试剂盒(Clauss改进法)(日本Sysmex公司)。VIDAS全自动荧光免疫分析仪(法国bioMerieux公司),CA-7000全自动血凝分析仪(日本Sysmex公司)。
于清晨,采集DVT组和对照组患者的空腹静脉血3 ml,血液标本经枸橼酸钠抗凝,3 000 r/min离心10 min后分离血浆,并于血样采集2 h内完成检测分析。基于酶联免疫荧光法,使用全自动荧光免疫分析仪和D-D排除试验试剂盒,检测血样中D-D水平;基于凝固法,使用全自动凝血分析仪检测血样中的Fbg水平。所有血样的采集均在患者未接受抗凝治疗前进行,检测过程严格按照仪器操作规程操作。
采用SPSS 17.0统计学软件进行数据分析,对患者D-D和Fbg水平数据进行正态性检验,数据属于偏态分布资料。符合正态分布的计量数据均以均值±标准差(Mean±SD)表示。D-D和Fbg水平采用中位数和四分位数间距M(P25,P75)表示;采用Logistic回归模型分析D-D和Fbg的相关性;计量资料及计数资料组间比较分别采用非参数Mann-Whitney U检验分析和χ2检验;以P<0.05为差异有统计学意义。以受试者工作特征(receiver operating characteristic,ROC)曲线评估D-D、Fbg及两者联合对恶性肿瘤合并DVT的诊断价值。
DVT组和对照组的一般临床参数比较结果表明,其年龄差异有统计学意义(P<0.05),性别差异无统计学意义(P>0.05)。(表1)
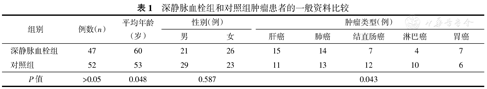
深静脉血栓组和对照组肿瘤患者的一般资料比较
深静脉血栓组和对照组肿瘤患者的一般资料比较
| 组别 | 例数(n) | 平均年龄(岁) | 性别(例) | 肿瘤类型(例) | |||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 肝癌 | 肺癌 | 结直肠癌 | 淋巴癌 | 胃癌 | |||
| 深静脉血栓组 | 47 | 60 | 21 | 26 | 15 | 14 | 7 | 4 | 7 |
| 对照组 | 52 | 53 | 29 | 23 | 11 | 13 | 12 | 10 | 6 |
| P值 | >0.05 | 0.048 | 0.587 | 0.043 | |||||
DVT组患者血浆中D-D和Fbg水平均明显高于对照组,差异有统计学意义(均P<0.01)。(表2、图1)
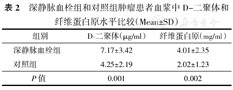
深静脉血栓组和对照组肿瘤患者血浆中D-二聚体和纤维蛋白原水平比较(Mean±SD)
深静脉血栓组和对照组肿瘤患者血浆中D-二聚体和纤维蛋白原水平比较(Mean±SD)
| 组别 | D-二聚体(μg/ml) | 纤维蛋白原(mg/ml) |
|---|---|---|
| 深静脉血栓组 | 7.17±3.42 | 4.01±2.35 |
| 对照组 | 4.25±2.19 | 2.02±1.23 |
| P值 | 0.001 | 0.002 |
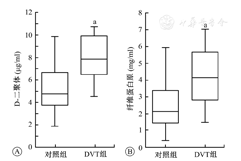

DVT—深静脉血栓。与对照组比较,aP<0.05
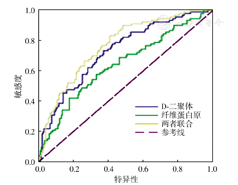
如表3所示,D-D、Fbg及Fbg+D-D诊断肿瘤合并DVT的ROC曲线下面积(area under curve,AUC)分别为0.642、0.728和0.764,三者特异性分别为62.50%、65.50%和59.00%,敏感性分别为58.80%、72.50%和83.30%。单项检测指标中,单D-D与Fbg+D-D诊断肿瘤合并DVT的AUC均大于0.7。
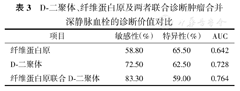
D-二聚体、纤维蛋白原及两者联合诊断肿瘤合并深静脉血栓的诊断价值对比
D-二聚体、纤维蛋白原及两者联合诊断肿瘤合并深静脉血栓的诊断价值对比
| 项目 | 敏感性(%) | 特异性(%) | AUC |
|---|---|---|---|
| 纤维蛋白原 | 58.80 | 65.50 | 0.642 |
| D-二聚体 | 72.50 | 62.50 | 0.728 |
| 纤维蛋白原联合D-二聚体 | 83.30 | 59.00 | 0.764 |
癌症是DVT的独立危险因素,癌症患者大多会有凝血参数异常,如血浆纤维蛋白相关的标记物(FRMs)增多、血小板(PLT)升高等。癌细胞及其产物可以直接与其他细胞(如PLT、内皮细胞)相互作用使血液呈高凝状态,此外,化学治疗会改变机体凝血物质水平,以上因素将导致机体预防DVT形成的功能降低。Benelhaj等[5]的研究结果表明,与非癌症患者相比,癌症患者血栓形成的风险高6~7倍,约20%新发DVT患者是肿瘤患者,尸检研究结果显示癌症患者静脉血栓栓塞率高达50%,有20%的恶性肿瘤患者会发展成癌相关血栓形成,尽管在晚期和化疗期间风险会增加,但超过50%的静脉血栓栓塞在诊断的前3个月内发生并干扰癌症的治疗。临床中对于癌症合并血栓形成患者通常采用低分子肝素抗凝治疗至少3个月,然而即使有最佳抗凝治疗,癌症患者静脉血栓形成的复发率仍高于非癌症静脉血栓患者,预后也更差[6]。但是并不是所有的肿瘤患者都要进行抗凝治疗,因此,评估恶性肿瘤患者血液是否处于高凝状态对于指导抗凝治疗非常重要,这是因为DVT患者临床症状和体征不典型,如患者血液已经处于高凝状态或有血栓形成的风险,将延误诊断及治疗,威胁患者生命安全。因此,降低肿瘤患者中DVT发生的关键在于早期诊断、预防和及时治疗[7]。Lauber等[8]的研究中提到高龄患者有较高的静脉血栓栓塞风险,65岁以上患者占急性静脉血栓栓塞患者的55%。本研究中DVT肿瘤患者组和对照组的平均年龄分别为60(35~76)岁和53(31~80)岁,DVT组肿瘤患者年龄高于对照组,差异具有统计学意义(P<0.05),表明年龄是DVT的危险因素。

D-D是当交联纤维蛋白被纤维蛋白溶解系统分解时释放到血液循环中的纤维蛋白衍生片段,稳定性好,是确定机体内有无继发性纤溶亢进以及是否存在血栓的分子标志物。当发生DVT时,凝血与纤维蛋白溶解系统的动态平衡被破坏,导致纤维蛋白降解产物(fibrinogen degradation products,FDP)增加,引起D-D升高。Schutte等[9]的研究结果表明,高水平的D-D与癌症有关,DVT患者中几乎有1/3患有癌症,D-D水平>20 μg/ml的患者癌症患病率超过40%。van Hylckama Vlieg等[10]运用Vidas®D-D检测方法检测患者血浆中D-D水平,其结果发现,D-D水平升高与血栓风险增加有关(OR:1.8~3.4)。本研究中DVT肿瘤患者组和对照组血浆中D-D水平分别为7.17 μg/ml和4.25 μg/ml,DVT组肿瘤患者血浆中D-D浓度明显高于非DVT组(P<0.01),肿瘤患者中发生DVT者血浆中D-D水平较高,这与上述研究结果相符。Fbg是由肝脏合成的,是对于血凝系统很重要的蛋白;Fbg的增加会引起血黏度升高,凝血因子活性增强,血小板激活,抗凝及纤溶活性降低从而加速血栓的形成[11]。Yetgin等[12]研究结果表明,Fbg水平升高是预测患者发生DVT的危险因素,其在血浆中水平增高提示患者易发生栓塞,本研究中DVT肿瘤患者组和对照组血浆中Fbg水平分别为4.01 mg/ml和2.02 mg/ml,DVT肿瘤患者的Fbg水平明显高于对照组(P<0.01),这与Yetgin等[12]的研究结果相符。此外,Sheth等[13]的研究结果表明,癌症类型、分期、肿瘤来源等因素均与DVT发生的风险有关,DVT发病率最高的是脑癌、肺癌、子宫癌、膀胱癌、胰腺癌、胃癌和肾癌,与未发生肿瘤转移的患者相比,肿瘤转移患者发生DVT风险增加4~13倍。不同类型肿瘤患者和肿瘤分期患者血浆中Fbg和D-D水平有差异,在Wang等[14]的研究中,早期(Ⅰ、Ⅱ)和晚期(Ⅲ/Ⅳ)期胰腺癌患者Fbg水平平均分别为(3.19±0.70)、(3.65±0.90)mg/ml(P=0.008);在Yamashita等[15]的研究结果中肝细胞癌患者血浆中D-D水平为14.9 μg/ml,肺癌患者为0.9 μg/ml;在李晓鸥等[16]的研究结果中乳腺癌和肝癌患者血浆D-D和Fbg水平明显高于非DVT对照组(P<0.05和P<0.01)。本研究中,DVT组与对照组在肿瘤类型上的差异有统计学意义(P<0.05),但是每种类型的肿瘤例数较少,难以得出可靠的结论。此外,本研究没有对不同肿瘤类型患者血浆中D-D和Fbg水平的诊断价值进行分析,肿瘤类型与D-D水平和Fbg水平以及肿瘤转移与DVT发生风险之间的关系还有待进一步研究。
通过进行ROC曲线分析发现,D-D水平用于诊断肿瘤患者发生DVT的AUC、特异性和敏感性分别为0.728、62.50%和72.50%,Fbg水平用于诊断肿瘤患者发生DVT的AUC、特异性和敏感性分别为0.642、65.50%和58.80%,但D-D和Fbg联合诊断肿瘤患者中DVT的AUC、灵敏度和特异度分别为0.764、83.30%和59.00%。肿瘤患者发生DVT后,预后较差,早期诊断DVT后能够指导临床正确用药。为尽量避免漏诊导致的危险后果,应最大限度提高诊断的敏感性,而将D-D和Fbg联合使用,诊断DVT的AUC和灵敏度都得到了明显的提高,用于诊断肿瘤患者中DVT的诊断价值高于单一指标检测。Yamashita等[15]的研究结果表明,D-D用于诊断肿瘤患者静脉血栓栓塞症的cut-off值为6.8 μg/ml,此时敏感性和特异性分别为79.5%和79.5%。李晓鸥等[16]根据ROC曲线得到,当血浆D-D的cut-off值为2.6 μg/ml时诊断肿瘤患者DVT最佳,此时敏感性75.9%、特异性75.9%、AUC=0.861;血浆Fbg用于诊断肿瘤患者DVT的临界值为6.3 mg/ml,此时敏感性75.9%、特异性72.8%、AUC=0.793。而席少枝等[17]的研究结果表明以Fbg>4 g/L为界,Fbg可以作为诊断DVT的指标,敏感性和特异性分别是89.29%和56.63%。在本研究中,D-D检测试剂盒的测定范围为45~10 000 ng/ml,对于D-D>10 μg/ml的血样,将结果记录为10 μg/ml,并未进一步进行稀释,在一定程度上影响统计结果,如果进一步得出准确数值,D-D及D-D+Fbg联合使用的诊断价值可能会进一步增强。
据统计,首发DVT的发病率为1~3人/年,复发的风险很高,12%~30%的患者5年内会发生复发[10],D-D水平还与首发血栓和复发血栓有关,DVT复发率男性高于女性(8.6%∶2.2%,P=0.04)[18]。Bjøri等[19]在研究首次DVT诊断时D-D水平与复发性DVT风险的关系中得出,首次诊断DVT时血浆D-D≤1.5 μg/ml的患者比D-D>1.5 μg/ml(HR:0.46;95%CI:0.25~0.82)的患者复发风险低54%。Sun等[20]的研究显示,血浆D-D水平(HR:1.71;95%CI:1.07~2.73;P=0.025)被确定为显著的独立预后预测因子;Fbg水平是患者的独立预后参数[16]。Yamashita等[15]的研究结果表明,血栓形成患者30 d死亡率和90 d死亡率分别为19.4%和27.6%,无血栓患者30 d死亡率和90 d死亡率分别为3.5%和8.5%,有血栓患者与无血栓患者之间差异有统计学意义(P<0.01);90 d后死亡者血浆中D-D水平、FDP水平均明显高于90 d存活者(P<0.01),血栓形成的患者死亡率更高。对于本研究而言,样本总例数和各部分样本的例数均较少,缺乏治疗前后D-D和Fbg检测结果的比较。虽然目前也有D-D和Fbg联合使用用于诊断血栓性疾病的相关研究,但关于两个指标用于肿瘤患者发生DVT早期诊断价值的研究还很少,而血栓对于肿瘤患者的危害极大,因此联合血栓相关分子水平和影像学结果并在未来实现对肿瘤中发生DVT者的个体化治疗、监控病情和进行预后的判断有重要意义。D-D和Fbg联合检测是一种安全、相对无创、操作简便快捷、经济实惠的肿瘤患者中DVT的诊断方法。目前DVT的诊断指标还有蛋白C(PC)、可溶性纤维蛋白(SF)和血管性血友病因子抗原(vWF:Ag)等,未来的研究中将联合多个与DVT发生相关的凝血指标进行统计分析,希望能够最大限度提高诊断价值。
单独检测肿瘤患者血浆中Fbg水平用于诊断肿瘤患者发生DVT的敏感性较差,D-D的诊断价值略优于Fbg,但是当两项指标联合使用时,较单一指标的诊断价值有所提高。未来的研究方向是进一步测量每种肿瘤类型中血栓相关分子水平,比较不同肿瘤类型间该生物标志物的差别,探讨出合适的血栓相关标记物的组合用于DVT的诊断。此外,还应进一步加大样本量,更确切地研究肿瘤类型、转移、分期以及预后与血凝标志物水平之间的相关性,从而可以实现对肿瘤患者中发生DVT的早期诊断,降低肿瘤患者DVT的发病率和死亡率。
所有作者均声明不存在利益冲突



























