
本文报道了1例羊膜带综合征(amniotic band syndrome, ABS)病例。该例孕妇于孕22周+4胎儿系统超声提示未见明显异常,孕30周时,B超发现羊水过多,胎儿水肿可能,收住南京医科大学第一附属医院治疗。入院后予控制血糖,行羊水减量术,B超动态监测羊水指数,每日胎心监护。孕32周起,孕妇出现胎动进行性减少,胎心监护渐呈正弦波样改变;孕32周+3时因胎儿窘迫行急诊剖宫产终止妊娠,术中发现脐带的胎盘插入部见片状羊膜自该处延续至胎儿左下肢近踝部皮肤,羊膜分离呈多孔状,新生儿左踝部可见明显带状缩窄环,左足水肿明显,确诊ABS。该羊膜带对胎儿左足影响较为直接,脐带的胎盘插入部附近的片状羊膜对胎儿是否存在影响尚无足够证据。该早产儿于出生24 h后因"新生儿窒息"死亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
孕妇,28岁,孕2产1。末次月经2017年10月12日。2018年5月10日,孕30周因"B超发现羊水过多"收入南京医科大学第一附属医院产科。否认早孕期风疹病毒感染史、放射线及有毒物质接触史,孕17周行无创产前检测(non-invasive prenatal testing, NIPT)提示低风险,孕22周+4胎儿系统超声提示未见明显异常。孕27周B超提示羊水过多,羊水深度83 mm,之后多次复查B超均提示羊水过多。2018年5月10日孕30周B超提示羊水指数371 mm,胎儿头颅皮肤稍增厚,厚度6.1 mm。患者曾于2008年孕32周+因"胎儿窘迫"行剖宫产,新生儿死亡,死因不详。
体格检查:心肺检查未见异常。产科检查:宫高35 cm,腹围99 cm,左枕前胎位,胎心率140次/min。初步诊断:孕30周左枕前待产,羊水过多,瘢痕子宫,胎儿水肿。
入院后完善相关检查,空腹血糖波动于5.7~8.8 mmol/L,餐后2 h血糖波动于7.3~9.6 mmol/L,其余检查无明显异常。临床予补充诊断:妊娠期糖尿病。予控制饮食后,空腹血糖降至正常,餐后2 h血糖波动于5.3~6.8 mmol/L。孕31周+2行胎儿头颅MRI检查示:胎儿头皮及颈背部软组织水肿,胎儿双侧脑沟、脑回部分出现,较相应孕周脑沟回显少,胎儿左侧侧脑室饱满。B超动态监测羊水指数呈进行性增长,羊水指数波动于322~465 mm。孕30周+5时,因羊水过多行羊膜腔穿刺并羊水减量术,同时行羊水基因拷贝数变异(copy number variations, CNVs)检测,注射地塞米松10 mg促进胎肺成熟。结果显示,未检出染色体非整倍体或100 kb以上已知的、明确致病的基因组CNVs。
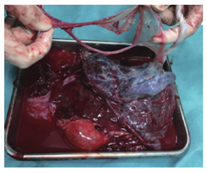
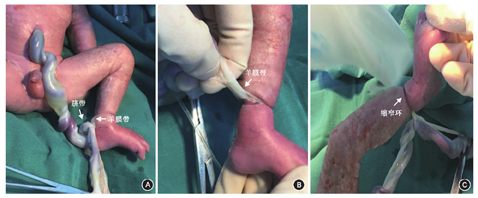
5月17日孕31周B超显示,羊水指数322 mm;孕31周+2羊水指数465 mm;31周+4羊水指数389 mm,羊水内见多个条絮状光带。孕32周时孕妇自觉胎动渐进性减少,B超示羊水深度147 mm,羊水指数433 mm,宫腔上段见多处条状光带漂浮于羊水中。患者与家属要求继续待产观察。孕32周+3时患者自觉胎动进一步减少,胎心监护呈正弦样波形。考虑"胎儿窘迫"存在,胎儿严重畸形不能排除,新生儿不良预后可能性大,孕妇及家属对胎儿期望极高,并坚决要求行剖宫产终止妊娠、积极抢救新生儿。孕32周+3行紧急剖宫产术。术中见羊水量约4 000 ml,娩出一男婴,体重1 580 g,早产儿头部及颈部水肿,出生时氧饱和度测不出,心率78次/min,予气管插管、气管内给药1∶10 000肾上腺素2 ml后转入新生儿科。生后1、5、10 min Apgar评分分别为2分(心率+1,皮肤颜色+1)、2分(心率+1,皮肤颜色+1)、3分(心率+2,皮肤颜色+1),转入新生儿重症监护病房(neonatal intensive care unit, NICU)。胎盘胎膜自然娩出,脐带的胎盘插入部见片状羊膜自该处延续至胎儿左下肢近踝部皮肤,羊膜分离呈多孔状(图1)。新生儿左踝部可见明显带状缩窄环,左足水肿明显(图2)。诊断为羊膜带综合征(amniotic band syndrome, ABS)。


患儿转入NICU,积极抢救,胸部X射线片提示双侧气胸,给予双侧胸腔闭式引流,左肺复张,右肺始终复张不全。患儿反复出现心率、血氧饱和度下降,反复予胸外按压、肾上腺素静脉推注、扩容、纠正酸中毒等对症处理,患儿心率、血压、血氧仍难以维持。出生24 h后,患儿仍无明显生存迹象,家长放弃抢救。患儿因"新生儿窒息"死亡。
ABS是指与羊膜带相关的一组高度变异的先天性复合畸形,胎儿受累器官可出现分裂或发育畸形,常见于头部、躯干和四肢,导致胎儿变形或肢体截断。ABS呈散发,与胎儿性别无关。据文献报道,ABS在活产儿中的发病率为1/15 000~1/1 200[1]。ABS导致流产、早产及死产的发生风险增加,而自发性流产的发生率可高达178/10 000[2],死产中的发生率约为1/56[3]。ABS发生时间越早,胎儿畸形越明显,预后越差[4]。
ABS确切的发病机制尚不明确,目前主要有血管论、内因论和外因论等3种理论。本例行羊水CNVs检查,提示胎儿染色体未见异常。从发生原因上分析,暂不支持基于血管病变/破裂的血管论及基于遗传物质突变的内因论。1965年,Torpin[5]提出外因论观点,即羊膜早破假说,早孕时羊膜破裂,绒毛膜完整,导致从羊膜的绒毛侧形成多条松散的中胚层链,即羊膜带,可黏附和/或缠住胚胎或胚盘。本例新生儿,片状羊膜自脐根部延续至左下肢近踝部皮肤,左踝部有明显的带状缩窄环,该表现与外因论观点相似。根据外因论观点,无论医源性或自发性的羊膜破裂,导致羊水外渗,都有可能造成羊水减少。ABS的超声表现之一为羊水过少[6]。但本例并未出现羊水过少的表现。孕27周时发现羊水过多,且羊水持续增多。剖宫产术中见到羊水量约4 000 ml。可能原因为:(1)患者血糖控制不佳;(2)羊膜自胎盘的脐带插入部附近羊膜分离,呈多孔状,有片状羊膜延伸至胎儿左足部,无效羊膜面积增大,影响羊膜与羊水之间的交换功能;(3)孕期胎儿头颅MRI检查提示:胎儿脑皮层发育较相应孕周脑沟回显少,不排除胎儿神经系统发育异常可能;(4)尽管本例孕期胎儿系统超声提示未见异常,但并不能排除食管、十二指肠闭锁等可能在孕晚期才出现的消化道畸形[7]。由于新生儿死亡后未行进一步尸检,故无法证实该患儿是否合并上述异常。
羊膜带发生的位置导致ABS可出现不同临床表型,分为肢体型、颅面型和躯干内脏型[8]。ABS临床表现差异很大,单一的轻度肢体异常往往预后良好,而合并头颅、脊柱和躯干方面的严重异常与胎儿或新生儿死亡密切相关[9]。本例患儿外在表型为肢体型,但是预后极差,考虑为以下两方面原因所致:(1)胎儿娩出后,可见明显的羊膜带缠绕胎儿左下肢形成缩窄环,并延续至脐带根部,压迫脐带,阻碍脐带血流,与胎儿缺血缺氧密切相关。文献报道,ABS导致死胎的主要原因是脐带因素[10]。(2)新生儿在NICU抢救过程中,双侧气胸考虑与出生抢救时气管插管有关,予引流后,左肺复张,右肺始终复张不全。研究表明,ABS患儿可能存在肺发育异常[8]。本例中胎儿外在表型为肢体型,表现为左下肢缩窄环,亦不排除同时存在肺发育异常,直接影响复苏效果,与新生儿死亡有关。
ABS的诊断目前主要依靠B超检查,而准确、及时发现及诊断ABS,对临床选择治疗方案及改善疾病预后具有重要意义。当超声发现宫腔内强回声光带时,首先要与羊膜片、宫腔黏连带、子宫纵隔、轮状胎盘、双胎羊膜隔等进行鉴别诊断,并关注其与胎儿躯体之间有无明确关系,胎动后光带的变化,注意脐血流值的变化,排除胎儿肢体或其他器官的畸形,提高产前超声诊断ABS的灵敏度[11]。ABS孕期超声漏诊率高,尤其是肢体畸形,漏诊率可达53.5%[12]。本例孕期多次B超检查均未见宫内异常带状回声,直至羊水减量术后第6天,即孕31周+4时B超检查才提示宫腔内絮状强回声,孕32周复查B超显示宫腔上段强回声光带,但是当时未能仔细辨别光带与胎儿肢体之间的关系。胎儿娩出后,再次回顾孕32周的B超检查结果发现,光带的位置与胎儿左足部所对应的位置相吻合。本例患儿出生后ABS诊断明确,但产前超声漏诊。考虑可能有以下原因:(1)羊水过多,减弱探头透过羊水的声场,影响对胎儿结构特别是颜面及肢体畸形的观察和诊断,导致漏诊;(2)表观畸形较轻微,本例只表现为肢体远端的缩窄环,易漏诊;(3)临床及超声医师对此类疾病认识的局限。随着影像技术的进步,目前孕期三维超声或MRI可以提供更详细的信息,是有效的辅助诊断技术[13],有助于明确诊断ABS。
若ABS发生于颅面部、脏器等处,导致严重畸形,目前尚无可靠的治疗方法。若只是发生在肢体的轻微畸形,可在出生后予以手术松解缩窄环并进行功能锻炼来纠正;若肢体畸形严重,存在"截肢"畸形可能,则可以通过行宫内外科手术来纠正,即胎儿镜下松解羊膜带,以避免羊膜带黏连或缠绕胎儿肢体引起宫内"截肢",且可避免束带缠绕脐带引起胎死宫内的发生[14,15]。
综上,ABS发病率低,确切发病机制不详,但对胎儿危害极大,临床医师要加强对本病的认识,若能早期发现,对于表现为肢体型的畸形,临床上有望通过胎儿镜进行宫内治疗,改善胎儿预后。



























