
多囊卵巢综合征(PCOS)病因不明,与胰岛素抵抗和高胰岛素血症密切相关。因不同人群临床表现存在高度异质性,故PCOS诊断标准尚存在争议,因而PCOS生物标志物成为研究热点。PCOS治疗包括调节生活方式,改善代谢紊乱、高雄激素血症以及生殖异常。本文综述了PCOS发病特点、诊断标准及治疗方式的最新进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄期妇女常见的内分泌代谢紊乱疾病之一,发病率约5%~10%,占不排卵不孕症的30%~60%,以闭经或月经紊乱、不孕、多毛、痤疮和双侧卵巢呈多囊样改变为主要临床表现[1]。
我国一项大型基层流行病学调查显示,育龄期女性PCOS的患病率为5.6%,其中约85%存在高雄激素血症或相关临床症状,81%存在卵巢多囊样改变(polycystic ovarian morphology,PCOM),月经紊乱和不孕分别占47.2%和6.4%,并按其临床表现进行亚型分型(表1)[2]。

我国多囊卵巢综合征亚型分型及其发病率[2]
PCOS病因不明,目前研究认为主要有下丘脑-垂体-卵巢轴调节功能紊乱、高雄激素血症和胰岛素抵抗(insulin resistance, IR)等机制产生影响(图1)[3]。
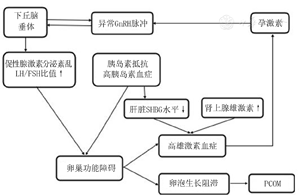
IR在PCOS发病机制中占重要地位,与肥胖、糖尿病、血脂异常等多种代谢相关疾病关系密切。PCOS患者中约60%存在IR,约50%~75%存在肥胖,其中肥胖PCOS患者高胰岛素血症发生率约75%,而非肥胖患者也高达30%[4]。我国社区PCOS人群调查结果显示,PCOS肥胖患病率为34.1%,代谢综合征患病率为26.8%,且内脏脂肪增多的正常体重患者发生代谢紊乱比例明显升高[2]。近期国内一项纳入426例PCOS患者的病例研究发现,PCOS合并糖耐量异常发生率约20.9%,2型糖尿病发病率约2.8%,而欧美国家的数据显示每年约2%的PCOS患者会新发展为糖尿病,发病风险较正常人增加5~10倍[5,6]。同时,肥胖、高脂血症、血管慢性炎症以及口服避孕药等高危因素使PCOS女性发生高血压、心肌梗死、动脉粥样硬化等心血管事件风险高达正常人的1.6倍[7]。最新研究报道,PCOS女性的同胞及父母发生IR代谢相关疾病及心脑血管疾病的风险也明显升高[8],提示了PCOS发病与基因相关。
不论是胰岛素抵抗还是卵巢改变都会对PCOS患者的生殖功能造成重大影响,国外研究报道PCOS患者中不孕症高达60%~70%,不孕及产科并发症的比例是正常女性的15倍;且子宫内膜癌和卵巢癌的风险明显增加[9]。因此鉴于多囊卵巢综合征这个名称仅代表了卵巢多囊的形态学特征,并没有真正涵盖这个疾病临床表现多变、致病机制复杂的本质,2016年6月,美国国立卫生研究院(NIH)决定将其更名为代谢生殖异常综合征(MRS)。
近30年来,因PCOS病因不明及其临床表现的高度异质性,PCOS诊断一直存在争议。2003年出台的鹿特丹标准[10]是目前全球应用最广的诊断标准:(1)稀发排卵或无排卵。(2)高雄激素的临床和(或)生化征象。(3) PCOM。符合以上3项中的2项,并排除其他相关疾病可诊断。但鹿特丹标准未细化使用何种指标诊断高雄激素血症和界定高雄激素临床表现,也未指明PCOS患者合并多种代谢并发症的诊治流程。
2018年1月,中华医学会妇产科学分会专家组结合我国PCOS人群特点(高雄激素表型较轻、合并代谢综合征比率高、体重指数较低)及临床经验制定了国内最新的PCOS指南[11],首次提出,青春期女性下丘脑-垂体-卵巢轴尚处于发育阶段,月经初潮后2年内激素分泌不符合成人模式,而经腹部超声不能完全反映卵巢形态,因而青春期PCOS诊断需同时满足以下3条:(1)初潮后月经稀发持续至少2年或闭经;(2)高雄激素临床表现或高雄激素血症;(3) PCOM。2018年同期,由中国医师协会内分泌分会制定的《PCOS内分泌专家共识》[12],全面阐述了PCOS患者胰岛素抵抗评估方法并提出PCOS代谢综合征诊断标准,为临床医生评估PCOS代谢紊乱提供重要依据。
2018年2月,由国际PCOS网络与美国生殖医学协会(ASRM)和欧洲人类生殖和胚胎学协会(ESHRE)联合制定了针对PCOS评估和管理的循证指南[13],提出(1) PCOS的诊断应首先对月经紊乱和高雄激素表现进行评估,当临床表现不明确时再进行生化或超声检查。(2)超声检查不应用于月经初潮8年以内的青春期PCOS的诊断,因为在此期间"多卵泡卵巢"发生率较高。(3)随着超声技术的进步,诊断任何一侧卵巢呈PCOM改变的阈值是一侧卵巢内卵泡数≥20或一侧卵巢体积≥10 ml,并确保卵巢内无黄体、囊肿或优势卵泡的存在。以往的PCOS诊断标准多基于专家共识,该国际循证指南首次根据世界范围内的循证医学证据,重点阐述了PCOS的筛查、风险评估、临床管理及生殖助孕等一系列问题,达166条推荐意见和实践要点,对全球PCOS的循证治疗具有重要意义。
Irisin是一种新型的肌细胞因子,在白色脂肪呈棕色化、减少能量消耗、改善糖耐量中起重要作用。2015年,本课题组首次发现在超重[体重指数(BMI)≥25 kg/m2]和PCOS患者血清中Irisin水平明显高于正常人,经6个月的二甲双胍治疗后PCOS患者血清Irisin水平显著降低,可能与改善IR相关,提示Irisin是评估PCOS患者IR的重要标志物[14]。本课题组最新一项临床研究显示,血清Irisin水平与高雄激素血症密切相关,PCOS亚型中包含高雄激素症的患者较其他亚型筛查Irisin水平意义更大,将为临床开展PCOS筛查项目提供重要依据[15]。近年有学者通过检测卵泡中Irisin水平发现其还可能参与调控卵母细胞的发育和受精[16],Irisin对PCOS女性代谢与生殖的影响值得深入探究。
中国人内脏脂肪指数(Chinese visceral adiposity index,CVAI)作为一种新的腹型肥胖预测指标,由年龄、腰围、BMI、三酰甘油、高密度脂蛋白组成。本课题组最新一项纳入537名育龄期女性(含387例PCOS患者)的临床研究显示[17],CVAI与胰岛素敏感指数(M值)呈强负相关(r=-0.695 3, P<0.000 1),对IR的诊断(约登指数71%)明显优于BMI、内脏脂肪指数(VAI)、脂质蓄积产物(LAP)、稳态模型评估的胰岛素抵抗指数(HOMA-IR)等指标,提示CVAI可替代高胰岛素-正葡萄糖钳夹成为识别中国育龄期PCOS女性IR的敏感指标之一。
本课题组还研究了PCOS女性血清锌-α2-糖蛋白(Zinc-α 2-glycoprote,ZAG)、脂联素(adiponectin,ADI)的变化,发现ZAG与PCOS独立相关,诊断PCOS的切点值约42.6 mg/L,且血清ZAG水平越高的PCOS患者并发代谢综合征、糖耐量异常、PCOM的风险越低[18]。本课题组观察到ADI指数[ADI/(空腹血糖×空腹胰岛素)]在PCOS患者中明显降低,分析了ADI指数诊断IR的切点值为0.67(灵敏度为89.4%,特异度为88.1%)[19],提示这类PCOS标志物相较正葡萄糖钳夹试验、糖耐量试验等常规评估IR的方法更简便易行,但仍需大量研究为其临床推广提供证据。
PCOS也被认为是一种受多因素影响的遗传相关性疾病,我国在PCOS的全基因组关联分析研究(genome wide association study,GWAS)方面也取得重大进展,先后发现多个与中国PCOS女性病理相关的易感位点,如GnRHR基因、FSHR基因、IR/IRS基因和FTO基因[20]。最新发现的与PCOS患者LH升高有关的SOD2 A16V基因以及首次发现与中国女性PCOS发病风险显著相关的ESR1 rs1999805和PPARG rs709154基因位点,有望为PCOS的精准诊疗提供证据[21,22]。但有关GWAS发现的易感基因与PCOS临床表型的关系及具体信号通路如何仍不清楚,还需在不同种族及大规模人群中验证。
对肥胖或非肥胖PCOS患者均应提倡健康饮食,坚持锻炼,以控制体重。最新的meta分析结果显示,生活方式的干预不仅可以改善PCOS患者的血脂、血压、空腹胰岛素水平,还能调整月经周期,改善排卵率和妊娠率[23]。但如何保持合理、稳定、长期的减重以及对目标体重的维持仍是一大难题,需从饮食、运动、精神心理等多方面协同制订个体化的减重方案。国际循证指南提出,应重视对PCOS患者心理健康的关注,建议从生活质量、抑郁和焦虑、性心理功能、进食障碍和饮食紊乱和生活形象等5个方面进行评估,全面提高患者远期生活质量[13]。
目前二甲双胍一直作为治疗PCOS患者代谢紊乱的一线药物。本课题组曾观察到给予PCOS患者二甲双胍(850 mg,bid)治疗6个月后BMI、体脂含量、空腹胰岛素、空腹血糖、HOMA-IR、雄激素水平均下降,提示二甲双胍可有效改善PCOS患者的代谢紊乱[14]。最近研究证实二甲双胍对肥胖或非肥胖PCOS患者的IR均有改善作用[24]。
近年来发现二甲双胍也有促排卵作用。有研究报道单用二甲双胍可提高PCOS患者的排卵率,且在诱导排卵前加用二甲双胍可使排卵率提高1.6倍[25]。发表在《柳叶刀》子刊上的最新研究显示,妊娠期PCOS女性服用二甲双胍或可降低孕晚期流产和早产的风险,PregMet2研究显示二甲双胍组的238例女性中发生晚期流产和早产的孕妇为12例(5%),而在安慰剂组的240名女性中为23名(10%),但妊娠期糖尿病、妊娠期高血压的发病率无明显差异[26]。挪威研究人员随访了182名儿童,母体二甲双胍暴露组儿童的体重和体重指数从6个月开始增加至4岁,超重或肥胖的风险较对照组儿童高近2倍,可能与二甲双胍具有潜在抑制线粒体活性和导致相对营养限制的功能,会对胎盘组织分化和胎儿生长产生不良影响有关[27]。因此孕期使用二甲双胍可能使母体获益,但对于胎儿和后代的影响还需要进一步的研究。
噻唑烷二酮类(thiazolidinediones,TZDs)药物能显著改善PCOS患者的代谢紊乱,可以作为对二甲双胍耐药或胃肠道不良反应严重时的优选药物。最新一项纳入643例PCOS患者的meta分析报道,与二甲双胍相比,吡格列酮改善PCOS患者空腹胰岛素水平和IR的能力更强,改善月经紊乱和排卵率的效果更佳,但有体重增加的风险[28]。同样有回顾性研究报道,在口服二甲双胍和抗雄激素药物的基础上加用吡格列酮能显著改善PCOS患者的IR、血脂异常、血清睾酮水平、慢性炎症状态以及非酒精性脂肪肝(NAFLD)的发生率[29]。但TZDs药物对PCOS患者的远期疗效以及对胎儿的影响有待进一步观察与研究。
有关阿卡波糖(acarbose)在PCOS治疗中的作用研究较少,其改善PCOS患者IR效果尚存在争议。曾有临床研究报道二甲双胍组(2 550 mg/d)较阿卡波糖组(300 mg/d)在改善排卵率和IR效果方面更优,而阿卡波糖组降低雄激素水平更强[30],但因存在其胃肠道胀气等不良反应,故在年轻PCOS女性中不受青睐。
胰升糖素样肽1(glucagon-like peptide-1, GLP-1)受体激动剂类降糖药物如利拉鲁肽、艾塞那肽,能显著改善胰岛素分泌功能,降低体重。本课题组最新研究发现,艾塞那肽能促进支链氨基酸和芳香族氨基酸的降解代谢,增加类固醇和胆汁酸的生物合成,改善脂质氧化和减轻氧化应激,有效调节PCOS患者的代谢紊乱[31]。一项针对肥胖PCOS患者的为期3个月的随机对照研究显示,利拉鲁肽(3 mg,qd)单药治疗减少体重和腰围效果更明显,而利拉鲁肽(1.2 mg,qd)+二甲双胍(1 000 mg,bid)联合组改善IR和雄激素水平能力更强,并且胃肠道不良反应更小[32],或许中剂量GLP-1受体激动剂联合二甲双胍治疗PCOS效益更佳。最新的meta分析显示,PCOS患者短期应用利拉鲁肽和艾塞那肽单药治疗均能有效降低BMI和血清睾酮水平,并能改善月经周期和排卵率,是肥胖PCOS患者的优选药物[33]。同时,GLP-1受体激动剂周制剂的上市,将会为PCOS的治疗提供又一选择。
至于其他药物,近年来也有报道在二甲双胍耐药的肥胖PCOS患者中,加用西格列汀可改善胰岛β细胞功能并降低糖尿病的发病率[34]。但二肽基肽酶4(DPP-4)抑制剂单独使用是否对PCOS患者有效还有待进一步证实。我国近期一项纳入240例超重或肥胖PCOS患者的随机对照研究显示,奥利司他组在减重和改善血脂紊乱方面较二甲双胍组效果更佳,但两者对于血清睾酮水平的影响及IR的改善未见统计学差异[35]。近年也有学者提出肌醇有望加入PCOS一线治疗队伍,卵泡液中肌肉肌醇(MI)可改善卵泡质量,调节月经紊乱,D-手性肌醇(DCI)可显著改善外周胰岛素水平,MI和DCI以生理剂量按40∶1配比治疗PCOS效果显著[36]。
对于青春期或无生育要求,以月经紊乱、高雄激素血症为主的女性,最新指南推荐复方短效口服避孕药(short-acting combined oral contraceptive, COC)为首选治疗方案。有研究报道1年的COC联合螺内酯治疗能使血清雄激素水平降低50%,明显改善多毛、痤疮、月经紊乱等症状,并对子宫内膜有保护作用[37]。对于有生育要求的PCOS女性,指南目前仍推荐克罗米芬或来曲唑作为一线促排卵药物,在改善代谢紊乱的前提下促排卵效果更佳。最新研究报道,来曲唑耐药时加用二甲双胍和肌醇均能提高妊娠率,且肥胖PCOS女性对二甲双胍获益更大[38]。药物效果不佳时还可选择手术治疗,如腹腔镜下卵巢电凝打孔术、卵巢楔形切除术,但对储存卵泡有不可逆损伤,宜权衡利弊后选择个体化方案。
随着生活水平的提高,PCOS发病率逐年上升,其表现出的代谢和生殖紊乱严重威胁女性的健康。全球范围内对PCOS的诊断尚需进一步探讨和统一,对PCOS生物标志物,尤其评估IR的新指标还需更深入研究,以便于临床应用。PCOS治疗应当在调节生活方式的基础上根据患者特点选择个体化方案。对于无生育需求的PCOS患者,改善胰岛素抵抗与调节月经治疗可双管齐下;对于有生育要求的患者在改善胰岛素抵抗的前提下助孕效果更佳。过去的10年,我国已在PCOS的表型特征、诊断依据和临床干预等多方面取得显著成果,未来期望能建立完善的PCOS基因型-表型关联模型,根据基因型对PCOS进行分类以实现早预防、早干预,并能有效避免远期并发症,提高PCOS患者生活质量。
所有作者均声明不存在利益冲突



























