
评估临床TNM(cTNM)分期判断病理TNM(pTNM)分期的准确性,探索胃癌新辅助化疗的潜在获益人群。
采用回顾性单臂队列研究。连续纳入2013年7月至2019年4月期间,北京大学肿瘤医院胃肠肿瘤中心一病区收治的确诊为胃腺癌、行开腹或腹腔镜D2胃癌根治手术治疗、且cTNM和pTNM确定的患者,排除术中淋巴结清扫数目<16枚、或既往行胃手术、或术前放化疗者。术前cTNM分期由影像科医生依据腹盆腔增强CT进行判读,术后pTNM分期来自患者术后病理报告结果。比较cTNM分期与pTNM分期的符合率并分析pⅠ期患者的cTNM分期情况,如cTNM分期组合对应pⅠ期比例<5%,则认为其是新辅助化疗的潜在获益人群。进一步研究临床特征与分期符合度之间的关系。
共459例患者纳入分析,男性321例(69.9%),女性138例(30.1%),平均年龄60(23~85)岁。cT分期与pT分期的符合率从T1~4期分别为82.5%(33/40)、31.1%(28/90)、34.4%(62/180)和55.0%(96/149)。cN分期与pN分期的符合率N0~3期分别为58.8%(134/228)、22.1%(19/86)、23.6%(26/110)和54.3%(19/35)。本研究中,现有分期手段对于淋巴结转移的敏感性和特异性分别为64.5%(171/265)和69.1%(134/194)。本组cT3~4患者中,对应pⅠ期比例为9.1%(30/329),对应pⅢ期的敏感性为94.8%(164/173);本组cT3~4+cN1~3患者中,对应pⅠ期比例为1.4%(3/218),对应pⅢ期患者的敏感性为76.9%(133/173)。肿瘤位置与cT/pT分期一致有关[胃食管结合部:64例(56.6%),胃上部:9例(9/17),胃中部:31例(40.3%),胃下部:97例(39.9%),全胃:4例(4/9),χ2=9.845,P=0.043],肿瘤分化程度与cN/pN分期一致有关[低分化:94例(42.3%),中分化:92例(41.1%),高分化:12例(12/13),χ2=13.261,P=0.001],差异均有统计学意义(均P<0.05)。
基于北京大学肿瘤医院单中心回顾性数据,胃癌新辅助化疗的潜在获益人群为cT3~4+N1~3期患者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
我国是胃癌高发地区,每年胃癌新发病例数约占全球的42.5%,其中70%为进展期胃癌[1]。由于进展期胃癌患者术后较高的复发率和转移率,单纯手术治疗仍难以达到理想效果,以手术联合化疗、放疗的围手术期综合治疗已成为全球共识。作为围手术期综合治疗的重要组成部分,新辅助化疗已被国际上各大指南所推荐,但其适应证人群的选择仍存在很大差异。2019版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,临床TNM(cTNM)分期≥T2(Nany)的患者应接受新辅助化疗[2];2016版欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南推荐,cTNM分期>T1N0的患者应接受新辅助化疗[3];而第5版日本胃癌治疗指南推荐,cTNM分期为T2~4且合并肿大淋巴结(Bulky N)的患者推荐新辅助化疗[4];2018版中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南推荐,cⅢ期的患者接受新辅助化疗[5]。
新辅助化疗的本质是化疗,理论上来说,所有需要行术后辅助化疗的患者都是新辅助化疗的适宜人群。但日本研究表明,cTNM分期与病理TNM(pTNM)分期符合率在25.1%~88.8%之间[6,7]。由于cTNM分期与pTNM分期符合率较低,若所有患者均推荐行新辅助化疗,部分患者会由于术前分期不准确,存在过度治疗的风险。而cTNM分期的准确性在现有条件下很难在短期内得到显著提高。因此,如何使更多患者从新辅助化疗中获益,并尽可能避免过度治疗的风险,显得尤为重要。
为解决这一问题,日本JCOG1302A研究提出,不同分期患者的分期准确性有显著差异,晚期患者很难在术前被错分为早期,因此该研究将这一问题转化为:哪些cTNM分期组合的患者术后病理Ⅰ期(pⅠ期)比例≤5%[7]。该研究经过前瞻性多中心研究发现,如果针对cT3~4+cN1~3组合的患者进行新辅助化疗,可以将pⅠ期(即过度治疗)的比例减少至6.5%。这实际上提出了现有诊断精度下新辅助化疗的适应证。但由于中国和日本胃癌分期比例存在差异,该结论并不能直接应用于国内临床工作。
为了在目前cTNM分期准确性的现状下,探索更适合国内胃癌患者新辅助化疗的适应证,本研究回顾性分析2013年7月至2019年4月期间,于北京大学肿瘤医院胃肠肿瘤中心一病区直接行手术治疗的胃癌病例的cTNM与pTNM的符合情况,了解目前cTNM分期的病理符合率,并探索如何在避免过度治疗风险的同时,让更多患者从术前治疗中获益。
本研究采用回顾性单臂队列研究。病例纳入标准:(1)胃镜及活检确诊为胃腺癌;(2)行开腹或腹腔镜D2胃癌根治手术;(3)术前行腹部增强CT,并经过多学科会诊确定cTNM分期;(4)术后存在pTNM分期;(5)无Ⅳ期因素。排除标准:(1)术中淋巴结清扫数目<16枚;(2)既往行胃手术或针对胃癌的放化疗。
根据上述标准,连续纳入2013年7月至2019年4月期间,于北京大学肿瘤医院胃肠外科一病区住院治疗、并符合纳入及排除标准的459例胃癌患者,其中男性321例(69.9%),女性138例(30.1%),平均年龄60(23~85)岁。所有患者均知情同意,本研究符合《赫尔辛基宣言》的要求。
本中心所有胃癌患者,术前均通过腹部增强CT、胃镜和(或)超声内镜等检查明确诊断,并在所有临床资料完备的前提下,于院前行多学科会诊(multidisciplinary team conference,MDT)。MDT团队包括胃肠外科、影像科、病理科、消化内科等,通过影像学检查结果得出患者cTNM分期,并依据cTNM分期与患者意愿拟定后续治疗方案。
腹部增强CT使用德国西门子64层螺旋CT,所有患者检查前均禁食6~8 h,扫描前服温水800~1 000 ml,患者取仰卧位。扫描范围:动脉期及静脉期由食管下段至双肾下级水平。平衡期扫描范围由膈顶至盆腔,于吸气末屏气一次完成。增强扫描选用80~100 ml非离子对比剂碘普罗胺(优维显,U1.travist,拜耳医药保健有限公司)300 mgI/ml经高压注射器经肘静脉注入,注入速率3.0 ml/s,动脉期、静脉期、平衡期分别选用注射后30~35 s、50~60 s、100~120 s。将扫描后原始数据进行5 mm薄层重建,层间距为5 mm。
TNM分期均参考第8版胃癌TNM分期及日本胃癌学会制定的《胃癌处理规约》第15版的相关定义[8,9]。
cTNM分期包括肿瘤局部浸润深度(cT分期)和淋巴结转移情况(cN分期),由影像科医生在MDT会诊讨论中现场阅片得出结论并记录。cT分期来自腹部增强CT结果,由院前MDT会诊中,通过高年资影像科医生根据患者1个月内本院腹部增强CT结果对患者肿瘤局部浸润情况作出判断;cN分期中对于转移淋巴结的定义为:腹部增强CT上可见淋巴引流区域的短轴≥8 mm或长轴≥10 mm的类圆形占位,记录其大小和分组。pTNM分期来自患者术后病理报告。
分析cTNM分期与pTNM分期的符合率(cTNM分期与pTNM分期一致例数/cTNM分期例数),以及pⅠ期患者的cTNM分期情况,归纳对应pⅠ期比例<5%的cTNM分期组合,并将该群体定义为胃癌新辅助化疗的潜在获益人群。进一步分析临床特征与cTNM/pTNM分期是否一致的关系。
采用SPSS 22.0统计软件包进行统计分析。经Kolmogorov-Smirnov检验,对符合正态分布的计量资料用 ±s表示,否则用中位数(范围)表示;分类变量用例数(%)表示,组间比较采用χ2检验;P<0.05表示差异有统计学意义。
±s表示,否则用中位数(范围)表示;分类变量用例数(%)表示,组间比较采用χ2检验;P<0.05表示差异有统计学意义。
在459例患者中,cT分期与pT分期的符合率从T1~4期分别为82.5%(33/40)、31.1%(28/90)、34.4%(62/180)和55.0%(96/149),见表1。有329例患者被诊断为cT3~4,其中术后病理确诊为pT1者34例(10.3%),pT2者48例(14.6%)。cN分期与pN分期的符合率N0~3期分别为58.8%(134/228)、22.1%(19/86)、23.6%(26/110)和54.3%(19/35),见表2。
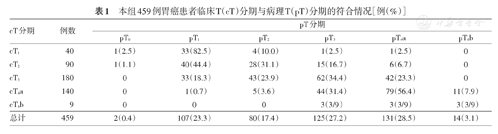
本组459例胃癌患者临床T(cT)分期与病理T(pT)分期的符合情况[例(%)]
本组459例胃癌患者临床T(cT)分期与病理T(pT)分期的符合情况[例(%)]
| cT分期 | 例数 | pT分期 | |||||
|---|---|---|---|---|---|---|---|
| pT0 | pT1 | pT2 | pT3 | pT4a | pT4b | ||
| cT1 | 40 | 1(2.5) | 33(82.5) | 4(10.0) | 1(2.5) | 1(2.5) | 0 |
| cT2 | 90 | 1(1.1) | 40(44.4) | 28(31.1) | 15(16.7) | 6(6.7) | 0 |
| cT3 | 180 | 0 | 33(18.3) | 43(23.9) | 62(34.4) | 42(23.3) | 0 |
| cT4a | 140 | 0 | 1(0.7) | 5(3.6) | 44(31.4) | 79(56.4) | 11(7.9) |
| cT4b | 9 | 0 | 0 | 0 | 3(3/9) | 3(3/9) | 3(3/9) |
| 总计 | 459 | 2(0.4) | 107(23.3) | 80(17.4) | 125(27.2) | 131(28.5) | 14(3.1) |
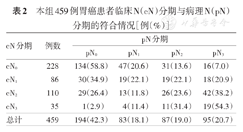
本组459例胃癌患者临床N(cN)分期与病理N(pN)分期的符合情况[例(%)]
本组459例胃癌患者临床N(cN)分期与病理N(pN)分期的符合情况[例(%)]
| cN分期 | 例数 | pN分期 | |||
|---|---|---|---|---|---|
| pN0 | pN1 | pN2 | pN3 | ||
| cN0 | 228 | 134(58.8) | 47(20.6) | 31(13.6) | 16(7.0) |
| cN1 | 86 | 30(34.9) | 19(22.1) | 19(22.1) | 18(20.9) |
| cN2 | 110 | 29(26.4) | 13(11.8) | 26(23.6) | 42(38.2) |
| cN3 | 35 | 1(2.9) | 4(11.4) | 11(31.4) | 19(54.3) |
| 总计 | 459 | 194(42.3) | 83(18.1) | 87(19.0) | 95(20.7) |
有231例(50.3%)患者术前诊断为淋巴结转移(cN1~3),其中171例为病理证实淋巴结转移(pN1~3),阳性预测值为74.0%(171/231);而228例患者术前诊断无淋巴结转移(cN0),其中134例术后病理证实淋巴结未见转移(pN0),阴性预测值为58.8%(134/228)。全组共有265例pN1~3患者和194例pN0患者,现有分期手段对于淋巴结转移的敏度性和特异性分别为64.5%(171/265)和69.1%(134/194)。本研究459例患者中,共13例(2.8%)患者术中发现腹腔灌洗细胞学阳性或腹膜转移。
本组共91例患者术后证实为pⅠ期。cT1N2、cT1N3、cT2N3、cT4bN0和cT4bN1这5种cTNM分期组合中,无pⅠ期的病例;cT2N2、cT3N1、cT3N2、cT3N3、cT4aN1、cT4aN2、cT4aN3、cT4bN2、cT4bN3这9种组合的对应的pⅠ期比例均<5%。见表3。
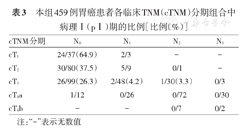
本组459例胃癌患者各临床TNM(cTNM)分期组合中病理Ⅰ(pⅠ)期的比例[比例(%)]
本组459例胃癌患者各临床TNM(cTNM)分期组合中病理Ⅰ(pⅠ)期的比例[比例(%)]
| cTNM分期 | N0 | N1 | N2 | N3 |
|---|---|---|---|---|
| cT1 | 24/37(64.9) | 2/3 | - | - |
| cT2 | 30/80(37.5) | 5/9 | 0/1 | - |
| cT3 | 26/99(26.3) | 2/48(4.2) | 1/30(3.3) | 0/3 |
| cT4a | 1/12 | 0/26 | 0/72 | 0/30 |
| cT4b | - | - | 0/7 | 0/2 |
注:"-"表示无数值
本组93.6%(308/329)cT3~4患者合并淋巴结转移。如选取cT3~4+cN1~3作为新辅助化疗的潜在适应证,其对应pⅠ期患者比例为1.4%(3/218),对应pⅢ期患者的敏感性为76.9%(133/173)。如选取cT3~4作为新辅助化疗的潜在适应证,其对应pⅠ期患者比例为9.1%(30/329),对应pⅢ期的敏感性为94.8%(164/173)。见表4。
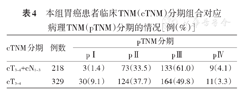
本组胃癌患者临床TNM(cTNM)分期组合对应病理TNM(pTNM)分期的情况[例(%)]
本组胃癌患者临床TNM(cTNM)分期组合对应病理TNM(pTNM)分期的情况[例(%)]
| cTNM分期 | 例数 | pTNM分期 | |||
|---|---|---|---|---|---|
| pⅠ | pⅡ | pⅢ | pⅣ | ||
| cT3~4+cN1~3 | 218 | 3(1.4) | 73(33.5) | 133(61.0) | 9(4.1) |
| cT3~4 | 329 | 30(9.1) | 124(37.7) | 164(49.8) | 11(3.3) |
本研究459例患者中,肿瘤位置与cT/pT分期一致有关(χ2=9.845,P=0.043),肿瘤分化程度与cN/pN分期一致有关(χ2=13.261,P=0.001),差异均有统计学意义。Lauren分型与cT/pT分期及cN/pN分期是否符合之间关系的差异无统计学意义(均P>0.05)。见表5。
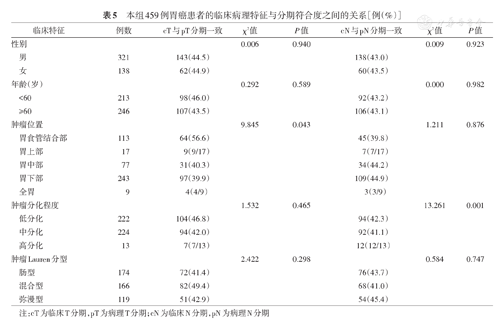
本组459例胃癌患者的临床病理特征与分期符合度之间的关系[例(%)]
本组459例胃癌患者的临床病理特征与分期符合度之间的关系[例(%)]
| 临床特征 | 例数 | cT与pT分期一致 | χ2值 | P值 | cN与pN分期一致 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 性别 | 0.006 | 0.940 | 0.009 | 0.923 | ||||
| 男 | 321 | 143(44.5) | 138(43.0) | |||||
| 女 | 138 | 62(44.9) | 60(43.5) | |||||
| 年龄(岁) | 0.292 | 0.589 | 0.000 | 0.982 | ||||
| <60 | 213 | 98(46.0) | 92(43.2) | |||||
| ≥60 | 246 | 107(43.5) | 106(43.1) | |||||
| 肿瘤位置 | 9.845 | 0.043 | 1.211 | 0.876 | ||||
| 胃食管结合部 | 113 | 64(56.6) | 45(39.8) | |||||
| 胃上部 | 17 | 9(9/17) | 7(7/17) | |||||
| 胃中部 | 77 | 31(40.3) | 34(44.2) | |||||
| 胃下部 | 243 | 97(39.9) | 109(44.9) | |||||
| 全胃 | 9 | 4(4/9) | 3(3/9) | |||||
| 肿瘤分化程度 | 1.532 | 0.465 | 13.261 | 0.001 | ||||
| 低分化 | 222 | 104(46.8) | 94(42.3) | |||||
| 中分化 | 224 | 94(42.0) | 92(41.1) | |||||
| 高分化 | 13 | 7(7/13) | 12(12/13) | |||||
| 肿瘤Lauren分型 | 2.422 | 0.298 | 0.584 | 0.747 | ||||
| 肠型 | 174 | 72(41.4) | 76(43.7) | |||||
| 混合型 | 166 | 82(49.4) | 68(41.0) | |||||
| 弥漫型 | 119 | 51(42.9) | 54(45.4) | |||||
注:cT为临床T分期,pT为病理T分期;cN为临床N分期,pN为病理N分期
围手术期综合治疗是目前局部进展期胃癌的标准治疗方案,但基于不同的临床研究结果,东西方对于新辅助化疗适应证人群的选择存在很大差异。这种差异既取决于东西方治疗模式的差异,也取决于东西方手术方式的差异。虽然ESMO和NCCN指南中推荐对于>T1N0的患者均行新辅助化疗,但是由于其循证医学证据基础是接受D1根治术患者的围手术期治疗的临床研究结果,因此难以直接应用于行D2根治术的胃癌人群。我们认为,相较于辅助化疗,新辅助化疗实际是将部分术后化疗挪至手术前,同时利用新辅助化疗依从性高,降低肿瘤分期,提高手术切除率的优点,使患者获益更多,因此任何一个需要术后辅助化疗的进展期胃癌患者都适宜接受新辅助化疗[10,11]。但由于现有影像学诊断手段的局限性,难以避免术前cTNM分期不准,导致部分早期胃癌患者接受不必要的新辅助化疗的可能。
日本JCOG1302A研究结果提出,也许可将现有诊断精度下新辅助化疗的适应证缩小到cT3~4+cN1~3组合[7]。这为新辅助化疗的潜在获益人群选择带来一些启示,但仍无法直接应用于临床。其根本原因在于,中国和日本早期胃癌和局部进展期胃癌的比例存在显著差异。日本早期胃癌的比例>50%,而我国早期胃癌的比例约为20%[12]。一方面,局部进展期胃癌比例的不同导致两国对于局部进展期胃癌诊断水平存在差异,以JCOG1302A研究为例,平均每个中心每月入组患者不足2例,这与国内各中心情况存在差异,一定程度上会影响进展期胃癌的诊断准确性,国内对于局部进展期胃癌诊断的准确性可能会相对更高。另一方面,在相同的分期准确性的前提下,早期胃癌在总人群所占比例不同也会影响基于cTNM分期的新辅助化疗患者的选择。比如总人群中,如果早期胃癌比例<5%,则接诊的任何一个患者均接受新辅助化疗,其过度治疗的风险也<5%。
因此,本研究通过回顾性分析2013年7月至2019年4月共459例直接行手术治疗的胃癌病例,发现相较于日本JCOG1302A研究,我们中心的cTNM分期准确性略优。考虑可能的原因有:(1)中国胃癌人群与日本胃癌人群有人数和分期上的明显差异,我国胃癌以进展期胃癌为主,且患者例数多,各临床中心对于进展期胃癌的诊治经验积累的更多,分期准确性可能受此影响;(2)JCOG1302A为多中心研究,该研究中共纳入53家机构,不同中心的胃癌术前诊断能力可能存在较大差别,可能对研究结果造成影响。
本研究为首个基于中国人群的、针对胃癌新辅助化疗潜在获益人群的研究。既往研究发现,超过70%的cT3~4患者合并有淋巴结转移[13];在本研究中这一比例为93.6%(308/329)。但如果因此将cT3~4作为新辅助化疗指征,尽管pⅢ期患者的敏感性可达到94.8%(164/173),这部分患者中pⅠ期的比例也高达9.1%(30/329),即在这种情况下会导致接近10%的患者接受过度治疗,因此并不是理想的选择。这一结论与JCOG1302A等研究相同[7]。现有分期手段主要通过CT评价胃周淋巴结的大小,尤其是短径,来判断淋巴结转移,这一诊断方法的准确率在54%~84%之间[14,15,16]。本研究中对于淋巴结转移的敏感性和特异性分别为64.5%(171/265)和69.1%(134/194),与之前的研究结果接近[6,17]。我们认为,现有手段对于胃癌淋巴结转移的诊断效能不足。同时,因CT诊断不同分组淋巴结转移的敏感性存在显著差异,或许对淋巴结进行分组记录、甚至在适应证选择中对不同分组淋巴结赋予不同权重并计算总值,是未来应用CT诊断淋巴结转移可能的方式[18]。本研究亚组分析中发现,CT对于分化程度高的胃癌淋巴结转移诊断准确性明显高于其他,这可能是由于高分化胃癌恶性程度低、局部浸润为主且病例数较少有关。而食管胃结合部癌及胃上部癌的T分期准确性更高,可能与该处胃壁较为固定、受胃体积膨胀的影响相对较小有关。
本研究为回顾性、单中心研究,病例数有限(459例),导致某些特定cTNM分期组合(如T1N1、T2N2)及部分特定肿瘤位置的病例数偏少。且本研究仅仅基于肿瘤分期,未考虑分子分型和基因的影响。未来仍需前瞻性多中心研究进行验证本研究结论。
综上,基于北京大学肿瘤医院单中心回顾性数据,cT3~4+cN1~3的患者中pⅠ期的比例为1.4%,可认为该人群为新辅助化疗的潜在获益人群。
所有作者均声明不存在利益冲突



























