
近年来十二指肠乳头肿瘤内镜下切除术日渐成熟,但存在较高风险,术后有肿瘤残留,且术后并发症发生率或复发率较高,是否追加外科手术仍存在争议。现报道1例行改良十二指肠乳头肿瘤内镜下切除术患者,术前通过超声胃镜评估有无胆胰管内生性生长,术中于胆胰管内放置鼻胆引流管改造的长支架预防术后并发症,术后根据病理结果组织多学科讨论,旨在为十二指肠乳头肿瘤的规范化治疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
十二指肠乳头肿瘤发病率低,早期可无症状,随着瘤体增大可出现梗阻性黄疸、反复胰腺炎发作等症状,并存在恶变倾向。以往治疗以外科手术为主,近年来随着内镜技术的发展,有选择地内镜下切除十二指肠乳头肿瘤成为可能[1,2,3]。然而,目前对十二指肠乳头肿瘤的治疗策略尚存在争议[4]。本病例为十二指肠乳头肿瘤患者,内镜下切除术后根据病理结果,组织多学科讨论,探讨其诊断和治疗方案,旨在为十二指肠乳头肿瘤的规范化诊治提供参考。
患者男,58岁,因"上腹部疼痛3个月"入院。患者既往体格健康,于2018年10月无明显诱因出现上腹部疼痛,伴食欲下降,后出现恶心、呕吐,呕吐物为胃内容物。2018年12月13日当地医院磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)检查示胆总管"壶腹部结石",遂行内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP),术中见十二指肠乳头明显肿大,胆管造影见胆总管直径约1.4 cm,胆总管内未见明显结石影,遂放置鼻胆引流管,并在乳头部位取6块活组织进行检查,标本质地韧,弹性一般。病理检查结果示,部分区域(乳头)呈腺瘤样改变伴轻、中度异型增生。ERCP术后鼻胆引流管每日引流出400~600 mL黄色胆汁。于2019年1月7日在解放军总医院第一医学中心门诊行十二指肠镜检查,可见十二指肠乳头肿大,其上黏膜粗糙,在内镜窄带成像术(narrow band imaging,NBI)模式下见腺管呈脑回样,取活组织2块,标本质地软、弹性可。病理检查结果示,小肠(乳头部)黏膜慢性炎症,部分腺体呈息肉样增生,局灶淋巴组织增生。解放军总医院第一医学中心消化内科门诊2019年1月28日以"十二指肠乳头占位、内镜下鼻胆管置入术后"收治入院。
患者入院时精神可,食欲差,1个月内体质量下降5 kg。入院体格检查示上腹部轻压痛,无反跳痛、肌紧张;余未见异常。血常规、尿常规、粪常规、凝血功能指标,以及IL-6水平均在正常范围内,肿瘤标志物(癌胚抗原、CA19-9、甲胎蛋白)均未见异常。血生物化学检查示:ALT水平为64.3 U/L,DBil水平为10.7 μmol/L,GGT水平为193.6 U/L,淀粉酶、脂肪酶等均在正常范围内。2019年1月29日MRCP检查结果见胆总管下段近十二指肠乳头区可疑信号,考虑肿瘤性病变可能,伴胰胆管轻度扩张;2月1日腹部增强CT检查结果可见十二指肠乳头占位、胆管引流术后改变(图1)。
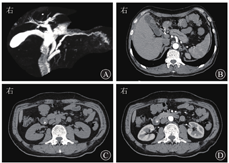

初步诊断为十二指肠乳头占位,内镜下鼻胆引流管置入术后;术后病理诊断为十二指肠乳头壶腹部低分化腺癌。
2019年1月30日行内镜下鼻胆外引流管变更内引流支架术(图2)。术后患者食欲改善,2周内体质量增加5 kg。2月11日患者出现发热,体温为37.7 ℃,上腹部疼痛,伴后背放射痛。查血常规未见异常,血生物化学检查示AST水平为88.2 U/L,胆红素水平在正常范围内,血淀粉酶水平为174.1 U/L(正常参考值为0~150.0 U/L ),血脂肪酶水平为352.7 U/L(正常参考值为13.0~60.0 U/L),不排除因乳头占位压迫胰管可能,予禁食水、对症支持治疗。2月13日行十二指肠乳头肿物内镜下切除术+超长胆胰管支架转流(鼻胆外引流管改造)术。术中先行超声内镜检查,初步评估乳头部占位无明显胆管、胰管内生性生长,但胰管扩张明显(图3)。考虑乳头病变浸润相对较深,为避免肿瘤组织残留或复发,切除乳头病变时尽量深切,术后创面可见固有肌层显露。为避免胰液或胆汁刺激创面而引起迟发出血或穿孔,术中置入鼻胆外引流管改造的超长(约35 cm)胆胰管支架转流,将胰液和胆汁跨过乳头切除创面引流至远端空肠,创面予金属夹夹闭(图4)。术后病理结果(图5)提示十二指肠乳头壶腹部低分化腺癌,癌旁和表浅腺体呈管状-绒毛状腺瘤改变,癌灶大小约1.5 cm×1.0 cm×0.5 cm,癌组织侵犯十二指肠肠壁肌层,紧邻基底切缘(切缘电凝变性显著)。术后当天和第2天胃管内共引流出约220 mL血性液体,发热,体温最高38.5 ℃,右上腹疼痛,查体无腹膜刺激征。复查血红蛋白较前无明显下降,白细胞计数为9.17×109/L,中性粒细胞占比为0.81,IL-6水平为80.4 ng/L,血淀粉酶水平为183.3 U/L,血脂肪酶水平为292.26 U/L,余未见明显异常。予以禁食水、抗感染(静脉注射亚胺培南西司他丁钠,1 g/8 h)、止血(经静脉泵注射艾司奥美拉唑、生长抑素,静脉注射酚磺乙胺、卡洛磺钠,口服凝血酶冻干粉等)、静脉营养支持等治疗。患者胃管内出血逐渐停止,腹痛渐缓解,1周后拔除胃管,逐步恢复饮食。患者于2019年5月31日至解放军总医院第一医学中心复查,十二指肠检查结果未见异常,活组织病理学检查示慢性炎,正电子发射计算机断层显像(PET-CT)检查未见明确肿瘤残留、复发或远处移位。2019年10月外院复查腹部增强CT亦未见明显异常。遂继续随访观察至今,患者无明显不适。
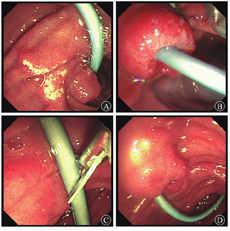

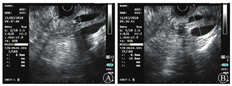



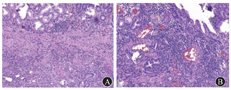

消化内科王子恺副主任医师:患者为老年男性,以腹痛起病,外院初诊为"胆总管结石",遂行ERCP术治疗。术中胆管造影未见结石,置入鼻胆引流管外引流。发现十二指肠乳头肿大,病理活组织检查示腺瘤样改变伴轻、中度异型增生。为改善患者营养状态和提高生命质量,解放军总医院第一医学中心消化内科先将鼻胆引流管由外引流改为内引流,待患者一般状况好转后行超声内镜评估,排除乳头占位胆胰管内生性生长后,行十二指肠乳头肿物内镜下切除术。术中为预防术后复发、残留,乳头病变予深切至固有肌层。术后为减少胆汁、胰液对局部创面的化学性刺激,预防出血、穿孔、胰腺炎和胆管炎,置入7 F鼻胆外引流管改造胆胰管支架,头端甩向空肠,并置入胃管。切除标本予多刀切片,病理示十二指肠乳头壶腹部低分化腺癌,癌旁和表浅腺体呈管状-绒毛状腺瘤改变,癌组织侵犯十二指肠肠壁肌层,紧邻基底切缘。十二指肠乳头病变的治疗模式是选择外科手术还是内镜切除,以及内镜切除的适应证和内镜切除术后并发症预防措施都是本次讨论的重点,还需请肝胆外科和病理科专家参与,结合本病例的病理结果制定进一步治疗方案,明确该患者后续治疗。
消化内科李明阳副主任医师:近年来,内镜下切除术已逐步成为十二指肠乳头肿瘤的一线治疗方法,然而手术适应证尚未明确。目前较为统一的适应证如下:肿瘤组织仅限于壶腹部,无内镜下恶性肿瘤证据(溃疡性、易碎性和自发性出血),无导管(胆管、胰管)内生性生长,十二指肠固有肌层无侵犯,瘤体组织最大径<4 cm或<5 cm等[5,6]。术前乳头病变的准确评估至关重要,需从多方面进行。术前镜下乳头活组织检查的准确率为62%~85%,有相对较高的假阴性率,可能无法完整反映病变性质[7,8]。内镜超声在评估十二指肠乳头肿瘤导管内生性生长方面的准确性与ERCP相当,而且能够准确判断肿瘤局部T分期[9],但其对淋巴结转移的诊断困难。然而,即使完善上述检查,术前早期准确诊断也非常困难。该患者在解放军总医院第一医学中心内镜下切除术前曾先后2次行乳头活组织检查均未提示高级别瘤变或癌变,内镜下切除术前亦通过腹部CT、MRCP、超声内镜等检查除外导管内生浸润,充分评估后选择内镜下切除治疗,但术后病理提示低分化腺癌,癌组织侵犯十二指肠肠壁肌层。严格意义上来说,该患者并不适合内镜下切除,需追加外科手术以避免术后残留或复发。
消化内科郭旭副主任医师:内镜下切除是十二指肠乳头肿瘤的有效治疗方法,但术后复发率高达33%[5],且黄疸、隐匿性腺癌、导管内受累,以及术前活组织检查结果提示高级别瘤变或腺癌等,均为术后残留的危险因素[10,11]。如内镜下无法完整切除病变,需追加外科手术。此外,即使完整切除病变,5年内仍可能复发,并有可能从低级别上皮内瘤变进展为腺癌,因此有必要长期监测[11]。解放军总医院第一医学中心消化内科曾收治1例内镜下切除术后病理提示高级别上皮内瘤变伴局灶癌变的患者,建议追加外科手术,患者拒绝。随访1年半后肿瘤复发,遂行惠普尔手术(Whipple术),术中发现肝脏转移灶,术后病理提示胆管、门静脉和淋巴结多发转移,预后差。因此,结合本例患者病理结果,考虑其术后残留、复发或转移风险较高,故建议追加外科手术治疗。
消化内科张修礼主任医师:十二指肠乳头肿瘤解剖位置特殊,内镜下切除手术难度较高,术后并发症发生率高。文献报道内镜下切除术后并发症高达25%,死亡率为0.4%[12]。早期并发症包括术后胰腺炎、出血、穿孔和胆管炎等,晚期并发症主要是胆胰管术后狭窄。其中胰腺炎是最常见的早期并发症,发生率为8%~15%,术后预防性放置胰管支架可降低术后胰腺炎的风险[13],然而是否常规或选择性放置胰管支架,目前尚无共识。出血是第二常见并发症,其发生率为2%~13%,多发生于肛侧切缘,基底病变残留和侧向发育生长是其危险因素,可通过术中黏膜注射止血、金属夹夹闭或氩气刀等治疗。然而,切除术后出血会影响后续的胰腺支架置入术,术后持续渗血需要反复止血。术后穿孔较少见(发生率≤4%),但最为严重,术中微小穿孔可通过金属夹夹闭,一旦发现较大穿孔或迟发穿孔需尽快外科手术,否则会发生胆汁、胰液外渗,引起严重腹膜后感染,甚至死亡。
近1年内,解放军总医院第一医学中心消化内科曾收治2例内镜下切除术后穿孔、继发严重腹膜后感染的患者,为避免胆汁和胰液对乳头部创面的化学性刺激,在内镜下切除术后均予放置胆管和胰管塑料支架。其中1例患者穿孔位置为乳头部肛侧,由于胆管和胰管支架长度较短,非但不能避开穿孔部位,反而将胆汁和胰液直接引流至穿孔部位,引起持续化学性刺激而加重穿孔和腹膜后感染。为解决这个棘手问题,李闻主任将鼻胆引流管改造成超长胆管、胰管内引流支架,可跨过穿孔部位,配合经皮腹膜后穿刺置管引流和内镜清创腹膜后感染坏死组织,该患者最终康复出院,但住院时间长,费用高,患者痛苦极大。在本例患者的内镜下切除术中,李闻主任在患者胆管和胰管内直接放置鼻胆引流管改造的超长支架,将支架远端甩至空肠,最大限度避免了胰胆液对局部创面的刺激,减少了术后并发症的风险,这为内镜下切除术后并发症的预防提供了新思路。
病理科刘爱军主任医师:十二指肠乳头部肿瘤内镜下活组织检查因取材表浅无法反映病变全貌,假阴性率较高,有一定局限性。术前活组织检查已提示高级别上皮内瘤变或癌变,内镜下不完整切除率较高,一般建议首选外科手术治疗[10]。如经过评估选择了内镜下乳头切除术,术后标本可视为大块活组织检查,比常规内镜活组织检查更能全面反映病变性质。如内镜下切除术后病理提示绒毛-管状腺瘤,一般提示预后不佳,有发生癌变风险,建议密切随访或追加外科手术。如标本提示不完整切除、伴高级别上皮内瘤变或恶变,也建议追加外科手术。临床随访中,确实发现部分患者内镜下切除术后病理提示癌变,但长期随访未见复发或转移,或内镜下切除术后病理提示癌变,追加外科手术后未见手术部位癌变。通过回顾阅片,发现这些患者乳头病变发生癌变的部位一般较为表浅,未侵犯十二指肠壁黏膜下层,因此发生淋巴结转移的风险较小,内镜下乳头肿瘤切除即达到完整切除,对于这类患者可酌情选择密切随访。然而,如内镜下切除术后病理提示癌变侵犯黏膜下层甚至肌层,仍建议追加外科手术。
该病例术前2次活组织检查均与内镜下切除术后病理不符,这也印证了术前活组织检查的局限性。内镜下切除术后病理提示十二指肠乳头壶腹部低分化腺癌,癌组织侵犯十二指肠肠壁肌层,考虑淋巴结转移风险较大,建议追加外科手术。此外,十二指肠乳头部解剖结构复杂、胆胰管汇合,因此不能将乳头部肿瘤内镜下切除标本按其他消化道早癌标本进行简单处理(即垂直于肠腔纵轴切片),需沿肠腔纵轴、平行胆胰管方向多刀切片,以便准确判断肿瘤组织有无胆胰管内生浸润。该患者内镜下切除术后标本处理不规范,因此无法识别胆胰管结构,亦无法判断肿瘤有无胆胰管内生浸润。这提示病理科医师应结合病变部位和临床要求规范处理术后病理标本。
肝胆外科纪文斌主任医师:十二指肠乳头肿瘤既往多通过外科手术治疗,近年来,内镜下十二指肠乳头肿瘤切除术日渐成熟,但其治疗策略仍存在争议。十二指肠乳头肿瘤如有以下表现,一般建议首选外科手术:①内镜下判断病变浸润较深或有癌变;②影像学提示有胆胰管内生性生长;③活组织检查提示高级别上皮内瘤变或癌变。术式包括惠普尔手术和乳头部局部切除术,后者术后复发率和癌变率较高。解放军总医院第一医学中心肝胆外科既往经验提示,术后病理提示绒毛-管状腺瘤的患者若仅行乳头局部切除,术后复发或癌变可能性大。因此,对于术中快速冰冻切片病理提示绒毛-管状腺瘤患者,应直接行惠普尔手术。根据该患者内镜切除术后病理结果,建议追加惠普尔手术。
消化内科李闻主任医师:十二指肠乳头肿瘤术前评估较困难,回顾性分析解放军总医院第一医学中心2006年至2017年间110例行内镜下乳头切除术的患者资料,结果显示,术前活组织检查容易低估病变的恶性程度(高达30.9%)[2]。可见内镜下切除不仅是治疗手段,还是诊断方法(大块活组织检查),应根据术后病理结果,选择随访观察或追加手术。该患者诊断明确,治疗方面有以下技术上的改进:①术前超声内镜评估有无导管内生性浸润;②术后于胆胰管内放置超长支架,有效预防术后相关并发症;③手术标本行多刀切片,全部取材包埋,争取病理还原病变层面和浸润深度。此次多学科讨论联合消化内科、病理科和肝胆外科专家,从不同角度对内镜下切除术后的管理和随访进行深入讨论,最终达成一致意见,该患者需追加惠普尔手术。
本例患者诊断明确,为十二指肠乳头低分化腺癌,治疗难点包括术前病变评估的准确性,治疗方式的选择,内镜治疗术中和术后并发症的预防,以及术后随访和治疗策略等。内镜下十二指肠乳头切除术是乳头良性肿瘤的有效治疗方法,但在病例选择方面需谨慎,建议消化内科、肝胆外科、病理科等多学科参与制定。内镜下切除术风险高,并发症严重,其中穿孔是最严重的并发症,及时进行术中和术后干预可降低穿孔风险,改善预后。内镜技术的进步和改良(如术前超声内镜评估、术中放置胆胰管超长支架等)有助于准确评估病变,减少并发症发生。内镜下切除术后标本处理和病理结果至关重要,需根据病理结果制定后续随访和治疗方案,如术后病理提示高级别上皮内瘤变或癌变,导管内生性浸润,病变累及黏膜下层及以下,以及镜下不完整切除等,建议追加外科手术。该患者术后密切随访,先后复查十二指肠镜、PET-CT和腹部增强CT等未见明确肿瘤残留、复发或转移现象,故患者和家属选择继续随访观察,未行外科手术治疗。目前继续密切随访中。
所有作者均声明不存在利益冲突



























