
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性硬膜下血肿(chronic subdural hematoma,CSDH)是血液集聚在蛛网膜与硬脑膜之间形成的慢性占位性病变,常在头部外伤3周以后形成。其发病率为1/10~13.1/10万人口,随着人口老龄化CSDH的发病率不断升高,80岁以上老年人年发病率可达127/10万人[1,2]。CSDH一般认为由外伤引起,但约50%患者否认外伤史[3,4]。除外伤外,与CSDH发病相关、吸收不良或复发的常见危险因素包括:(1)长期应用抗凝和抗血小板药;(2)反复或突然的胸腹压力增高(如难产、便秘);(3)开颅手术;(4)血液病。
CSDH发生、发展及吸收的机制尚不十分清楚。以往对CSDH发病机制进行一系列探讨,桥静脉撕裂出血、渗透压增高、血肿包膜出血和局部纤溶亢进等均被认为与CSDH产生及发展有关,但迄今为止CSDH的发病机制仍不十分清楚[5,6]。近期有证据表明,外伤等原因导致硬膜下腔局部血液和(或)脑脊液聚集,炎性细胞因子和血管内皮生长因子(VEGF)大量分泌聚集,导致血肿壁上幼稚血管的大量增生、血管内皮细胞受损、缝隙连接开放、通透性增高,并导致循环中的物质不断渗漏,血肿逐渐增大[6]。同时,CSDH患者体内存在的可调节T细胞(regulatory T cells,Treg)和内皮祖细胞(endothelia progenitor cell,EPC)等相关抑炎、促修复因素不足,从而导致血肿壁上"幼稚血管新生-内皮细胞损害-血管渗漏"反复出现,可能是CSDH形成的关键因素[5,7,8,9,10]。其他研究证实,免疫调节异常,血管修复成熟能力下降,以及硬脑膜淋巴系统在CSDH的发生、发展中具有重要作用[11,12,13]。
CSDH是一种颅内出血性疾病,发病隐匿,进展缓慢,当血肿增大引起颅内压增高时,常常出现头痛、头晕或肢体活动障碍等临床表现。CT扫描和MRI检查可明确诊断,临床上常常根据影像学检查时患者血肿的大小、中线移位程度来评估病情的严重程度。但由于CSDH高发的老年人群常常存在脑萎缩等多种颅内容积代偿因素,致使影像学表现较为严重的CSDH患者往往症状体征轻微(许多患者因此拒绝手术治疗),加之病情进展缓慢,影像学检查难以满足临床动态、反复和及时评估的需要。为了准确及时地评估CSDH患者病情严重程度及其发展趋势,Markwalder团队综合考虑患者临床症状严重程度及意识状态评分,提出了MGS-GCS评分(Markwalder′s Grading Scale and Glasgow Coma Scale),见表1[14]。
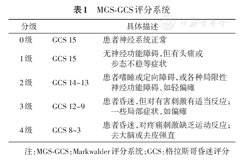
MGS-GCS评分系统
MGS-GCS评分系统
| 分级 | 具体描述 | |
|---|---|---|
| 0级 | GCS 15 | 患者神经系统正常 |
| 1级 | GCS 15 | 无神经功能障碍,但有头痛或步态不稳等症状 |
| 2级 | GCS 14~13 | 患者嗜睡或定向障碍,或各种局限性神经功能障碍,如轻偏瘫 |
| 3级 | GCS 12~9 | 患者昏迷,但对有害刺激有适当反应;一些局部症状,如偏瘫 |
| 4级 | GCS 8~3 | 患者昏迷,对疼痛刺激缺乏运动反应;去大脑或去皮强直 |
注:MGS-GCS:Markwalder评分系统;GCS:格拉斯哥昏迷评分
推荐意见:建议采用MGS-GCS体系作为CSDH患者病情严重程度的临床评估标准(中证据等级,强推荐)。
大多数CSDH常逐渐增大,随着占位效应增加,患者病情可持续加重,甚至发生脑疝并危及生命(少部分患者经观察和对症治疗,血肿可自然吸收[15])。对占位效应明显的CSDH患者通常首选手术治疗。临床上常常选用钻孔或锥孔引流术治疗[16]。也有采用小骨窗开颅术或内镜辅助下血肿清除术治疗[17,18]。大多数患者手术治疗效果良好,但仍有部分患者术后复发(复发率最高可达33%[2]),甚至因反复复发不得不接受多次手术治疗或病灶侧硬脑膜中动脉介入栓塞治疗[19]。由于CSDH常见于老年人,患者体弱,基础病较多,手术治疗风险高,常可产生严重并发症甚至死亡(死亡率最高达32%[20])。有报道,90岁以上CSDH患者无论选择做还是不做手术,总体预后良好率为24%[21]。
CSDH药物治疗的目的是改善患者症状体征,促进血肿吸收。药物治疗又可分为对症治疗和促进血肿吸收的治疗。对症治疗目的是为了改善患者的症状体征,为手术或其他治疗创造条件。促进血肿吸收的药物治疗不但能为患者提供一种简便易行且痛苦较小的治疗手段,还可用于防治术后复发,并可为高龄体弱、难以耐受手术或手术治疗失败的患者提供一种安全有效的治疗方法。
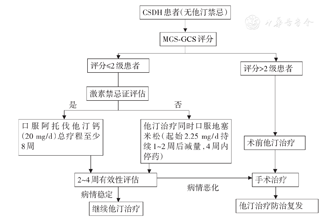
促进血肿吸收药物治疗的适应症是:(1)生命体征平稳且MGS-GCS 0~2级;(2)影像学显示中线移位未超过1 cm,无需紧急手术干预的患者;(3)合并多器官衰竭、凝血功能障碍等不适宜手术或拒绝手术的患者;(4)手术治疗后用于防治术后复发等。其禁忌证是:(1)MGS-GCS 3~4级;(2)影像学显示脑组织受压严重、中线移位超过1 cm;(3)出现意识障碍,恶心呕吐等脑疝前兆;(4)对所使用药物过敏或者具备该药物使用禁忌证。本共识推荐的CSDH治疗药物为阿托伐他汀钙和地塞米松,其相关禁忌证可参照其产品说明,不再赘述。对于接受促血肿吸收的药物治疗2周或2周以上、临床表现及影像学检查仍无明显改善或血肿持续增大或不能耐受药物治疗者应建议改用手术治疗。
正是基于免疫调节紊乱、血管生成不成熟等假说,抑制过度炎症反应和促进新生血管成熟成为了促进CSDH吸收的治疗策略。脑创伤(traumatic brain injury)的基础研究提示,脑创伤后循环血中EPC动员增加可以促进血脑屏障修复、血管神经单元的建立和颅内血肿的吸收,提高循环血中EPC,可以改善预后[22]。脑创伤患者的临床观察证实,循环血中EPC数量较高的患者预后明显好于EPC数量低的患者[23]。阿托伐他汀钙则被证实具有免疫调节和促血管成熟的双调节作用,可改善TBI鼠模型的神经症状[22,24]。他汀,即3-羟基-3甲基戊二酰辅酶A(HMG-CoA)还原酶选择性抑制剂,以往被用于治疗高血脂症。但是研究发现,他汀类药物还可提高循环EPC和Treg水平,具有抑制非特异性免疫炎症反应、促进损伤血管修复、促进人工血管(支架)内皮化等作用,已被常规用于高血压、冠心病的临床治疗。基础研究还发现,应用阿托伐他汀钙可以抑制模型动物CSDH壁上的炎症反应,促进幼稚血管成熟与修复(血管壁平滑肌生成、稳定内皮屏障缝隙连接),加速血肿吸收。但大剂量的阿托伐他汀钙在调动更多的EPC的同时,大幅增加VEGF,组织生长因子β(tissue growth factor-β,TGF-β),基质金属蛋白酶9(MMP-9)在血肿壁上的表达,这一特点又会造成新的幼稚血管增生、发育不全,消减了阿托伐他汀钙产生的治疗作用[12,25]。另外,在脑卒中的基础研究中还发现,小剂量阿托伐他汀钙可促进卒中动物神经功能改善,而大剂量阿托伐他汀钙可诱发脑出血[26];临床实践中还发现阿托伐他汀钙相关的肝酶升高、横纹肌溶解等并发症的发生与用药剂量密切相关[27]。因此,小剂量长疗程的阿托伐他汀钙应用更适合CSDH患者的治疗。
目前,小剂量阿托伐他汀钙已被中国许多神经外科医生用于促进CSDH吸收及防治CSDH手术后复发[28,29,30]。25家中国神经外科中心历时3年完成的小剂量长疗程阿托伐他汀钙(20 mg/d)治疗CSDH的随机双盲对照研究(RCT),结果显示,治疗8周后阿托伐他汀钙治疗组较对照组的血肿减少量明显增多(减少量较对照组多12.55 ml),大多数患者经药物治疗后神经功能症状显著改善。同时,阿托伐他汀钙治疗组转手术率明显下降。药物治疗过程中未出现需要处理的严重副作用[31]。此外,这一治疗方案还被应用于治疗一些难治性CSDH病例,如年幼低龄术后反复复发不能耐受再次手术的患儿、合并凝血功能异常(长期口服法华令、阿司匹林和氯吡格雷等凝血功能抑制药)导致手术禁忌证等患者,以及预防术后复发,也取得了良好疗效[29,30,32]。
推荐意见:对于本共识规定的符合药物治疗适应症的CSDH患者,可采用小剂量长疗程阿托伐他汀钙治疗(20 mg/d),连续治疗至少8周,直到神经症状体征消失、血肿吸收满意后停药(高证据等级,强推荐)。围手术期患者也适用该方案以减少术后复发几率(中等证据等级,强推荐)。用药期间患者血脂仍然升高者,可以适当增加阿托伐他汀钙用量,但从安全性考虑,不超为调节血脂水平而限定的极量80 mg/d(低证据等级,强推荐)。
地塞米松是一种人工合成的皮质类固醇(激素),通过抑制免疫炎症细胞集聚,吞噬、释放炎症介质,非特异性地抑制免疫炎症反应,减轻和防止组织对炎症的反应。神经外科患者(包括CSDH患者)围手术期,根据病情需要可选择性地采用地塞米松等糖皮质激素进行替代治疗或辅助对症治疗。由于地塞米松半衰期较长、应用剂量范围宽泛,临床上被较多的采用[33]。以往研究证实,虽然CSDH患者循环血中白细胞等免疫炎症指标并不高,但CSDH血肿壁和血肿腔内存在着大量的免疫炎症细胞和炎性因子等炎症反应的产物[34]。早在20世纪60年代,国际上就有学者将大剂量地塞米松应用于CSDH的临床治疗[35]。此后,陆续有关于应用大剂量地塞米松促进CSDH吸收、防治患者术后复发的临床报道。但这些报道疗程不一、地塞米松剂量也不尽相同[36,37],并且均未得到可靠的循证医学研究证实。
在以往大剂量地塞米松治疗CSDH的相关报道中,地塞米松剂量一般在12~16 mg/d,疗程总剂量超过336 mg[37]。众所周知,大剂量地塞米松治疗易导致肥胖、胃肠道损害和其他类固醇相关并发症,因此,高血压、糖尿病、血栓症、胃与十二指肠溃疡、精神病、电解质代谢异常、心肌梗死、青光眼及库欣综合征等患者一般不宜使用。老年患者,尤其是更年期后的女性使用易发生骨质疏松。而CSDH恰恰高发于老年人群。一项回顾性研究指出,与手术治疗相比,大剂量地塞米松(6~8 mg/d)仅能使17% CSDH患者免于手术,但显著增加患者的治疗并发症[38]。近期的相关循证医学研究(荟萃分析)显示,在CSDH治疗时地塞米松使用剂量较大,此类剂量地塞米松治疗的不良反应令人堪忧,其使用率已呈下降趋势[39]。
阿托伐他汀钙是通过抑制CSDH局部炎症反应,促进血管修复,达到治疗目的。有证据显示,阿托伐他汀钙可以减少CSDH血肿液导致的血管渗漏,但其作用较弱。临床上小剂量短疗程地塞米松治疗是指单日剂量为0.5~3 mg/d,激素使用时间不超过4周(地塞米松总剂量约为60 mg)[32]。小剂量短疗程地塞米松辅助阿托伐他汀钙治疗,一方面可以增强对炎性反应导致的血管渗出的抑制作用,另一方面又可以避免地塞米松大剂量长期使用带来的不良反应。因此,小剂量短疗程地塞米松辅助阿托伐他汀钙治疗有望更好地纠正CSDH存在的损害因素与修复因素的失衡。本团队概念验证(proof of concept,POC)研究证实,与单纯应用小剂量阿托伐他汀钙比,小剂量阿托伐他汀钙联合短期小剂量地塞米松治疗CSDH的疗效更加显著,且没有增加药物相关副作用。尽管还有待设计严谨的RCT研究来进一步证实该复方疗法的实际疗效,但这项POC表明,该复方疗法可作为没有相关药物应用禁忌证CSDH患者的优先疗法,为接受阿托伐他汀钙单药疗法疗效欠佳的患者提供了新选择[40]
推荐意见:大剂量(12~16 mg/d)或长疗程(超过3个月)地塞米松因其副作用大,不推荐常规使用(高证据等级,强推荐);小剂量短疗程地塞米松应用可以提高阿托伐他汀钙对CSDH的治疗效果。对于术后反复复发等难治性CSDH和使用单药阿托伐他汀钙疗效不明显者,推荐小剂量阿托伐他汀钙(20 mg/d)治疗基础上联合应用地塞米松片(首剂2.25 mg/d,持续1~2周,逐步在4周之内减量至停药),然后可继续接受小剂量阿托伐他汀钙(20 mg/d)直到神经症状体征消失、血肿吸收满意后停药(低证据等级,强推荐)。
CSDH是颅内的出血性疾病,长期口服抗凝药物及抗血小板药物是CSDH发生的高风险因素[41]。最近的一项循证医学研究(荟萃分析)结果显示,术后重启抗凝药物治疗(不包括抗血小板药物)将会增加CSDH复发的风险[42]。对于长期口服抗凝药物及抗血小板药物的患者,除存在近期体内血管支架置入、人工血管置换及心脏瓣膜置换等难以停用抗凝抗血小板药物的原因外,确诊CSDH后应立即停用相关药物,并进行凝血功能及血小板相关监测,必要时可使用拮抗药物。CSDH血肿完全吸收后,可以恢复患者既往抗凝和抗血小板药物应用并严密监测患者的凝血功能,具体治疗原则参见文献[43,44]。
由于CSDH高发于老年人,并且通常没有全身性的凝血功能障碍,而高龄患者常合并全身多种血栓性疾病,如脑梗死及冠状动脉粥样硬化性心脏病,止血药物应用会大大增加栓塞性疾病的发病风险。一般不常规使用止血药物。
CSDH抗纤溶药物治疗备受关注。研究显示,CSDH患者血肿液及外膜中组织型纤溶酶原激活物、纤维蛋白降解产物及血栓调节蛋白显著升高,提示,纤溶亢进与CSDH血管反复"漏血"有关[45,46,47,48]。抗纤溶药物能通过抑制纤溶酶原激活及纤溶酶活性发挥止血作用。临床病例及回顾性研究认为,氨甲环酸作为抗纤溶药物可用于治疗CSDH,促进血肿吸收,减少复发[49,50,51,52,53]。但是有研究认为,抗纤溶药物会增加患者血栓事件的发生率[54],因此,抗纤溶药物治疗还需要更高级别循证医学证据。
推荐意见:CSDH患者一旦确诊,原则上应停用抗凝及抗血小板药物(极低证据等级,强推荐);除合并全身凝血障碍的患者外,止血药物需慎重使用(极低证据等级,强推荐);此外,在获得高级别循证医学证据证实前,不推荐抗纤溶药物应用(低证据等级,弱推荐)。
(1)CSDH合并颅内压增高及头痛的药物治疗。CSDH压迫刺激脑组织,可导致患者发生头痛、恶心等高颅压症状,也可导致运动、语言功能障碍及精神症状。给予脱水药如甘露醇、甘油果糖以及利尿剂等渗透性降颅压治疗可缓解疼痛。但是,一项严格规范的RCT证实渗透性治疗不导致血肿吸收[55]。对头痛症状明显的患者,还可针对性使用包括非甾体类抗炎药(NSAID)如对乙酰氨基酚、萘普生及布洛芬等止痛药物,以及麦角类制剂和曲普坦类药物。渗透性降颅压治疗前及治疗期间,需要观察患者肾功能水平以及电解质变化,防止肾功能不全者病情加重以及老年患者电解质紊乱[56]。阿片类药物应用较少,用药同时要定期进行影像学监测关注颅内血肿及脑水肿变化。(2)CSDH合并抑郁焦虑及精神行为异常的药物治疗。部分患者存在焦虑、抑郁及失眠等精神症状的CSDH患者,可对症应用氟哌噻吨美利曲辛、地西泮、艾司唑仑及坦度螺酮等药物调节情绪及睡眠[57],也可选用扎来普隆。对于有精神及情感症状者临床多应用奥氮平控制,用药期间患者血脂升高者注意调整他汀用量[58]。但所有以上精神类和治疗失眠类药物的应用,都可能带来严重副作用,长期使用时需要告知患者危险性。(3)CSDH合并癫痫的药物治疗:癫痫发作是CSDH钻孔引流术前及术后的主要并发症之一,其发生率在CSDH确诊后可达3%~23%,临床常采用丙戊酸钠等抗癫痫药物对症处理。但预防性使用抗癫痫药物效果不确定,是否对CSDH患者预防性抗癫痫仍存在争议。目前尚无随机对照研究及新近回顾性研究评估CSDH患者预防性抗癫痫治疗的风险及受益,但对于高龄及酗酒的CSDH患者,预防性抗癫痫治疗可能对患者更加安全及有利[59]。
推荐意见:推荐渗透性脱水治疗CSDH引起的颅内压升高(中证据等级,强推荐),但不推荐应用该疗法促进CSDH吸收(高证据等级,强推荐);推荐抗抑郁助睡眠药物作为CSDH患者情绪及失眠症状的改善(中证据等级,强推荐);推荐奥氮平用于治疗患者精神及情感症状(低证据等级,强推荐);推荐丙戊酸钠作为CSDH患者癫痫发作的治疗性药物(中证据等级,强推荐),但不推荐无癫痫患者的预防性治疗(低证据等级,中等推荐)。
CSDH药物治疗无效者常表现为原有神经症状体征加重或持续不能缓解,且影像学显示血肿逐渐增大。此种患者可能因血肿增大导致脑疝甚至生命危险,需及时转手术治疗;而CSDH治疗有效者,则表现为原有神经症状体征减轻和(或)神经影像显示血肿减少。但临床中也观察到部分老年患者影像学显示血肿体积缩小到一定程度即固化不再缩小,神经症状体征却完全消失且长期随访不变化,这种情况可以视为治疗有效。
另外,阿托伐他汀钙服用者中约有15%会出现转氨酶升高,还有少量患者会出现碱性磷酸酶、胆红素异常,极少患者出现横纹肌溶解症状[60]。而小剂量地塞米松使用后部分患者可能出现心率加快、面部潮红、食欲增加、毛孔增粗和体质量增加。还可能加重原有糖尿病、消化道溃疡病史、原有股骨头坏死和原有骨质疏松患者的病情,因此,所有接受药物治疗的CSDH患者均需要接受严密的临床神经症状体征、神经影像学和血化验监测。
推荐意见:推荐所有接受药物治疗的CSDH患者24 h需有陪伴,如发生神经症状加重,需到最近的神经外科急诊就医(低证据等级,强推荐);推荐药物治疗开始后的2周内至少接受1次头CT或头MRI平扫检查(低证据等级,强推荐);推荐药物治疗开始后的2周内至少接受血常规、肝肾功能、血脂和血糖检查,必要时测肌酸激酶和肌红蛋白(低证据等级,强推荐)。
依据以上共识意见,绘制CSDH药物治疗流程图见图1。

最后的几点说明:(1)迄今为止,促进CSDH吸收的药物治疗探索经历了漫长的发展过程,除阿托伐他汀钙和地塞米松以外,研究者还先后尝试应用过多种药物甚至草本药物应用,但这些药物疗法要么疗效不确切、不良反应巨大,要么未能或尚未通过临床RCT循证医学研究,缺乏安全、可靠的证据支持[61],所以,本共识不对这些药物做推荐。(2)本共识关于阿托伐他汀钙治疗CSDH的临床和基础证据都基于应用立普妥获得,临床证据主要是成人样本,尚不能确认其他品牌阿托伐他汀钙、其他类型他汀也具有等效性。也不能确认长期口服阿托伐他汀钙患者可以减少CSDH发生,以及已经长期口服阿托伐他汀钙患者再应用阿托伐他汀钙治疗仍然可以获得良好效果。(3)本共识推荐意见适用于成人CSDH患者,儿童患者请参照文献[32]。(4)随着更多神经科学临床、科研工作者对该病的关注,以及多学科协作研究的广泛开展,对CSDH发病机制及治疗手段的认识会逐步深入。未来还将出现更多新的有效治疗方法,包括新药物及新术式,本共识内容也将与时俱进做相应的更新,期待有关CSDH的研究有更大突破。(5)本共识仅基于目前检索可得的文献及参与讨论专家所掌握的循证医学证据所得,仅供神经外科临床医生参考,不具备法律效力,不作为任何医疗纠纷及诉讼的法律依据。解释权在本共识编写专家委员会。(6)本共识采用定量系统评价证据分级工具(GRADE)方法[62]将证据质量分为高、中、低和极低4个级别,将推荐等级分为强推荐和弱推荐2个级别。具体分类方法见表2。

定量系统评价证据分级工具(GRADE)证据质量及推荐等级分类方法
定量系统评价证据分级工具(GRADE)证据质量及推荐等级分类方法
| 等级 | 证据质量 |
|---|---|
| 高 | 非常确信(很有把握认为真实值与估计值接近) |
| 中 | 信心一般(真实值可能与估计值接近,但存在二者完全不同的可能性) |
| 低 | 信心有限(真实值可能与估计值完全不同) |
| 极低 | 几乎没什么信心(估计值很不确定) |
| 推荐强度 | |
| 强 | 明显显示干预措施利大于弊或弊大于利 |
| 弱 | 利弊不确定或无论质量高低的证据均显示利弊相当 |
本共识编写专家委员会名单(按姓氏拼音为序):费舟(空军军医大学西京医院)、冯华(解放军陆军军医大学第一附属医院)、高国栋(空军军医大学唐都医院)、郝解贺(山西医科大学附属第一医院)、侯立军(上海长征医院)、胡锦(复旦大学附属华山医院)、黄楹(天津市环湖医院)、焦保华(河北医科大学第二医院)、吉宏明(山西省人民医院)、江晓春(皖南医学院附属弋矶山医院)、康德智(福建医科大学附属第一医院)、李建荣(解放军第一一七医院)、李新钢(山东大学齐鲁医院)、刘劲芳(中南大学湘雅医院)、刘宁(江苏省人民医院)、刘献志(郑州大学附属第一医院)、毛颖(复旦大学附属华山医院)、屈延(空军军医大学唐都医院)、Wai Sang Poon潘伟生(香港中文大学威尔士亲王医院)、苏宁(内蒙古自治区人民医院)、孙涛(宁夏医科大学总医院)、孙晓川(重庆医科大学附属第一医院)、王建军(鄂尔多斯市中心医院)、王任直(中国医学科学院 北京协和医学院 北京协和医院)、魏俊吉(中国医学科学院 北京协和医学院 北京协和医院)、王硕(首都医科大学附属北京天坛医院)、尹港峰(沧州市中心医院)、游潮(四川大学华西医院)、于如同(徐州医学院附属医院)、余新光(解放军总医院)、袁贤瑞(中南大学湘雅医院)、张建民(浙江大学医学院附属第二医院)、张俊义(鄂尔多斯市东胜区人民医院)、赵世光(哈尔滨医科大学附属第一医院)、赵元立(首都医科大学附属北京天坛医院)、赵宗茂(河北医科大学第二医院)、钟春龙(同济大学附属东方医院)、朱锡德(临沂市人民医院)、祝新根(南昌大学第二附属医院)
本共识撰写者名单:江荣才、张建宁、王东、田野、尉辉杰、权伟、高闯、岳树源、雷平、邓全军、张舒、周源、孙健、安硕、魏盈胜、葛歆瞳(所有撰写者单位均为天津医科大学总医院神经外科/天津市神经病学研究所)
所有作者均声明不存在利益冲突


























