
探究克罗恩病(CD)患者血清总25羟维生素D[T-25(OH)D]水平及其与外周血细胞因子白细胞介素6(IL-6)、IL-8及肿瘤坏死因子α(TNF-α)和克罗恩病活动指数(CDAI)之间的相关性。
回顾性纳入2014年4月至2019年3月收住北京协和医院且行血清T-25(OH)D和细胞因子[IL-6、IL-8和(或)TNF-α]检测的CD患者60例,收集临床资料进行分析。
60例CD患者中男46例,年龄(34±13)岁;其中缓解期16例(26.7%),活动期44例(73.3%);其血清T-25(OH)D水平为(16.0±7.7)μg/L,其中维生素D充足为16例(26.7%),维生素D不足为24例(40.0%),维生素D缺乏为20例(33.3%)。相关性分析发现,血清T-25(OH)D水平与CDAI(r=-0.363,P=0.004)、IL-6(r=-0.360,P=0.007)、超敏C反应蛋白(hsCRP)(r=-0.272,P=0.043)、红细胞沉降率(ESR)(r=-0.293,P=0.024)水平均呈负相关;而与血清白蛋白(Alb)(r=0.372,P=0.003)、血红蛋白(Hb)(r=0.330,P=0.010)和体质指数(BMI)(r=0.276,P=0.033)呈正相关。在44例活动期CD患者中,23例(52.3%)合并感染,其血清T-25(OH)D水平较CD活动期未合并感染组低[(12.55±7.17)比(17.41±6.49)μg/L,P=0.023]。
CD患者血清T-25(OH)D水平与CDAI、IL-6及炎症指标均呈负相关,且合并感染的CD活动期患者血清T-25(OH)D水平更低。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(CD)是炎症性肠病(IBD)中的一种。CD患者体内促炎细胞因子与抗炎细胞因子比例失调,Th1细胞和Th17细胞及其分泌的细胞因子在CD的发病过程中起重要作用[1]。维生素D/维生素D受体(VDR)通路除其经典的调节钙磷代谢的作用外,亦有抗感染、抗炎和抗肿瘤作用[2,3]。IBD患者存在维生素D/VDR通路异常。血清总25羟维生素D[T-25(OH)D]浓度被用于评估体内维生素D水平。前期临床研究发现,CD患者血清T-25(OH)D水平减低,且与其疾病活动度呈负相关性[4]。国外亦有研究报道,维持较高水平T-25(OH)D的IBD患者外周血的白细胞介素6(IL-6)水平低,溃疡性结肠炎(UC)患者中血清T-25(OH)D水平与外周血白介素10(IL-10)呈正相关,而与肿瘤坏死因子α(TNF-α)、IL-6无相关性[5,6]。以上研究提示IBD患者血清T-25(OH)D与外周血细胞因子水平存在相关性,而目前国内鲜有报道。本研究拟探究CD患者血清T-25(OH)D水平特点及其与外周血细胞因子的相关性。
(1)2014年4月至2019年3月在北京协和医院住院并经病理确诊或临床确诊的CD患者,其诊断标准参考我国《炎症性肠病诊断与治疗的共识意见(2018年,北京》[7];(2)住院期间行外周血IL-6、IL-8和(或)TNF-α检测,距离细胞因子检测前后1周内完成血清T-25(OH)D水平检测。入组时间定义为完善血清T-25(OH)D水平检测的日期。排除标准:(1)尚不能确诊CD的患者;(2)未行外周血细胞因子或血清T-25(OH)D水平检测的患者;(3)血清T-25(OH)D水平检测时间距离外周血细胞因子检测时间>1周的患者。经北京协和医院病案科住院资料数据库检索,研究窗内有437例诊断为CD的患者住院,通过病历回顾,排除不能确诊为CD的患者60例,排除住院期间未完成细胞因子或血清T-25(OH)D水平检测的患者315例,排除细胞因子和血清总25(OH)D水平检测间隔时间>1周的患者2例,最终纳入符合标准的60例患者。本研究经北京协和医院伦理委员会批准(S-K862)。
回顾性收集并分析60例CD患者的临床资料,基本情况包括纳入本研究时的年龄、性别、病程、肠道手术史、蒙特利尔分型、克罗恩病疾病活动指数(CDAI)、体质指数(BMI),辅助检查包括外周血IL-6、IL-8和TNF-α,血清T-25(OH)D浓度,红细胞沉降率(ESR)和超敏C反应蛋白(hsCRP),血红蛋白(Hb)、血清白蛋白(Alb);入组前1个月内的并发症和用药情况。蒙特利尔分型中,根据诊断年龄分为A1(诊断年龄≤16岁)、A2(17~40岁)、A3(≥40岁);根据病变累及部位分为L1(仅累及回肠)、L2(仅累及结直肠)、L3(累及回肠和结直肠)、L4(累及空肠及其以上部位消化道);根据疾病行为分为B1(非狭窄非穿通型)、B2(狭窄型)、B3(穿通型);肛周病变定义为病程中出现肛瘘、肛周脓肿、肛裂等临床表现。根据CDAI评分将CD分为缓解期和活动期,缓解期定义为CADI总分≤149,活动期定义为CDAI总分≥150,其中150~220分为轻度活动,221~450分为中度活动,451~1 100分为重度活动。
总结60例CD患者中血清T-25(OH)D水平特点,根据我国《维生素D与成年人骨骼健康应用指南》[8],将血清T-25(OH)D≥20 μg/L定义为维生素D充足,12 μg/L≤血清T-25(OH)D<20 μg/L定义为维生素D不足,血清T-25(OH)D<12 μg/L定义为维生素D缺乏。分析CD患者中血清T-25(OH)D水平与细胞因子等指标的相关性;将44例处于活动期的CD患者根据是否合并感染分为无感染组和并发感染组,比较两组患者之间血清T-25(OH)D、细胞因子、炎症指标、CDAI及并发症发生率差异。
应用液相色谱串联质谱法(LC-MS/MS)测定血清T-25(OH)D;应用西门子全自动化学发光免疫分析仪(IMMULITE 1000)行化学发光法测定血清IL-6、IL-8、TNF-α水平,IL-6测定试剂盒(编号LK6P1)、IL-8测定试剂盒(编号LK8P1)、TNF-α测定试剂盒(编号LKNF1)均购自英国西门子医学诊断产品有限公司;采用常规方法测定ESR和hsCRP。以上检测均由我院检验科完成。
应用SPSS 24.0软件进行统计学分析,符合正态分布的计量资料以 ±s表示,组间比较采用单因素ANOVA检验,相关性分析采用Pearson相关性分析;不符合正态分布的计量资料以[M(P25,P75)]表示,组间比较采用非参数检验,相关性分析采用Spearman相关性分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
±s表示,组间比较采用单因素ANOVA检验,相关性分析采用Pearson相关性分析;不符合正态分布的计量资料以[M(P25,P75)]表示,组间比较采用非参数检验,相关性分析采用Spearman相关性分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
60例CD患者中男46例(76.7%),年龄(34±13)岁,中位病程60月。21例(35%)CD患者存在至少1次肠道手术史,其中仅小肠手术3例,小肠和大肠手术10例,仅大肠手术8例。蒙特利尔分型方面,诊断年龄以A2(70%)为主,病变部位以L3(70%)为主,疾病行为以狭窄型(40.0%)多见。入组时,16例(26.7%)处于缓解期,44例(73.3%)处于活动期。并发症方面,23例(38.3%)并发感染的患者均处于疾病活动期,其中7例为病原不明的消化道感染,7例为肛周感染,7例为腹腔感染,2例为呼吸道感染,其他并发症包括肠瘘17例(28.3%),肠梗阻11例(18.3%)和消化道大出血4例(6.7%)。完善检查时应用美沙拉秦22例(36.7%)、糖皮质激素15例(25.0%)、硫唑嘌呤10例(16.7%)、生物制剂7例(11.7%)、沙利度胺3例(5.0%)和甲氨蝶呤2例(3.3%);10例(16.7%)补充维生素D制剂治疗中(表1)。

60例克罗恩病患者临床特征
60例克罗恩病患者临床特征
| 项目 | 结果 | |
|---|---|---|
| 男性[例(%)] | 46(76.7) | |
年龄[岁, ±s] ±s] | 34±13 | |
| 病程[月, M(P25,P75)] | 60(36,120) | |
| 肠道手术史[例(%)] | ||
| 无 | 39(65.0) | |
| 仅小肠手术史 | 3(5.0) | |
| 小肠和大肠手术史 | 10(16.7) | |
| 仅大肠手术史 | 8(13.3) | |
| 诊断年龄[例(%)] | ||
| ≤16岁 | 5(8.3) | |
| 17~40岁 | 42(70.0) | |
| >40岁 | 13(21.7) | |
| 病变部位[例(%)] | ||
| L1 | 10(16.7) | |
| L2 | 8(13.3) | |
| L3 | 42(70.0) | |
| L4 | 11(18.3) | |
| 疾病行为[例(%)] | ||
| 非狭窄非穿通型 | 9(15.0) | |
| 狭窄型 | 24(40.0) | |
| 穿通型 | 6(10.0) | |
| 狭窄并穿通型 | 21(35.0) | |
| 肛周病变[例(%)] | 26(43.3) | |
| 疾病活动度[例(%)] | ||
| 缓解期 | 16(26.7) | |
| 轻度活动 | 10(16.7) | |
| 中度活动 | 29(48.3) | |
| 重度活动 | 5(8.3) | |
| 并发症[例(%)] | ||
| 感染 | 23(38.3) | |
| 肠瘘 | 17(28.3) | |
| 肠梗阻 | 11(18.3) | |
| 消化道大出血 | 4(6.7) | |
| 应用维生素D补充剂 | 10(16.7) | |
60例CD患者血清T-25(OH)D为(16.0±7.7)μg/L,其中维生素D充足为16例(26.7%),维生素D不足为24例(40.0%),维生素D缺乏为20例(33.3%)。CD患者血清T-25(OH)D水平与CDAI呈负相关(r=-0.363, P=0.004),进一步分析发现其与IL-6(r=-0.360, P=0.007)、hsCRP(r=-0.272, P=0.043)、ESR (r=-0.293, P=0.024)呈显著的负相关性,而与血清Alb(r=0.372,P=0.003)、Hb(r=0.330,P=0.010)和BMI(r=0.276,P=0.033)呈正相关,与病程、是否存在小肠手术史及细胞因子IL-8或TNF-α均无显著相关性(图1)。
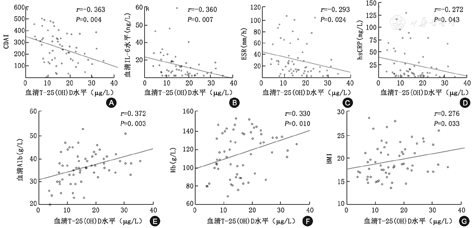

注:T-25(OH)D:总25羟维生素D;CDAI:克罗恩病活动指数;IL:白细胞介素;ESR:红细胞沉降率;hsCRP:超敏C反应蛋白;Alb:血清白蛋白;Hb:血红蛋白;BMI:体质指数
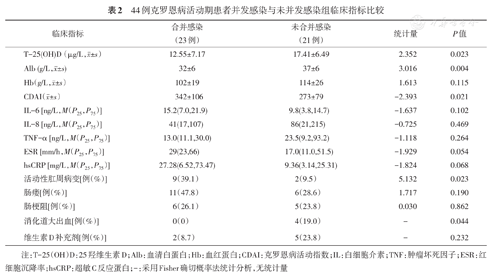
44例CD活动期患者中23例(52.3%)并发感染、21例(47.7%)未并发感染。并发感染组较无感染组血清T-25(OH)D更低[(12.55±7.17)比(17.41±6.49)μg/L,P=0.023],Alb减低[(32±6)比(37±6)g/L,P=0.004],CDAI增高[(342±106)比(273±79),P=0.021],活动性肛周病变比例更高[9(39.1%)比2(9.5%),P=0.023]。在其他疾病相关辅助检查、并发症肠梗阻和肠瘘发生率及合并用药情况等方面两组间差异无统计学意义(表2)。
44例克罗恩病活动期患者并发感染与未并发感染组临床指标比较
44例克罗恩病活动期患者并发感染与未并发感染组临床指标比较
| 临床指标 | 合并感染(23例) | 未合并感染(21例) | 统计量 | P值 |
|---|---|---|---|---|
T-25(OH)D(μg/L, ±s) ±s) | 12.55±7.17 | 17.41±6.49 | 2.352 | 0.023 |
Alb (g/L, ±s) ±s) | 32±6 | 37±6 | 3.016 | 0.004 |
Hb(g/L, ±s) ±s) | 102±19 | 114±26 | 1.613 | 0.115 |
CDAI( ±s) ±s) | 342±106 | 273±79 | -2.393 | 0.021 |
| IL-6 [ng/L,M(P25,P75)] | 15.2(7.0,21.9) | 9.8(3.8,14.7) | -1.637 | 0.102 |
| IL-8 [ng/L,M(P25,P75)] | 41(17,107) | 86(21,215) | -0.725 | 0.469 |
| TNF-α [ng/L,M(P25,P75)] | 13.0(11.1,30.0) | 23.5(9.2,93.2) | -1.118 | 0.264 |
| ESR [mm/h,M(P25,P75)] | 29(23,66) | 17.0(11.0,51.5) | -1.929 | 0.054 |
| hsCRP [mg/L,M(P25,P75)] | 27.28(6.52,73.47) | 9.36(3.14,25.31) | -1.824 | 0.068 |
| 活动性肛周病变[例(%)] | 9(39.1) | 2(9.5) | 5.132 | 0.023 |
| 肠瘘[例(%)] | 11(47.8) | 6(28.6) | 1.717 | 0.190 |
| 肠梗阻[例(%)] | 6(26.1) | 5(23.8) | 0.030 | 0.862 |
| 消化道大出血[例(%)] | 0(0) | 4(19.0) | - | 0.044 |
| 维生素D补充剂[例(%)] | 2(8.7) | 5(23.8) | - | 0.232 |
注:T-25(OH)D:25羟维生素D;Alb:血清白蛋白;Hb:血红蛋白;CDAI:克罗恩病活动指数;IL:白细胞介素;TNF:肿瘤坏死因子;ESR:红细胞沉降率;hsCRP:超敏C反应蛋白;-:采用Fisher确切概率法统计分析,无统计量
本研究结果表明,CD患者血清T-25(OH)D缺乏或不足患病率高,血清T-25(OH)D水平与CDAI呈负相关,与外周血促炎细胞因子IL-6、炎症指标hsCRP和ESR均呈负相关,而与血清Alb、Hb和BMI均呈正相关。CD活动期患者并发感染比例高达52.3%,CD并发感染的患者血清T-25(OH)D、Alb水平较未并发感染的患者更低、CDAI更高。
我国CD患者中维生素不足或缺乏患病率高。2015年我国一项多中心流行病学调查显示,健康人血清T-25(OH)D为(19.4±6.4)μg/L,维生素D不足或缺乏者患病率为55.9%[9]。而本研究中CD患者血清T-25(OH)D为(16.0±7.7)μg/L,较健康人群低;维生素D不足和缺乏者患病率高达73.3%,较健康人群高。且本研究提示血清T-25(OH)D水平与CD疾病活动度呈负相关,与国内外文献报道一致[4,10]。CD患者体内维生素D水平低与其饮食受限、肠道切除或肠道炎症导致吸收功能下降、紫外线暴露减少、糖皮质激素等药物副作用和患者维生素D/VDR通路相关基因单核苷酸基因多态性相关[11]。
CD患者血清T-25(OH)D水平与外周血促炎细胞因子IL-6呈负相关。IL-6可由单核细胞、巨噬细胞、B淋巴细胞或T淋巴细胞等多种免疫细胞产生[12],CD患者外周血IL-6升高,被认为是炎症持续的标志[13],与CD疾病活动度呈正相关,IL-6可激活NF-κB通路、增强上皮细胞通透性、导致肠黏膜微循环障碍等。本研究发现,CD患者血清T-25(OH)D水平与外周血IL-6呈负相关。临床研究表明,补充维生素D可降低外周血IL-6水平[12,14]。体外实验也证明1.25(OH)2D3可抑制外周血单核细胞、巨噬细胞和T细胞产生IL-6[15,16]。IL-6的产生与p38蛋白激酶磷酸化和激活相关[15,17],而1,25(OH)D可通过上调丝裂原活化蛋白激酶(MAPK)磷酸酶1[15]或MAPK磷酸酶5[18]表达,导致p38去磷酸化;或抑制PI3K/Alt/NF-κB信号通路[19]抑制IL-6产生。
维生素D通过作用于VDR,可上调防御素和抗菌肽表达,增强黏膜免疫屏障,发挥抗感染作用。本研究发现CD合并感染组患者血清T-25(OH)D水平、白蛋白水平均较非感染组更低,而CDAI较非感染组明显升高。CD患者由于营养不良、肠黏膜屏障破坏、免疫紊乱及免疫抑制药物应用,为感染高危人群,文献报道IBD患者并发CDI与血清低维生素D水平相关[20]。补充维生素D可减低IBD患者上呼吸道感染发生率[21]。提醒临床医师应重视对CD患者血清维生素D水平的评估,并积极纠正维生素D不足或缺乏状态,以减低其感染风险。
本研究仍存在一定局限性。首先,本研究为回顾性研究,部分资料不完备,文献报道体内维生素D水平受饮食、日照等环境因素影响[22,23],但本研究未能获得患者饮食习惯、长期居住地及室外活动习惯等资料,未能评估环境因素对CD患者维生素D水平的影响;其次,本研究为横断面研究,未纳入随访资料,血清T-25(OH)D水平对疾病治疗反应、炎症相关结直肠癌的发生等疾病预后的影响无法评价。
综上,CD患者中,并发维生素D不足或缺乏患病率高,CD合并感染的患者体内维生素D水平更低。血清T-25(OH)D水平与CD患者疾病活动度、外周血IL-6及炎症指标均呈负相关。CD患者体内维生素D不足或缺乏可能影响CD患者疾病活动度和感染的发生,积极评估CD患者体内维生素D水平并纠正其维生素D不足或缺乏或可使患者从中获益。
所有作者均声明不存在利益冲突



























