
分析原发性肾上腺皮质功能减退症(PAI)的病因构成及不同类型的临床特点。
回顾性分析北京协和医院内分泌科1981年10月至2019年6月以PAI为首发症状的病例资料,对病因进行分析并总结临床特点。
共纳入PAI患者131例,年龄0~73岁,其中男87例,女44例;青少年起病57例,成年起病74例。青少年PAI的首要病因为基因缺陷,占52.6%(30/57),其中DAX1基因缺陷占50.0%(15/30);其次为自身免疫,占比为22.8%(13/57)。成年PAI的首要病因为感染,占58.1%(43/74),其中以肾上腺结核为主(93.0%,40/43);自身免疫占19.0%(14/74)。和结核组相比,自身免疫组患者女性更多见,起病年龄更小,血皮质醇、血钠、血糖、血肌酐和醛固酮的水平更低(均P<0.05),血钾、肾素水平更高(均P<0.05)。
本组PAI病例成年组感染比例高于青少年组,成年PAI的最常见病因是肾上腺结核;基因缺陷是青少年PAI的最常见病因,DAX1基因缺陷占比最多。自身免疫性肾上腺炎较肾上腺结核对肾上腺皮质的功能影响更严重。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肾上腺皮质功能减退症(PAI)是指原发于肾上腺的各种病变导致肾上腺皮质产生糖皮质激素和(或)盐皮质激素水平下降所致的一类全身性疾病[1,2],又称艾迪生病(以下均称艾迪生病),是一种罕见疾病,发病率为每年0.4/10万,患病率为10~14/10万[3,4]。艾迪生病的常见病因有自身免疫、感染、手术、基因异常、肾上腺原发或转移性肿瘤和药物等[5]。在欧美国家,自身免疫因素在所有病因中占70%~90%[6],但在欠发达国家,肾上腺结核曾被报道是引起艾迪生病的最常见原因[7]。国内尚缺乏艾迪生病的流行病学调查数据。既往文献提示20世纪50~60年代肾上腺结核是引起艾迪生病的最常见原因,随着结核的有效防控,多数学者认为目前自身免疫已成为最常见病因,但尚缺乏相关数据支持。此外,目前我国每年新发结核病患者约90万,居世界第3位[8],合并肾上腺结核的比例也不明确。故我们对近38年在北京协和医院内分泌科长期规律随访,以肾上腺皮质功能不全(AI)为首要表现的131例艾迪生病患者临床资料进行回顾性分析,以明确艾迪生病的病因构成和临床特点。
1981年10月至2019年6月于北京协和医院内分泌科就诊并长期随访的资料完整的艾迪生病患者。因先天性肾上腺皮质增生症(CAH)如21羟化酶缺陷症、11β-羟化酶缺陷症、17-羟化酶缺陷症、3β羟类固醇脱氢酶缺陷症等类型首诊症状多为性发育异常,而非AI,这类病例不纳入本研究。
纳入标准:符合艾迪生病的诊断[5]。(1)存在肾上腺皮质功能不全的临床表现(如乏力、食欲减退、体重减轻、皮肤黏膜色素沉着等);(2)实验室检查:清晨血总皮质醇<140 nmol/L,血浆促肾上腺皮质激素(ACTH)>正常上限2倍;(3)对于临床表现不典型且血皮质醇水平>138 nmol/L者进一步行低血糖兴奋试验明确诊断,低血糖后血皮质醇峰值<496.8 nmol/L考虑存在AI。排除标准:(1)下丘脑-垂体病因引起的继发性AI(包括长期应用外源性糖皮质激素引起的三发性AI);(2)因性发育异常为首诊症状的CAH;(3)自主分泌皮质醇的肾上腺肿瘤或结节性增生术后、因库欣病双侧肾上腺切除术后引起的AI。
结合北京协和医院艾迪生病诊疗常规并参考国内外艾迪生病诊治相关指南[5]。对艾迪生病症进行相关检查,筛查自身免疫性肾上腺炎及多内分泌腺自身免疫综合征(APS)、肾上腺脑白质营养不良;所有患者常规进行肾上腺CT检查,如有肾上腺占位,进一步筛查结核、肿瘤等;对于无明显肾上腺占位患者,筛查浆细胞疾病、巨细胞病毒感染和艾滋病毒感染等;上述检查均阴性的儿童及青少年起病的患者行相关基因检测;最后结合上述检查分析艾迪生病的病因。
采用SPSS 20.0统计软件进行数据分析,符合正态分布的定量资料用 ±s表示,两组间比较采用独立样本t检验;非正态分布的定量资料用中位数(四分位数)[M(Q1,Q3)]表示,两组间比较采用Wilcoxon秩和检验。定性资料用例数及百分比表示,两组间比较采用χ2检验。均为双侧检验,P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验;非正态分布的定量资料用中位数(四分位数)[M(Q1,Q3)]表示,两组间比较采用Wilcoxon秩和检验。定性资料用例数及百分比表示,两组间比较采用χ2检验。均为双侧检验,P<0.05为差异有统计学意义。
根据入选和排除标准,纳入艾迪生病患者131例,其中男87例,女44例(男女比例2∶1),年龄范围0~73岁;青少年起病57例,起病年龄3(0,11)岁;成年起病74例,起病年龄43(36,50)岁。
根据起病年龄将艾迪生病患者分为青少年组(起病年龄<18岁)和成年组(起病年龄≥18岁)。青少年艾迪生病最常见症状为乏力和呕吐(均为40.8%),最常见体征为色素沉着(100%);成年组艾迪生病最常见的症状和体征分别为乏力(68.2%)和色素沉着(86.4%)。两组比较结果显示,成年组艾迪生病患者乏力、纳差、消瘦、头晕等症状的比例均高于青少年组(均P<0.05),色素沉着比例低于青少年组(P=0.017),两组低血压发生比例差异无统计学意义(P=0.835)(表1)。
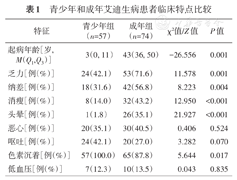
青少年和成年艾迪生病患者临床特点比较
青少年和成年艾迪生病患者临床特点比较
| 特征 | 青少年组(n=57) | 成年组(n=74) | χ2值/Z值 | P值 |
|---|---|---|---|---|
| 起病年龄[岁,M(Q1,Q3)] | 3(0, 11) | 43(36, 50) | -26.556 | 0.001 |
| 乏力[例(%)] | 24(42.1) | 53(71.6) | 11.578 | 0.001 |
| 纳差[例(%)] | 18(31.6) | 42(56.8) | 8.223 | 0.004 |
| 消瘦[例(%)] | 8(14.0) | 32(43.2) | 12.950 | <0.001 |
| 头晕[例(%)] | 1(1.8) | 26(35.1) | 21.927 | <0.001 |
| 恶心[例(%)] | 20(35.1) | 30(40.5) | 0.406 | 0.524 |
| 呕吐[例(%)] | 24(42.1) | 20(27.0) | 3.282 | 0.070 |
| 色素沉着[例(%)] | 57(100.0) | 65(87.8) | 5.644 | 0.017 |
| 低血压[例(%)] | 7(12.3) | 10(13.5) | 0.043 | 0.835 |
成年组艾迪生病患者血皮质醇8∶00、24 h尿游离皮质醇(24 h UFC)分别为195.4(112.8,292.6)nmol/L和13.7(8.5,25.7)μg/24 h;青少年组艾迪生病患者血皮质醇、24 h UFC分别为189.3(61.6,231.8)nmol/L和21.9(12.2,41.6)μg/24 h。成年组ACTH为165.2(126.9,216.7)pmol/L,青少年组ACTH为227.5(177.8,245.1)pmol/L。此外,ACTH超过最高可测值(>275 pmol/L)患者的比例,青少年组(30例,52.6%)明显多于成年组(18例,24.3%)(P=0.001);成年组ACTH、血钙、尿素氮、血浆肾素活性、血管紧张素Ⅱ水平均低于青少年组(均P<0.05),血皮质醇、空腹血糖、血肌酐、醛固酮水平均高于青少年组(均P<0.05)。两组间24 h UFC、血钠、血钾、血氯、促甲状激素(TSH)水平差异均无统计学意义(均P>0.05)(表2)。
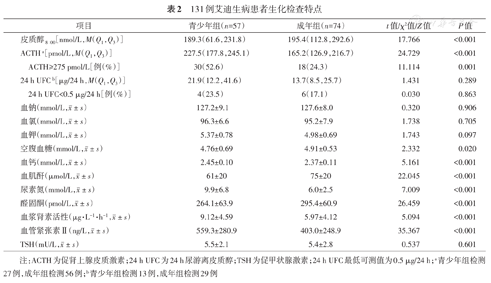
131例艾迪生病患者生化检查特点
131例艾迪生病患者生化检查特点
| 项目 | 青少年组(n=57) | 成年组(n=74) | t值/χ2值/Z值 | P值 | |
|---|---|---|---|---|---|
| 皮质醇8∶00[nmol/L,M(Q1,Q3)] | 189.3(61.6,231.8) | 195.4(112.8,292.6) | 17.766 | <0.001 | |
| ACTHa[pmol/L,M(Q1,Q3)] | 227.5(177.8,245.1) | 165.2(126.9,216.7) | 24.729 | <0.001 | |
| ACTH≥275 pmol/L[例(%)] | 30(52.6) | 18(24.3) | 11.114 | 0.001 | |
| 24 h UFCb[μg/24 h,M(Q1,Q3)] | 21.9(12.2,41.6) | 13.7(8.5,25.7) | 1.431 | 0.289 | |
| 24 h UFC<0.5 μg/24 h[例(%)] | 4(23.5) | 6(17.1) | 0.030 | 0.863 | |
血钠(mmol/L, ±s) ±s) | 127.2±9.1 | 127.6±8.0 | 0.320 | 0.906 | |
血氯(mmol/L, ±s) ±s) | 96.3±6.6 | 95.2±7.9 | 1.738 | 0.705 | |
血钾(mmol/L, ±s) ±s) | 5.37±0.78 | 4.98±0.69 | 1.743 | 0.097 | |
空腹血糖(mmol/L, ±s) ±s) | 4.76±0.69 | 4.91±0.53 | 2.332 | 0.020 | |
血钙(mmol/L, ±s) ±s) | 2.45±0.10 | 2.37±0.11 | 5.161 | <0.001 | |
血肌酐(μmol/L, ±s) ±s) | 61±20 | 75±20 | 22.045 | <0.001 | |
尿素氮(mmol/L, ±s) ±s) | 9.9±6.8 | 6.0±2.5 | 7.009 | <0.001 | |
醛固酮(pmol/L, ±s) ±s) | 264.1±63.9 | 295.4±60.9 | 26.459 | <0.001 | |
血浆肾素活性(μg·L-1·h-1, ±s) ±s) | 9.12±4.59 | 5.97±4.12 | 5.094 | <0.001 | |
血管紧张素Ⅱ(ng/L, ±s) ±s) | 559.3±280.9 | 403.0±248.9 | 35.367 | <0.001 | |
TSH(mU/L, ±s) ±s) | 5.5±2.1 | 5.4±2.8 | 0.537 | 0.601 | |
注:ACTH为促肾上腺皮质激素;24 h UFC为24 h尿游离皮质醇;TSH为促甲状腺激素;24 h UFC最低可测值为0.5 μg/24 h;a青少年组检测27例,成年组检测56例;b青少年组检测13例,成年组检测29例
本组数据提示艾迪生病首要病因仍为感染(35.1%),其中肾上腺结核在感染病因中占绝大多数(91.3%),其次为基因缺陷(24.4%),自身免疫仅占20.6%,原因不明为11.5%。血管性病变(出血或血管炎)累及肾上腺有6例(4.6%),其他系统疾病如非血管炎性结缔组织病、血液系统疾病等累及肾上腺有4例(3.1%),恶性肿瘤肾上腺转移1例(0.7%)(表3)。
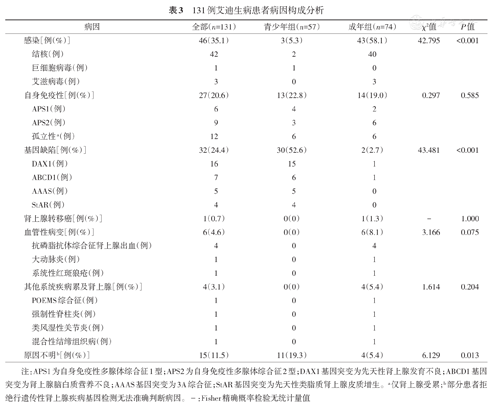
131例艾迪生病患者病因构成分析
131例艾迪生病患者病因构成分析
| 病因 | 全部(n=131) | 青少年组(n=57) | 成年组(n=74) | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 感染[例(%)] | 46(35.1) | 3(5.3) | 43(58.1) | 42.795 | <0.001 | |
| 结核(例) | 42 | 2 | 40 | |||
| 巨细胞病毒(例) | 1 | 1 | 0 | |||
| 艾滋病毒(例) | 3 | 0 | 3 | |||
| 自身免疫性[例(%)] | 27(20.6) | 13(22.8) | 14(19.0) | 0.297 | 0.585 | |
| APS1(例) | 6 | 4 | 2 | |||
| APS2(例) | 9 | 3 | 6 | |||
| 孤立性a(例) | 12 | 6 | 6 | |||
| 基因缺陷[例(%)] | 32(24.4) | 30(52.6) | 2(2.7) | 43.481 | <0.001 | |
| DAX1(例) | 16 | 15 | 1 | |||
| ABCD1(例) | 7 | 6 | 1 | |||
| AAAS(例) | 5 | 5 | 0 | |||
| StAR(例) | 4 | 4 | 0 | |||
| 肾上腺转移癌[例(%)] | 1(0.7) | 0(0) | 1(1.3) | - | 1.000 | |
| 血管性病变[例(%)] | 6(4.6) | 0(0) | 6(8.1) | 3.166 | 0.075 | |
| 抗磷脂抗体综合征肾上腺出血(例) | 4 | 0 | 4 | |||
| 大动脉炎(例) | 1 | 0 | 1 | |||
| 系统性红斑狼疮(例) | 1 | 0 | 1 | |||
| 其他系统疾病累及肾上腺[例(%)] | 4(3.1) | 0(0) | 4(5.4) | 1.614 | 0.204 | |
| POEMS综合征(例) | 1 | 0 | 1 | |||
| 强制性脊柱炎(例) | 1 | 0 | 1 | |||
| 类风湿性关节炎(例) | 1 | 0 | 1 | |||
| 混合性结缔组织病(例) | 1 | 0 | 1 | |||
| 原因不明b[例(%)] | 15(11.5) | 11(19.3) | 4(5.4) | 6.129 | 0.013 | |
注:APS1为自身免疫性多腺体综合征1型;APS2为自身免疫性多腺体综合征2型;DAX1基因突变为先天性肾上腺发育不良;ABCD1基因突变为肾上腺脑白质营养不良;AAAS基因突变为3A综合征;StAR基因突变为先天性类脂质肾上腺皮质增生。a仅肾上腺受累;b部分患者拒绝行遗传性肾上腺疾病基因检测无法准确判断病因。-:Fisher精确概率检验无统计量值
根据不同年龄组区分,成年艾迪生病首要病因仍为感染,占比最高(58.1%,43/74),其中结核感染在感染病因中占大多数(93.0%,40/43),自身免疫性肾上腺炎占19.0%(14/74),血管性病变累及肾上腺有6例(占8.1%),原因不明占5.4%,其他系统疾病累及肾上腺、基因缺陷和恶性肿瘤肾上腺转移各有4例、2例和1例。青少年艾迪生病首要病因为基因缺陷(52.6%),其中DAX1基因缺陷引起的先天性肾上腺发育不良占50%;其次为自身免疫(22.8%)、原因不明11例(19.3%),感染仅有3例(5.3%)。两组比较结果显示,成年组感染所占比例远高于青少年组(58.1%比5.3%),基因缺陷(2.7%比52.6%)比例明显低于青少年组(均P<0.05),其他病因所占比例在两组间差异均无统计学意义(均P>0.05)(表3)。
本组数据提示,艾迪生病病因中肾上腺结核感染42例,自身免疫性肾上腺炎27例,现将两组临床特点整理分析如下。肾上腺结核男性多见(男女比例1.5∶1),起病年龄(47.4±12.6)岁,最常见症状是乏力(71.4%),最常见体征为色素沉着(95.2%),血皮质醇149.6(87.5,233.5)nmol/L,ACTH>275 pmol/L有12例,占比为28.6%,ACTH<275 pmol/L者30例(71.4%),其ACTH为165.2(123.0,245.1)pmol/L,血钾、血钠、空腹血糖水平分别为(4.60±0.51)mmol/L、(134.3±6.8)mmol/L、(5.11±0.88)mmol/L;肾上腺CT阳性发现(增大、占位、钙化)率为95.2%,维持阶段氢化可的松用量为(30±7)mg/d。自身免疫性肾上腺炎方面,女性多见(男女比例为1∶2.4),起病年龄(37.0±10.6)岁,最常见症状是乏力(74.1%),最常见体征为色素沉着(100%),血皮质醇21.3(5.5,31.5)nmol/L,ACTH>275 pmol/L比例为44.4%,<275 pmol/L比例为55.6%,其ACTH为176.4(87.1,213.8)pmol/L,平均血钾、血钠、空腹血糖水平分别为(4.89±0.98)mmol/L、(131.7±8.1)mmol/L、(4.79±0.64)mmol/L;肾上腺CT阳性发现(增大、占位、钙化)率为11.1%(图1),维持阶段平均氢化可的松用量(32±9)mg/d。
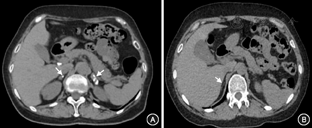

与结核组相比,自身免疫组女性患者更多见(男女比例1∶2.4和1∶0.7),起病年龄更小[(37.0±10.6)岁比(47.4±12.6)岁,P<0.001],症状中呕吐(48.1%比21.4%)和低血压比例更高(29.6%比7.1%),就诊时平均血压更低(均P<0.05);自身免疫组患者血皮质醇、血钠、血氯、空腹血糖、血肌酐、醛固酮水平更低(均P<0.05),血钾、血磷、尿素氮、肾素活性、血管紧张素Ⅱ、TSH水平、抗甲状腺过氧化物酶抗体(A-TPO)阳性比例更高(均P<0.05);两组间病程、乏力症状、色素沉着比例、血钙及维持阶段糖皮质激素需要量差异均无统计学意义(均P>0.05)(表4)。
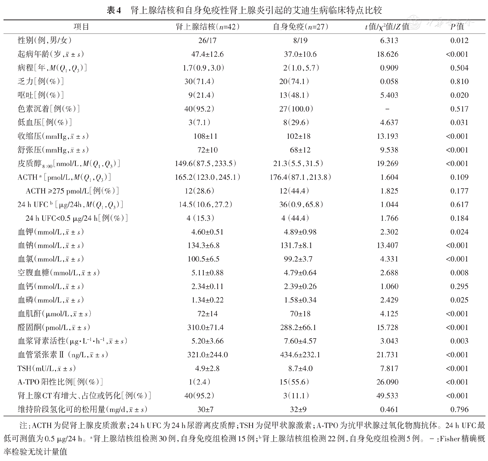
肾上腺结核和自身免疫性肾上腺炎引起的艾迪生病临床特点比较
肾上腺结核和自身免疫性肾上腺炎引起的艾迪生病临床特点比较
| 项目 | 肾上腺结核(n=42) | 自身免疫(n=27) | t值/χ2值/Z值 | P值 | |
|---|---|---|---|---|---|
| 性别(例,男/女) | 26/17 | 8/19 | 6.313 | 0.012 | |
起病年龄(岁, ±s) ±s) | 47.4±12.6 | 37.0±10.6 | 18.626 | <0.001 | |
| 病程[年,M(Q1,Q3)] | 1.7(0.9,3.0) | 2(1.0,5.7) | 0.909 | 0.504 | |
| 乏力[例(%)] | 30(71.4) | 20(74.1) | 0.058 | 0.810 | |
| 呕吐[例(%)] | 9(21.4) | 13(48.1) | 5.403 | 0.020 | |
| 色素沉着[例(%)] | 40(95.2) | 27(100.0) | - | 0.517 | |
| 低血压[例(%)] | 3(7.1) | 8(29.6) | 4.637 | 0.031 | |
收缩压(mmHg, ±s) ±s) | 108±11 | 102±18 | 13.193 | <0.001 | |
舒张压(mmHg, ±s) ±s) | 72±10 | 68±12 | 9.538 | <0.001 | |
| 皮质醇8∶00[nmol/L,M(Q1,Q3)] | 149.6(87.5,233.5) | 21.3(5.5,31.5) | 19.269 | <0.001 | |
| ACTH a[pmol/L,M(Q1,Q3)] | 165.2(123.0,245.1) | 176.4(87.1,213.8) | 1.604 | 0.109 | |
| ACTH ≥275 pmol/L[例(%)] | 12(28.6) | 12(44.4) | 1.825 | 0.177 | |
| 24 h UFC b[μg/24h,M(Q1,Q3)] | 14.5(10.6,27.2) | 36(0.9,65.8) | 1.044 | 0.617 | |
| 24 h UFC<0.5 μg/24 h[例(%)] | 4(15.3) | 4(44.4) | 1.766 | 0.184 | |
血钾(mmol/L, ±s) ±s) | 4.60±0.51 | 4.89±0.98 | 2.302 | 0.024 | |
血钠(mmol/L, ±s) ±s) | 134.3±6.8 | 131.7±8.1 | 13.407 | <0.001 | |
血氯(mmol/L, ±s) ±s) | 100.5±6.5 | 99.2±3.7 | 4.331 | <0.001 | |
空腹血糖(mmol/L, ±s) ±s) | 5.11±0.88 | 4.79±0.64 | 2.688 | 0.008 | |
血钙(mmol/L, ±s) ±s) | 2.34±0.11 | 2.39±0.26 | 1.060 | 0.295 | |
血磷(mmol/L, ±s) ±s) | 1.34±0.22 | 1.58±0.34 | 2.429 | 0.025 | |
血肌酐(μmol/L, ±s) ±s) | 72±14 | 70±18 | 4.125 | <0.001 | |
醛固酮(pmol/L, ±s) ±s) | 310.0±71.4 | 288.2±66.1 | 15.728 | <0.001 | |
血浆肾素活性(μg·L-1·h-1, ±s) ±s) | 5.20±3.66 | 7.60±4.57 | 3.043 | 0.003 | |
血管紧张素Ⅱ(ng/L, ±s) ±s) | 321.0±244.0 | 434.6±232.1 | 21.731 | <0.001 | |
TSH(mU/L, ±s) ±s) | 4.9±2.8 | 8.7±4.0 | 7.817 | <0.001 | |
| A-TPO阳性比例[例(%)] | 1(2.4) | 15(55.6) | 26.090 | <0.001 | |
| 肾上腺CT有增大、占位或钙化[例(%)] | 40(95.2) | 3(11.1) | 49.533 | <0.001 | |
维持阶段氢化可的松用量(mg/d, ±s) ±s) | 30±7 | 32±9 | 0.461 | 0.796 | |
注:ACTH为促肾上腺皮质激素;24 h UFC为24 h尿游离皮质醇;TSH为促甲状腺激素;A-TPO为抗甲状腺过氧化物酶抗体。24 h UFC最低可测值为0.5 μg/24 h。a肾上腺结核组检测30例,自身免疫组检测15例;b肾上腺结核组检测22例,自身免疫组检测5例。-:Fisher精确概率检验无统计量值
艾迪生病是一种罕见疾病,病因构成尚缺乏国内大样本的流行病学资料,本研究总结了北京协和医院近38年来长期规律随访的艾迪生病131例,是目前已知国内最大规模的单中心数据。结果提示,结核感染仍是整体患者特别是成年艾迪生病最常见的病因,而基因突变是青少年艾迪生病最常见病因。
在抗结核药物广泛应用之前,艾迪生病的最常见原因是结核感染,占80%以上,目前国外文献报道自身免疫肾上腺炎是艾迪生病的最常见原因,约占80%[1,2,3,4,5,9]。有文献报道,在活动性结核患者中有6%的患者会累及肾上腺[10],多达12%的患者合并无症状性肾上腺结核[11],国内例数有限的艾迪生病临床研究(15~26例)提示结核感染占65%~80%[12,13]。本组大样本的单中心数据提示艾迪生病首要病因仍为结核感染,整体占比32.1%,其次为基因缺陷,占24.4%,自身免疫因素仅占20.6%。按患者发病年龄进一步进行亚组分析发现,成年艾迪生病病因构成中结核感染占比高达54.1%,自身免疫因素仅占19.0%,提示国内外艾迪生病病因构成的不同,结核感染仍是国内特别是成年人艾迪生病最常见的病因。本研究提示青少年艾迪生病首要病因为基因突变(52.6%),其中DAX1基因缺陷引起的先天性肾上腺发育不良占50%,这与国内既往相关研究类似。瑞金医院曾报道25例艾迪生病男童,基因检测发现10例DAX-1基因缺陷(40%),1例SF-1基因缺陷(4%)[14]。可见青少年艾迪生病的基因突变病因较为常见。除了DAX1基因突变外,本组病例中还有6例ABCD1基因突变(20%),5例AAAS基因突变(16.7%)。这些患者的首诊症状均为艾迪生病且未出现其他系统的受累表现,但这些基因突变引起的艾迪生病有其他系统的症状,后续诊治策略多有不同,仅凭临床表现很难早期区分病因,因此对原因不明的艾迪生病患儿需加强相关肾上腺突变基因的检测[15]。自身免疫因素引起的艾迪生病在西方国家比例逐渐升高,一方面考虑与西方国家结核感染率逐渐下降有关,另一方面需考虑与我国针对肾上腺相关抗体检测并未普及有关[16]。自身免疫性艾迪生病虽然可伴有性功能障碍、甲状腺功能异常、1型糖尿病、白斑病、恶性贫血及甲状旁腺功能减退[17],但这些症状并非同步出现,因此在缺乏针对肾上腺相关抗体检测的情况下,确诊APS往往需要长期随访。此外部分系统性疾病也会累及到肾上腺,引起艾迪生病,本中心发现POEMS综合征、强直性脊柱炎、类风湿性关节炎、混合性结缔组织病引起艾迪生病各1例[18],此外发现由抗磷脂抗体综合征引起肾上腺出血4例,大动脉炎1例,系统性红斑狼疮1例,近期有文献将上述疾病均归因为血管性病变[2]。这提示我们如果血液系统、血管性病变及自身免疫系统疾病患者出现肤色变黑、乏力、低血压、低钠血症等时需注意评估肾上腺功能,筛查有无艾迪生病可能,以早期识别、早期治疗,避免肾上腺危象的发生。
进一步对肾上腺结核及自身免疫性肾上腺炎这两组人群临床特点进行比较,结果发现,结核好发于中年男性,自身免疫性肾上腺炎好发青年女性。与结核组患者相比,自身免疫组患者就诊时病情更重。此外,本组数据中自身免疫性艾迪生病患者TSH水平较结核组升高明显,一方面考虑与自身免疫组多合并自身免疫性甲状腺疾病,易引起TSH升高;另一方面也考虑与自身免疫组患者皮质醇缺乏更加明显,进一步促进了TSH的分泌有关。肾上腺CT检出率方面,结核感染多有肾上腺增大和钙化,故肾上腺结核感染CT多表现为肾上腺增粗、钙化(图1A),双侧多见,故阳性检出率较高(本组数据95.2%有阳性发现),需注意的是结核感染后期也有少数患者肾上腺缩小,故肾上腺CT无阳性发现不能除外结核感染,仍需结合病史并积极寻找其他结核感染证据。而自身免疫性肾上腺炎多表现为肾上腺纤细或无明显异常(图1B)。此外需注意的是肾上腺结核仅占双侧肾上腺病变的3.3%左右,发现肾上腺占位尚需考虑累及肾上腺的其他疾病[19]。部分CAH患者双侧肾上腺增生伴腺瘤变,部分也可伴钙化[20],这类患者多有性征发育异常,注意鉴别。
综上所述,通过对本组131例艾迪生病患者病因构成分析,结核感染仍是艾迪生病最常见病因,尤其是成年艾迪生病,而基因缺陷是青少年艾迪生病最常见病因,自身免疫性肾上腺炎在艾迪生病病因中占比不高,但和肾上腺结核相比,肾上腺皮质功能破坏可能更加严重。这一病因构成与国外文献报道不同,尚需要更大范围的艾迪生病流行病学调查明确确切的病因构成,对青少年艾迪生病应及时进行相关基因检测以早期明确病因,制定个体化诊治方案。
所有作者均声明不存在利益冲突



























