
了解儿童金黄色葡萄球菌(金葡菌)肺炎致病株分子特征及耐药性,供临床诊治参考。
收集2016年1月至2017年3月首都医科大学附属北京儿童医院确诊为金葡菌肺炎患者分离株,采用头孢西丁纸片法和mecA检测鉴定耐甲氧西林金葡菌(MRSA)或甲氧西林敏感金葡菌(MSSA);对所有菌株进行多位点序列分型(MLST)和葡萄球菌蛋白A(spa)分型,并对MRSA菌株进行葡萄球菌盒氏染色体(SCCmec)分型;采用PCR方法检测21种超抗原(SAgs)基因、杀白细胞素(PVL)基因、黏附基因fnbB、cna;采用琼脂稀释法、E-test检测14种抗生素体外药物敏感性。
共收集42株金葡菌,其中MRSA、MSSA各21株。MRSA的优势克隆为ST59-SCCmecⅣa-t437(71.4%);MSSA的分型较为分散,以ST25-t078(14.2%)最多见。42株金葡菌中有36株(85.7%)至少携带1种超抗原基因,最常见的超抗原基因型为sek-seq(21.4%);MRSA pvl基因携带率(52.3%)明显高于MSSA(14.2%),而MSSA fnbB及cna基因携带率(42.8%和47.6%)明显高于MRSA(均为9.5%),差异均有统计学意义(均P<0.05)。本组金葡菌多重耐药率达90.4%(38/42株)。
MRSA在儿童金葡菌肺炎致病株中检出率高,其主要克隆型为ST59-SCCmecⅣa-t437。儿童肺炎金葡菌分离株的超抗原基因携带率和多重耐药率较高,MRSA菌株常携带pvl基因,而MSSA菌株携带fnbB、cna更常见。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
金黄色葡萄球菌(简称金葡菌)可引起多种疾病。全球范围内金葡菌(Staphylococcus aureus)的流行给临床治疗带来诸多困难,是世界卫生组织呼吁急需研发针对性抗生素的细菌之一。据2017年中国细菌耐药性监测网(CHINET)细菌耐药性监测报告[1],所有临床分离株中金葡菌检出率为9.03%,在革兰阳性菌中占第1位。金葡菌毒力因子很多,流行病学研究表明,毒力因子携带与克隆型相关,与临床疾病也存在一定相关性。国内既往对金葡菌皮肤软组织感染分离菌株有研究报道,但对引起呼吸道感染的金葡菌研究相对较少,因此本研究对首都医科大学附属北京儿童医院确诊为金葡菌肺炎的分离株进行抗生素耐药性和毒力基因检测等研究,以期为临床诊治提供参考。
本研究所用菌株为分离自2016年1月至2017年3月首都医科大学附属北京儿童医院收治的42例肺炎患儿,所有病例的临床出院诊断为金葡菌肺炎,且进行了针对性抗生素治疗。
金葡菌肺炎诊断标准:患者痰液、支气管肺泡灌洗液、胸腔积液或血培养阳性,临床有肺炎表现,X线胸片或肺CT呈现肺炎影像[2]。
肺炎患儿符合以下至少1条的可诊断为重症肺炎:(1)胸片或肺CT出现肺坏死或空洞;(2)并脓胸;(3)需要入住重症监护室(ICU)[3]。
使用硅胶模型TM基因组DNA提取试剂盒(北京赛百盛公司),按照试剂盒说明书操作。溶葡萄球菌素(1 200 U/mg)购自加拿大BBI公司。
金葡菌42株,其中支气管灌洗液34株,血液6株,胸腔穿刺液2株。同一病例分离出的金葡菌视作1株。临床标本接种后通过菌落形态学鉴定出金葡菌,然后通过采用凝固酶试验和PCR方法检测nuc基因再确认。按照2013年美国临床实验室标准化研究所推荐的头孢西丁纸片(英国Oxoid公司)法及PCR方法检测mecA基因鉴定耐甲氧西林金葡菌(MRSA)菌株。以金葡菌标准株ATCC25923作为对照质控菌株。
使用PCR扩增金葡菌的7个管家基因,即arcC、aroE、glpF、gmk、pta、tpi和yqil。扩增引物参考Enright等[4]的设计。扩增片段由北京天一辉远生物技术有限责任公司进行测序。测序结果在MLST数据网站(http://www.mlst.net/)上比对等位基因的型别,根据7个等位基因型的组成判定菌株的序列型(sequence type,ST)。
采用Milheiriço等[5,6]提出的多重PCR方法检测SCCmec分型及亚型。SCCmec分型的标准菌株由日本顺天堂大学Teruyo Ito教授馈赠。
spa分型的PCR扩增引物为spa-F(5′-GACGATCCTFCAGTGAGCAAAG-3′)和spa-R(5′GCAGCAAGTCAGCAGTAG-3′)。扩增片段由北京天一辉远生物技术有限责任公司进行测序,测序结果通过spa分型数据库(http://spaserver.ridom.de/)进行分型。
按照Holtfreter等[7]的报道方法依次进行5组多重PCR反应和单一PCR反应。检测的基因为21种超抗原(SAgs)基因、杀白细胞素(panton-valentine leukocidin,PVL)基因、纤维连接蛋白结合蛋白B(fibrnectin-binding B,FnbB)基因、胶原黏附素(collagen adhesion,CNA)基因。5组多重PCR检测靶基因分别为(1)sea、seh、see和tsst-1;(2)sed、etd、eta和sek;(3)see、seb、sen、sel和seo;(4)sen、seg、seq和sej;(5)sei、set、seu和sep。PCR产物在含Goldview的15 g/L琼脂凝胶中电泳,用凝胶成像仪观察扩增结果。
采用琼脂稀释法检测所有菌株对青霉素、苯唑西林、万古霉素、利奈唑胺、替加环素、夫西地酸、红霉素、克林霉素、庆大霉素、氯霉素、环丙沙星、利福平、莫匹罗星13种抗生素的药物敏感性,采用E-test法检测所有菌株对复方磺胺甲 唑的药物敏感性,以金葡菌ATCC29213作为对照质控菌株,记录最低抑菌浓度(minimal inhibitory concentration,MIC)。替加环素根据美国食品药品管理局(U.S.Food and Drug Administration,FDA)的标准判定:MIC≤0.5 mg/L为敏感。余均根据美国临床与实验室标准协会(CLSI)制定的标准判定,同时对3类或3类以上抗生素耐药定义为多重耐药[8]。
唑的药物敏感性,以金葡菌ATCC29213作为对照质控菌株,记录最低抑菌浓度(minimal inhibitory concentration,MIC)。替加环素根据美国食品药品管理局(U.S.Food and Drug Administration,FDA)的标准判定:MIC≤0.5 mg/L为敏感。余均根据美国临床与实验室标准协会(CLSI)制定的标准判定,同时对3类或3类以上抗生素耐药定义为多重耐药[8]。
应用SPSS 20.0软件进行统计分析。正态分布且方差齐的计量资料采用 ±s描述,组间比较采用t检验;非正态分布采用中位数(四分位数间距)表示,组间比较采用秩和检验;计数资料用例数或菌株数及率表示,率的比较采用行×列表分析(χ2检验或Fisher′s确切概率法),P<0.05为差异有统计学意义。
±s描述,组间比较采用t检验;非正态分布采用中位数(四分位数间距)表示,组间比较采用秩和检验;计数资料用例数或菌株数及率表示,率的比较采用行×列表分析(χ2检验或Fisher′s确切概率法),P<0.05为差异有统计学意义。
所有42例患儿临床诊断为金葡菌肺炎。其中重症肺炎20例(47.6%)。42例患儿中男30例,女12例,男女比例为5∶2;中位年龄2个月(13 d~5岁)。20例出现呼吸衰竭,11例并肝损害,4例出现脓毒性休克,具有肺坏死、脓胸、脑炎表现者各2例,脑死亡、噬血细胞综合征各1例。好转出院者34例,自动出院7例,死亡1例。
42株金葡菌分离株中MRSA、MSSA各21株。MRSA组与MSSA组比较,年龄、感染相关危险因素(住院史、先天性疾病)、住院天数、发热天数及外周血粒细胞数等差异均无统计学意义(均P>0.05)。
抗生素敏感性检测结果显示,青霉素、红霉素和克林霉素耐药率分别为92.8%、90.4%和83.3%。本组菌株多重耐药率达90.4%(38/42株),主要的耐药表型为青霉素-红霉素-克林霉素,占60.5%(23/38株)。其中MRSA株为95.2%(20/21株),高于MSSA株[85.7%(18/21株)],但2组比较差异无统计学意义(P>0.05),见表1。
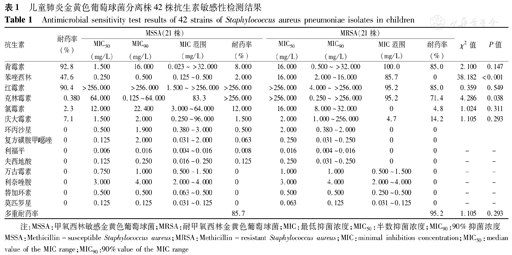
儿童肺炎金黄色葡萄球菌分离株42株抗生素敏感性检测结果
Antimicrobial sensitivity test results of 42 strains of Staphylococcus aureus pneumoniae isolates in children
儿童肺炎金黄色葡萄球菌分离株42株抗生素敏感性检测结果
Antimicrobial sensitivity test results of 42 strains of Staphylococcus aureus pneumoniae isolates in children
| 抗生素 | 耐药率(%) | MSSA(21株) | MRSA(21株) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC50(mg/L) | MIC90(mg/L) | MIC范围(mg/L) | 耐药率(%) | MIC50(mg/L) | MIC90(mg/L) | MIC范围(mg/L) | 耐药率(%) | χ2值 | P值 | ||
| 青霉素 | 92.8 | 1.500 | 16.000 | 0.023~>32.000 | 8.000 | 16.000 | 0.500~>32.000 | 100.0 | 85.0 | 2.100 | 0.147 |
| 苯唑西林 | 47.6 | 0.250 | 0.500 | 0.125~0.500 | 2.000 | 16.000 | 2.000~16.000 | 85.7 | 0 | 38.182 | <0.001 |
| 红霉素 | 90.4 | >256.000 | >256.000 | 1.500~>256.000 | >256.000 | >256.000 | 4.000~>256.000 | 95.2 | 85.0 | 0.359 | 0.549 |
| 克林霉素 | 0.380 | 64.000 | 0.125~64.000 | 83.3 | >256.000 | >256.000 | 0.250~>256.000 | 95.2 | 71.4 | 4.286 | 0.038 |
| 氯霉素 | 2.3 | 12.000 | 22.400 | 3.000~64.000 | 12.000 | 16.000 | 8.000~32.000 | 0 | 4.8 | 1.024 | 0.311 |
| 庆大霉素 | 7.1 | 1.500 | 2.000 | 0.250~96.000 | 1.500 | 2.000 | 1.000~256.000 | 4.7 | 14.2 | 1.105 | 0.293 |
| 环丙沙星 | 0 | 0.500 | 1.900 | 0.380~3.000 | 0.500 | 2.000 | 0.380~2.000 | 0 | 0 | ||
复方磺胺甲 唑 唑 | 0 | 0.125 | 2.000 | 0.031~2.000 | 0.063 | 0.250 | 0.031~0.250 | 0 | 0 | ||
| 利福平 | 0 | 0.006 | 0.016 | 0.004~0.016 | 0.008 | 0.016 | 0.004~0.016 | 0 | 0 | - | - |
| 夫西地酸 | 0 | 0.125 | 0.250 | 0.016-0.250 | 0.125 | 0.250 | 0.031~0.250 | 0 | 0 | - | - |
| 万古霉素 | 0 | 0.750 | 1.000 | 0.500-1.500 | 0 | 1.000 | 1.000 | 0.500~1.500 | 0 | - | - |
| 利奈唑胺 | 0 | 3.000 | 4.000 | 2.000~4.000 | 0 | 3.000 | 4.000 | 2.000~4.000 | 0 | - | - |
| 替加环素 | 0 | 0.500 | 0.500 | 0.063~0.500 | 0 | 0.500 | 0.500 | 0.250~0.500 | 0 | - | - |
| 莫匹罗星 | 0 | 0.125 | 0.125 | 0.031~0.125 | 0 | 0.063 | 0.125 | 0.031~0.125 | 0 | - | - |
| 多重耐药率 | 85.7 | 95.2 | 1.105 | 0.293 | |||||||
注:MSSA:甲氧西林敏感金黄色葡萄球菌;MRSA:耐甲氧西林金黄色葡萄球菌;MIC:最低抑菌浓度;MIC50:半数抑菌浓度;MIC90:90%抑菌浓度 MSSA:Methicillin-susceptible Staphylococcus aureus;MRSA:Methicillin-resistant Staphylococcus aureus;MIC:minimal inhibition concentration;MIC50:median value of the MIC range;MIC90:90%value of the MIC range
36株(85.7%,36/42株)至少携带1种超抗原基因,6株(14.2%,6/42株)未发现携带任何超抗原基因。所有菌株中未发现携带see和tsst-1基因。超抗原基因在MRSA、MSSA中携带率无明显差异,只有seq基因携带率在MRSA中明显高于MSSA分离株,差异有统计学意义(P<0.05)。pvl、fnbB、cna在MRSA及MSSA的阳性比率比较差异均有统计学意义(均P<0.05)。pvl在MRSA及MSSA的阳性比率分别为47.6%(10/21株)和14.2%(3/21株),而重症肺炎MRSA及MSSA中的阳性比率更高,分别为55.5%(5/9株)、27.2%(3/11株);fnbB及cna在MSSA的阳性率分别为42.8%(9/21株)、47.6%(10/21株),则明显高于MRSA(均为9.5%,2/21株),差异均有统计学意义(均P<0.05),在重症肺炎比率变化不大或降低,见表2、表3。
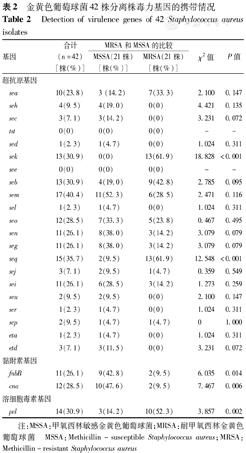
金黄色葡萄球菌42株分离株毒力基因的携带情况
Detection of virulence genes of 42 Staphylococcus aureus isolates
金黄色葡萄球菌42株分离株毒力基因的携带情况
Detection of virulence genes of 42 Staphylococcus aureus isolates
| 基因 | 合计(n=42)[株(%)] | MRSA和MSSA的比较 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| MSSA(21株)[株(%)] | MRSA(21株)[株(%)] | |||||
| 超抗原基因 | ||||||
| sea | 10(23.8) | 3 (14.2) | 7(33.3) | 2.100 | 0.147 | |
| seh | 4(9.5) | 4(19.0) | 0(0) | 4.421 | 0.135 | |
| sec | 3(7.1) | 3(14.2) | 0(0) | 3.231 | 0.072 | |
| tst | 0(0) | 0(0) | 0(0) | - | - | |
| sed | 1(2.3) | 1(4.7) | 0(0) | 1.024 | 0.311 | |
| sek | 13(30.9) | 0(0) | 13(61.9) | 18.828 | <0.001 | |
| see | 0(0) | 0(0) | 0(0) | - | - | |
| seb | 13(30.9) | 4(19.0) | 9(42.8) | 2.785 | 0.095 | |
| sem | 17(40.4) | 11(52.3) | 6(28.5) | 2.471 | 0.116 | |
| sel | 1(2.3) | 1(4.7) | 0(0) | 1.024 | 0.311 | |
| seo | 12(28.5) | 7(33.3) | 5(23.8) | 0.467 | 0.495 | |
| sen | 11(26.1) | 8(38.0) | 3(14.2) | 3.079 | 0.079 | |
| seg | 11(26.1) | 8(38.0) | 3(14.2) | 3.079 | 0.079 | |
| seq | 15(35.7) | 2(9.5) | 13(61.9) | 12.548 | <0.001 | |
| sej | 3(7.1) | 2(9.5) | 1(4.7) | 0.359 | 0.549 | |
| sei | 11(26.1) | 6(28.5) | 3(14.2) | 1.273 | 0.259 | |
| seu | 2(9.5) | 2(9.5) | 0(0) | 2.100 | 0.147 | |
| ser | 1(2.3) | 1(4.7) | 0(0) | 1.024 | 0.311 | |
| sep | 2(9.5) | 1(4.7) | 1(4.7) | 0 | 1.000 | |
| eta | 1(2.3) | 1(4.7) | 0(0) | 1.024 | 0.311 | |
| etd | 3(7.1) | 3(11.5) | 0(0) | 3.231 | 0.072 | |
| 黏附素基因 | ||||||
| fnbB | 11(26.1) | 9(42.8) | 2(9.5) | 6.035 | 0.014 | |
| cna | 12(28.5) | 10(47.6) | 2(9.5) | 7.467 | 0.006 | |
| 溶细胞毒素基因 | ||||||
| pvl | 14(30.9) | 3(14.2) | 10(52.3) | 3.857 | 0.002 | |
注:MSSA:甲氧西林敏感金黄色葡萄球菌;MRSA:耐甲氧西林金黄色葡萄球菌 MSSA:Methicillin-susceptible Staphylococcus aureus;MRSA:Methicillin-resistant Staphylococcus aureus
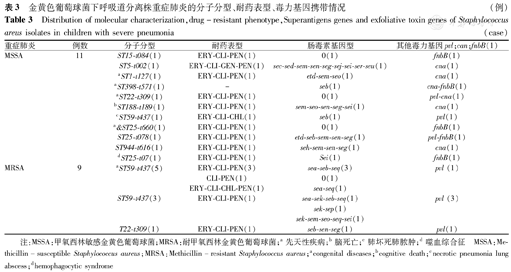
金黄色葡萄球菌下呼吸道分离株重症肺炎的分子分型、耐药表型、毒力基因携带情况(例)
Distribution of molecular characterization,drug-resistant phenotype,Superantigens genes and exfoliative toxin genes of Staphylococcus areus isolates in children with severe pneumonia(case)
金黄色葡萄球菌下呼吸道分离株重症肺炎的分子分型、耐药表型、毒力基因携带情况(例)
Distribution of molecular characterization,drug-resistant phenotype,Superantigens genes and exfoliative toxin genes of Staphylococcus areus isolates in children with severe pneumonia(case)
| 重症肺炎 | 例数 | 分子分型 | 耐药表型 | 肠毒素基因型 | 其他毒力基因pvl;can;fnbB(1) |
|---|---|---|---|---|---|
| MSSA | 11 | ST15-t084(1) | ERY-CLI-PEN(1) | 0(1) | fnbB(1) |
| ST5-t002(1) | ERY-CLI-GEN-PEN(1) | sec-sed-sem-sen-seg-sej-sei-ser-seu(1) | cna(1) | ||
| aST1-t127(1) | ERY-CLI-PEN(1) | etd-sem-seo(1) | cna(1) | ||
| aST398-t571(1) | - | seb(1) | cna-fnbB(1) | ||
| aST22-t309(1) | ERY-CLI-PEN(1) | 0(1) | pvl-cna(1) | ||
| bST188-t189(1) | ERY-CLI-PEN(1) | sem-seo-sen-seg-sei(1) | cna(1) | ||
| cST59-t437(1) | ERY-CLI-CHL(1) | seb(1) | pvl(1) | ||
| a&ST25-t660(1) | ERY-CLI-PEN(1) | 0(1) | fnbB(1) | ||
| ST25-t078(1) | ERY-CLI-PEN(1) | etd-seb-sem-sen-seg(1) | pvl-fnbB(1) | ||
| ST944-t616(1) | ERY-CLI-PEN(1) | seh-sem-sen-seg(1) | cna(1) | ||
| dST25-t07(1) | ERY-CLI-PEN(1) | Sei(1) | fnbB(1) | ||
| MRSA | 9 | aST59-t437(5) | ERY-CLI-PEN(3) | sea-seb-seq(3) | pvl (1) |
| CLI-PEN(1) | 0(1) | ||||
| ERY-CLI-CHL-PEN(1) | sea-seq(1) | ||||
| ST59-t437(3) | ERY-CLI-PEN(1) | sea-sek-seb-seq(1) | pvl (3) | ||
| sek-sep(1) | |||||
| sek-sem-seo-seq-sei(1) | |||||
| T22-t309(1) | ERY-CLI-PEN(1) | seb-sen-seg(1) | pvl(1) |
注:MSSA:甲氧西林敏感金黄色葡萄球菌;MRSA:耐甲氧西林金黄色葡萄球菌;a先天性疾病;b脑死亡;c肺坏死肺脓肿;d噬血综合征 MSSA:Methicillin-susceptible Staphylococcus aureus;MRSA:Methicillin-resistant Staphylococcus aureus;acongenital diseases;bcognitive death;cnecrotic pneumonia lung abscess;dhemophagocytic syndrome
42株金葡菌MLST共发现12种ST分型。MRSA有4种ST分型,以ST59最多见(71.4%,15/21株)。MSSA有8种分型,无明显优势克隆,排在首位的为ST25,仅占23.8%(5/21株),其次为ST398、ST22、ST5、ST188、ST1(各占9.5%,2/21株)。有2种ST型在MRSA、MRSA中均出现,分别为ST59、ST22。
全部菌株共有16种spa分型。MRSA有5种spa型,以t437为主(66.6%,14/21株),其次为t309(9.5%,2/21株);MSSA明显与MRSA不同,分型分散,共有14种分型,排在首位的为t078(14.2%,3/21株),其次为t002、t189、t127、t571、t309均为9.5%(2/21株)。在21株MRSA分离株的SCCmec分型中,Ⅳa最常见,占71.4%(15/21株),主要ST分型为ST59(71.4%,15/21株),ST59-SCCmecⅣa-t437为主要分型。
不同ST分型分离株超抗原基因谱各有特点(表4)。16株ST59型金葡菌中有7株为sek-seq和sea-sek-seq,ST22和ST25有5株为sem-sen-seg,占2种型别的55.5%(5/9株)。
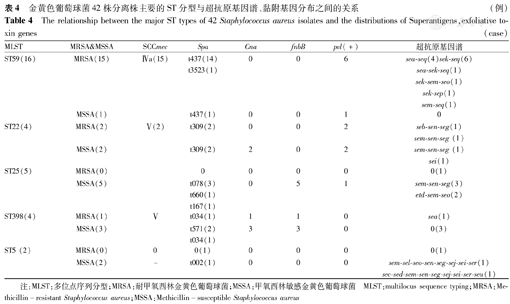
金黄色葡萄球菌42株分离株主要的ST分型与超抗原基因谱、黏附基因分布之间的关系(例)
The relationship between the major ST types of 42 Staphylococcus aureus isolates and the distributions of Superantigens,exfoliative to-xin genes(case)
金黄色葡萄球菌42株分离株主要的ST分型与超抗原基因谱、黏附基因分布之间的关系(例)
The relationship between the major ST types of 42 Staphylococcus aureus isolates and the distributions of Superantigens,exfoliative to-xin genes(case)
| MLST | MRSA&MSSA | SCCmec | Spa | Cna | fnbB | pvl(+) | 超抗原基因谱 |
|---|---|---|---|---|---|---|---|
| ST59(16) | MRSA(15) | Ⅳa(15) | t437(14) | 0 | 0 | 6 | sea-seq(4)sek-seq(6) |
| t3523(1) | sea-sek-seq(1) | ||||||
| sek-sem-seo(1) | |||||||
| sek-sep(1) | |||||||
| sem-seq(1) | |||||||
| MSSA(1) | t437(1) | 0 | 0 | 1 | 0 | ||
| ST22(4) | MRSA(2) | Ⅴ(2) | t309(2) | 0 | 0 | 2 | seb-sen-seg(1) |
| sem-sen-seg (1) | |||||||
| MSSA(2) | t309(2) | 2 | 0 | 2 | sem-sen-seg (1) | ||
| sei(1) | |||||||
| ST25(5) | MRSA(0) | 0 | 0 | 0 | 0 | 0(1) | |
| MSSA(5) | t078(3) | 0 | 5 | 1 | sem-sen-seg(3) | ||
| t660(1) | etd-sem-seo(2) | ||||||
| t167(1) | |||||||
| ST398(4) | MRSA(1) | Ⅴ | t034(1) | 1 | 1 | 0 | sea(1) |
| MSSA(3) | t571(2) | 3 | 3 | 0 | 0(3) | ||
| t034(1) | |||||||
| ST5 (2) | MRSA(0) | 0 | 0(1) | 0 | 0 | 0 | 0(1) |
| MSSA(2) | - | t002(1) | 0 | 0 | 0 | sem-sel-seo-sen-seg-sej-sei-ser(1) | |
| sec-sed-sem-sen-seg-sej-sei-ser-seu(1) |
注:MLST:多位点序列分型;MRSA:耐甲氧西林金黄色葡萄球菌;MSSA:甲氧西林敏感金黄色葡萄球菌 MLST:multilocus sequence typing;MRSA:Methicillin-resistant Staphylococcus aureus;MSSA:Methicillin-susceptible Staphylococcus aureus
本研究共收集42例临床确诊的金葡菌肺炎患儿,中位年龄2月龄,较国外报道年龄小。美国德克萨斯州儿童医院获得性耐甲氧西林金葡菌(community-acquired methicillin-resistant Staphylococcus aureus,CA-MRSA)肺炎患儿中位数年龄为0.9岁[9]。Doudoulakakis等[10]报道希腊金葡菌肺炎患儿的中位数年龄为4.3个月。因此,提示儿童金葡菌肺炎患者的主要人群是婴儿,原因可能与婴儿气管及支气管管腔狭小、黏液分泌不足、纤毛运动差有关;同时,婴幼儿皮肤黏膜屏障作用弱,非特异性免疫功能较差,细胞及体液免疫等特异性免疫反应尚未建立,易感染致病。同时,上述数据提示我国金葡菌肺炎患儿月龄偏小,需要引起临床重视。
本研究发现金葡菌体外药敏试验多重耐药率高达90.4%,主要耐药表型是青霉素-红霉素-克林霉素。克林霉素耐药率高达83.3%,高于上海金葡菌肺炎的分离株耐药率(69.2%)[11]。动物实验证明,辅助应用克林霉素在控制金葡菌感染中起积极作用[12],也有学者报道应用克林霉素联合其他药物治疗pvl阳性的金葡菌感染的坏死性肺炎有效,应用克林霉素联合用药治疗不仅是杀灭病原体,还可减少金葡菌毒素的产生[13]。我国由于克林霉素的高耐药率,鲜有应用克林霉素联合其他药物治疗严重的金葡菌感染的报道,其阻断金葡菌毒素作用有效性还需要更深入的研究。
以往报道提示,世界各地不同区域CA-MRSA肺炎的致病株优势克隆有所不同,美国ST8(USA300)是引起社区获得性坏死性肺炎的主要克隆[14];ST80则是引起希腊获得性肺炎的主要克隆[10]。Wang等[15]报道自2002年至2014年ST59-SCCmecVT-pvl(+)是中国台湾CA-MRSA分离株的主要分型。本研究发现,ST59-SCCmecⅣ-t437为儿童MRSA肺炎中分离株的主要分型,其中Ⅳa最常见。但2017年,Song等[11]报道上海两家儿童医院金葡菌肺炎的分离株ST59-SCCmecⅣ-t172为CA-MRSA主要分型,超过ST59-SCCmecⅣ-t437。
MRSA中另一个值得关注的ST是ST398,其最早在法国发现,常与牲畜和从事与牲畜相关工作的人群有关。ST398-MRSA曾在荷兰、欧洲的其他地方流行[16]均有报道,最常引起皮肤感染,也可引发菌血症、肺炎、心内膜炎等侵袭性感染。李士朋等[17]从1例坏死性肺炎女婴的痰液中,分离出了ST398MRSA-SCCmecⅤ-t034。本研究仅分离到4株ST398,均为新生儿。Uhlemann等[18]报道ST398-t034主要来源于牲畜,尤其是猪,但本研究分离到的菌株,患儿没有与牲畜接触的经历,ST398在人与牲畜之间的传播途径及流行病学变化需要引起国内研究者的注意。
SAgs位于可移动遗传原件(mobile genetic elements,MGES)上,其编码的多种毒素能够激活宿主的免疫功能,诱发高热,增强宿主对毒素杀伤效应的敏感性,并诱导T淋巴细胞增殖。各国金葡菌侵袭性感染SAgs的携带率不同,本研究发现大部分(90.4%)呼吸道分离的金葡菌菌株携带至少1个SAgs,本研究分离出的金葡菌主要来自呼吸道,主要的超抗原基因谱型为sek-seq。该结果与国外有明显不同[19]。He等[20]对菌血症患者中分离的金葡菌研究中发现,seb、seg最常见。研究认为tsst-1与中毒性休克综合征高度相关,see则与食物中毒有关[21],本研究中未发现有菌株携带tst-1、see,可能与本研究菌株分离自肺炎患者有关。超抗原基因在轻症肺炎与严重肺炎之间差异并无统计学意义。Nhan等[22]针对金葡菌毒力基因与临床关系研究中,未发现感染的严重程度与毒力基因之间有显著相关性。本研究结果与之一致。
既往认为pvl是一种可以导致严重坏死性疾病的毒素,但近年研究显示pvl的致病力颇具争议性。有报道pvl阳性的金葡菌与原发皮肤感染和严重的坏死性肺炎有关[23]。但在小鼠金葡菌感染模型中pvl阳性的CAMRSA与肺炎类型和严重程度无关[24]。本课题组前期研究显示87.5%pvl阳性菌株,临床病例并未出现坏死性病变,未发现pvl基因与坏死性肺炎之间的相关性[17],与本研究结果一致。美国一项针对儿童金葡菌肺炎的研究显示,大部分的MRSA(96%)和MSSA(92%)菌株均携带pvl基因[9],日本的来自血流样本的MRSA分离株仅1.3%携带pvl基因[25]。针对欧洲儿童金葡菌感染一项多中心研究提示pvl基因与更严重的感染相关[24],本研究发现重症肺炎中pvl基因携带率高于普通肺炎,提示pvl作为MRSA的主要毒力基因,虽然不一定引起坏死性改变,但可能与肺炎严重程度相关,与欧洲的结果一致[26]。
fnbB、cna基因分别编码FnbBPs蛋白和CNA蛋白,这2种蛋白均属于黏附素,在细菌致病过程中具有重要作用。本课题组前期研究发现,肺炎分离株的fnbB基因的携带率(27.4%),明显高于皮肤软组织感染分离株(12.7%),提示fnbB基因可能与感染肺炎有关[27]。本研究肺炎分离株fnbB基因的携带率与前期研究基本一致,且cna、fnbB基因在MSSA中的携带率高于MRSA。值得注意的是cna、fnbB基因可能与儿童MSSA引起的重症肺炎高度相关,在重症肺炎分离株中,MSSA的cna、fnbB基因的携带率均为45.4%,而MRSA中未发现cna、fnbB基因。
综上所述,当前我国儿童金葡菌肺炎主要发生于小婴儿,MRSA的检出率高,主要为ST59-SCCmecⅣ-t437克隆。致病菌株的多重耐药情况严重。超抗原基因在金葡菌肺炎中的携带率高,pvl在MRSA中携带率高,而MSSA携带fnbB、cna更为常见。
所有作者均声明不存在利益冲突



























