
慢性胰腺炎致脾动脉瘤形成是一种罕见而凶险的疾病。浙江大学医学院附属邵逸夫医院收治了1例首发症状为消化道出血的青年男性患者,通过内镜和影像学检查诊断为脾动脉瘤破入胰管致消化道出血。慢性胰腺炎可致脾动脉瘤破裂出血、区域性门静脉高压和胃底静脉曲张,综合实验室检查、内镜和影像学检查,尽早诊断、及时治疗,有助于改善患者预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
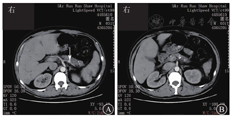
患者男,31岁,因"呕血伴黑便1个月余"于2017年11月24日入院。患者1个月余前劳累后出现恶心,后呕吐鲜血1次,量约50 mL,未就诊。数天后患者解成形黑便3次,每次量约100 g,伴头晕乏力,无黑矇晕厥。至浙江大学医学院附属邵逸夫医院急诊,查血常规示红细胞计数为2.35×1012/L,血红蛋白为34 g/L,平均红细胞体积为54.3 fL,平均血红蛋白水平263 g/L;血液生物化学检测示ALT为18 U/L,AST为14 U/L,ALP为91 U/L,GGT为63 U/L,TBil为19.6 mmol/L,DBil为8.2 mmol/L,LDH为265 U/L,淀粉酶为95 U/L,脂肪酶为82.22 U/L,胆碱脂酶为3 881 U/L,超敏CRP为0.6 mg/L。全腹增强CT检查示肝多发等低密度团片影,门静脉分支周围和胆囊稍水肿,脾部分陈旧梗死可能,脾静脉纤细并胃周侧支,脾动脉瘤(图1A),慢性胰腺炎(图1B),肝肾小囊肿,胃体后壁憩室。患者自述既往体格健康,有间断上腹隐痛,自认为"胃炎"未予诊治,平时未行健康体检。体格检查:体温为37.0 ℃,脉搏为96次/min,呼吸频率为19次/min,血压为129/72 mmHg(1 mmHg=0.133 kPa)。神志清楚,精神可,贫血貌,腹软,无压痛和反跳痛,肝脾肋下未及,肠鸣音6次/min,墨菲征阴性,移动性浊音阴性。

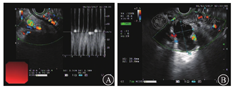
入院后予输注悬浮红细胞、抑酸护胃、补铁等治疗,患者未再出现呕血、黑便,大便隐血试验阴性。胃镜检查示十二指肠乳头处活动性渗血(图2)。腹部增强MRI检查示:①轻度肝硬化,轻度脂肪肝,动脉期肝脏异常强化灶,考虑异常灌注,左肝小囊肿。②脾大,脾部分梗死考虑,脾静脉显示不清,胃前方侧支形成;脾静脉与肠系膜上静脉汇合处血栓形成可能;脾动脉瘤。③考虑慢性胰腺炎。④胆囊底壁稍厚,胆囊腺肌症可能;右肾小囊肿。遂在介入科行脾动脉瘤栓塞术。术中见脾动脉局部囊袋样凸起,直径约8 mm,未见明显造影剂外溢,使用可控弹簧钢圈和栓塞胶进行栓塞(图3)。术后造影检查显示脾动脉主干及其远端分支显影良好,脾动脉瘤未见确切显示。患者术后多次复查血常规,血红蛋白水平维持在90 g/L以上。后复查胃镜示十二指肠乳头仍有活动性出血。遂行超声胃镜检查,内镜下见胃底、胃体上段多条曲张静脉,部分成团、成球样改变(图4A);十二指肠乳头结构无特殊,其开口可见墨绿色胆汁溢出;超声胃镜检查见胰腺实质回声不均匀,散在较密集点片状高回声区,呈云朵样;胰管显示,管壁回声增粗、增强;胆总管显示,胰头段胆管壁增厚;胰腺尾部见一3.0 cm×1.9 cm无回声区(图4B),部分囊壁呈片状增厚;脾脏显示增厚。诊断:慢性胰腺炎;胰尾部囊性病变,性质待定;重度胃底静脉曲张。对症支持治疗后患者未再解黑便,复查血红蛋白水平稳定,患者拒绝进一步检查,要求出院随访。
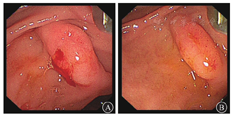

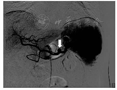


2018年2月11日,患者因"再发黑便1周"再次入住浙江大学医学院附属邵逸夫医院消化内科。查血常规示红细胞计数为1.84×1012/L,血红蛋白为34 g/L,平均红细胞体积为65.9 fL,平均血红蛋白水平为279 g/L。胃镜检查示十二指肠乳头搏动性出血,中重度胃底静脉曲张。胃镜下乳头冲洗后间断可见黄绿色胆汁流出,考虑胰管来源出血可能性大。急诊腹部增强CT检查示脾动脉瘤复发,行急诊脾动脉造影术和脾动脉栓塞术,脾动脉局部可见造影剂外溢,考虑活动性出血(图5);超选栓塞后造影见破裂口处闭塞,远端脾动脉通过侧支部分代偿,术中证实为脾动脉瘤破裂入胰管引起消化道出血。病情稳定后出院,随访5个月患者未再发呕血、黑便,复查血红蛋白水平在正常参考值范围内,大便隐血阴性。
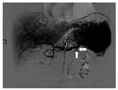

脾动脉瘤破裂引发消化道出血是一类罕见且凶险的疾病,具有隐匿性。本课题组回顾国内外近20年来关于脾动脉瘤破裂导致消化道出血的65篇文献,共计70例患者,男55例(78.6%),女15例(21.4%),年龄为(52.43±14.91)岁,主要的症状为黑便、呕血、腹痛和血便。因起病缓急、症状程度不同,患者从出现症状到最终确诊的时间不等,其中位时间(范围)为60 d(0.5 d~4年)。这些患者的脾动脉瘤瘤体最大径为(4.41±2.56) cm,其中大部分(58.6%,41/70)为假性动脉瘤,27.1%(19/70)为真性动脉瘤,其余患者未获取病理标本,从影像学难以判断性质。假性动脉瘤的成因有很多,以慢性胰腺炎(41.5%,17/41)和急性胰腺炎(19.5%,8/41)常见,其他如术后改变(9.8%,4/41)、肿瘤(9.8%,4/41)、消化性溃疡(2.4%,1/41)、腹膜炎(2.4%,1/41)、外伤(2.4%,1/41)、结核(2.4%,1/41)、不明原因(9.8%,4/41)。脾动脉瘤破入消化道的部位包括胰管(38.6%,27/70)、胃(28.6%,20/70)、结肠(12.9%,9/70)、手术切口(4.3%,3/70)、十二指肠(2.9%,2/70),12.9%(9/70),最终破入位置不明。在治疗和预后方面,45.7%(32/70)的患者选择了手术治疗,范围大多包含动脉瘤体、胰体尾和脾脏切除,预后均良好;37.1%(26/70)的患者进行了介入治疗,其中有4例患者因术后再出血再次行手术治疗,1例患者栓塞失败,1例患者出现严重的术后感染。所有经过治疗的患者最终预后均较好。有2例患者在明确病因前即死亡,最终通过尸体解剖明确动脉瘤破裂诊断。1例患者明确病因后放弃治疗自愿出院,预后不详。
本例患者为青年男性,因呕血、黑便的消化道出血表现就医。病史示呕血、黑便量不大,且入院后粪便隐血迅速转阴,通过单次消化道出血难以解释血红蛋白水平大幅度下降和小细胞低色素的贫血类型,考虑患者在本次起病前可能存在长期慢性消化道出血。入院后胃镜检查提示十二指肠乳头出血,根据解剖结构,出血可能来自十二指肠乳头本身、胆道系统或胰管。十二指肠乳头疾病中最常引起出血的是乳头肿瘤性病变,本例患者超声胃镜未见明显的十二指肠乳头部损伤或结构异常。而胆道系统出血大多伴有剧烈腹痛或肝功能异常等表现。根据患者的症状、体征,以及慢性胰腺炎、脾梗死、脾动脉瘤的影像学表现,乳头搏动性出血期间可间断见黄绿色胆汁流出等内镜下表现,考虑出血源自胰管。患者超声胃镜可见慢性胰腺炎征象,重度胃底静脉曲张,十二指肠乳头结构正常。根据国内外指南,本例患者在CT、MRI和超声内镜多种检查中表现出慢性胰腺炎的典型影像学特征,符合慢性胰腺炎诊断标准[1,2,3]。因此,诊断为慢性胰腺炎导致脾动脉瘤,破入胰管后引发消化道出血。患者先后两次接受脾动脉瘤栓塞术,且在第2次术中造影过程中发现脾动脉局部活动性出血引起的造影剂外溢,证实了其出血原因。经过介入栓塞治疗后,患者未再出现消化道出血征象,贫血逐渐好转,病情得到了有效控制。但反复追问病史,患者无反复发作胰腺炎的明确病史,否认饮酒和长期服药,具体胰腺炎病因仍待进一步随访。
慢性胰腺炎患者中10%~20%会出现周围血管的真性或假性动脉瘤,其中假性动脉瘤多见[4,5]。慢性胰腺炎所致血管瘤最常累及的血管是脾动脉,其次是肝动脉和胃十二指肠动脉。脾动脉瘤破裂出血发生率为4%~30%[6,7],一旦发生破裂则预后较差,死亡率可达50%[8],且根据破裂后的出血位置不同,死亡率也有所不同。破入胰管可造成呕血、血便、黑便等消化道出血症状,更易引起患者重视,常能较早得到诊治;而破入腹腔、后腹膜或假性囊肿时,患者症状可能较轻或不典型,从而错失治疗的最佳时机,常于出现血流动力学紊乱时方至医院就诊,死亡率可升高至90%[4,9]。在发生破裂出血前,通常可采用介入栓塞、血管内支架、手术套扎、脾切除、远端胰腺切除等方式进行治疗。介入治疗相对外科手术而言更为微创、便捷,是首选的治疗方式,但是再出血率较手术更高[4,6]。由于病灶特征、医疗条件、术者技术水平等因素差异较大,治疗后动脉瘤的再出血率尚无定论。
慢性胰腺炎常引起脾静脉和周围组织病变,出现脾静脉远端栓塞或血流动力学改变,回流受阻。原本通过脾静脉回流至门静脉的血流会改道周围的胃网膜左静脉、胃短静脉等侧支静脉,这些侧支静脉压力增高后可引发胃底静脉曲张和局限于左侧门静脉系统的区域性门静脉高压。15%~35%的区域性门静脉高压患者会出现继发的胃底静脉曲张,大多不累及食管。这样的曲张静脉大多在胃底黏膜下层广泛存在,少部分有成团隆起,一般无明显红色征或黏膜糜烂[10],因此在普通胃镜的白光视野下易被漏诊。对于疑诊的患者,使用多普勒超声内镜进行观察能够有效提高检出率。文献报道区域性门静脉高压所致静脉曲张出血率为15%~50%[11,12,13]。在出血前,可使用内镜下套扎、硬化剂治疗或外科脾切除+断流术等方法进行预防性治疗。区域性门静脉高压一般对肝功能无明显影响[10,14]。本例患者影像学检查提示肝脏异常强化病灶,考虑为区域性门静脉高压导致肝脏内血流时相紊乱。患者肝功能无明显异常,符合疾病特点。
总体而言,本例患者慢性胰腺炎原因仍不明确,症状不典型,也可能被患者平素自认为偶有胃部不适的表现而掩盖。经过栓塞治疗,目前未见明显的消化道出血。但胰腺原发病因尚未解除,反复的胰腺炎症仍可引发原有脾动脉瘤出血或周围其他腹腔血管形成新动脉瘤,介入栓塞治疗后,也存在一定的再出血风险。该患者目前已存在重度胃底静脉曲张,同样有消化道出血风险,且随着区域性门静脉高压的累及范围增大,程度加重,不排除出现肝功能异常的可能,故仍需密切定期随访。
所有作者均声明不存在利益冲突



























