
卡塔格内综合征是临床罕见疾病,其经典三联征为内脏转位、支气管扩张和慢性鼻窦炎。本文报道1例卡塔格内综合征患者在全身麻醉下行鼻窦手术,因术后拔管困难,转入重症监护病房治疗,14 d后治疗好转出院。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,47岁,因反复鼻塞、流涕10年,加重2个月入院。患者10年前无明显诱因出现双侧鼻腔堵塞,无交替性,伴流脓涕,伴嗅觉减退,无头痛头晕,无面部麻木等。2个月前自感上述症状加重,伴咳嗽咳痰,于外院检查并诊断为卡塔格内综合征(KS)(图1A,图1B)。患者既往有"支气管扩张、慢性阻塞性肺疾病"病史多年,长期使用噻托溴铵、家庭氧疗(包括无创呼吸机)等治疗。否认家族遗传病史,祖父母为近亲结婚。查体:生命体征平稳,双肺呼吸音稍粗,可闻及少量干湿啰音,心尖搏动位于右锁骨中线第5肋间,在胸部右侧可闻及心音。实验室检查无明显异常。心电图示右位心,窦性心律,多发室早。胸片显示双侧支气管扩张合并感染可能性大(图1C)。肺功能检查:极重度阻塞性肺通气功能障碍,中重度限制性肺通气功能障碍。鼻内镜检查:双侧中鼻道可见息肉样新生物,并可见脓性分泌物。暂予以地塞米松静滴、倍氯米松雾化、头孢孟多抗感染治疗,6 d后全麻下行鼻内镜下鼻窦开放+鼻息肉切除术。麻醉医师术前访视,患者体重55 kg,心功能Ⅲ级,咳嗽较前好转,双肺未闻及明显湿啰音,判断肺部病情稳定。
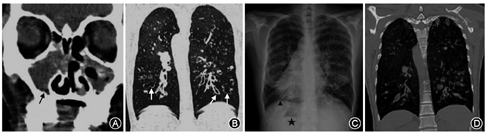

患者入手术室后生命体征平稳,血氧饱和度(SpO2)93%,血气分析:动脉血二氧化碳分压(PaCO2)42.0 mmHg(1 mmHg=0.133 kPa),动脉血氧分压(PaO2)61.8 mmHg,K+3.3 mmol/L。予以静脉补钾1 g,并静脉注射0.5 mg戊乙奎醚。麻醉诱导:咪达唑仑2 mg,舒芬太尼10 μg,丙泊酚80 mg,顺式阿曲库铵10 mg,瑞芬太尼75 μg。插管后采用压力控制模式控制呼吸,气道峰压(PEAK)25 cmH2O(1 cmH2O=0.098 kPa),潮气量(Vt)230 ml。听诊哮鸣音,予以沙丁胺醇4揿,呼吸道阻力下降。改呼吸参数为PEAK 30 cmH2O,呼气末正压(PEEP)6 cmH2O,Vt 330~360 ml,呼吸频率(f)14次/min,吸呼比1/2,氧浓度(FiO2)60%。血气分析:PaCO2 49.7 mmHg,PaO2 120 mmHg。术中以2%七氟醚吸入,辅助少剂量丙泊酚、瑞芬太尼持续泵入维持麻醉。半小时后,呼吸末二氧化碳分压(PETCO2)突然上升至75 mmHg,潮气量骤降,心率、血压有上升趋势,双肺痰鸣音明显。FiO2改为100%,并予以吸痰,可吸出中量淡黄色黏液痰,喷入沙丁胺醇。视潮气量情况调整压力参数,保证呼吸平台压<30 cmH2O(PEAK 31~35 cmH2O),PETCO2波动在58 mmHg上下,心率约100次/min,血压约110/80 mmHg。期间血气分析:PaCO2 60 mmHg,PaO2 300 mmHg。手术结束,支气管镜下可见大量黄色脓痰,并予以肾上腺素盐水盥洗。待患者自主呼吸恢复,Vt约320 ml,f 15次/min,血气分析(FiO2 30%):PaCO2 65.4 mmHg,PaO2 89 mmHg。带气管导管转入ICU,查体:心率120次/min,血压98/56 mmHg,f 33次/min,双肺呼吸音粗,可闻及大量痰鸣音及湿啰音。血气分析(FiO2 60%):PaCO2 98.2 mmHg,PaO2 154 mmHg;血常规:白细胞19.02×109/L,中性粒细胞百分比94.1%。予以哌拉西林舒巴坦抗感染、呼吸机辅助呼吸、化痰、镇静、镇痛等治疗。并行支气管镜检查:右下叶、左上叶、左下叶可见大量白色脓性分泌物,抽吸不尽。术后2 d,患者体温38.3 ℃,白细胞值明显增高,胸部CT示双侧支气管扩张合并感染(图1D),血气分析提示患者顽固性低钾,并诱发频发室性早搏。继续予以抗感染、化痰、补钾、支气管镜检查、体位引流等治疗,鼓励患者主动咳痰。痰培养示:铜绿假单胞菌。术后4 d,患者气道内痰液仍多,但神志清,肌力可,咳嗽锻炼可。为避免导管源性感染,予以拔管、无创辅助通气、间断端坐位等处理。3 d后,患者在家庭呼吸机辅助下生命体征平稳,予以转回专科病房治疗。
KS是一种罕见的常染色体隐性遗传性疾病,主要表现为支气管扩张、内脏逆位、慢性鼻窦炎[1]。具备前两项为不完全性,3项均具备则为完全性。国内鲜有统计报道,而国外认为其发病率为1∶20 000~1∶80 000,并有家庭遗传倾向[2,3],还可能伴有不孕不育及其他畸形。鼻窦的手术治疗和局部用药能改善其生活质量[4]。
该例患者为完全性KS女性,术前感染指标不高,且改善了气道环境,全麻术后却因肺部问题而拔管困难,出现术后肺部感染。该患者有多年支气管扩张病史,且纤毛协调运动受阻,术前检验结果未提示活动性炎症,行抗感染、平喘化痰等治疗,但术中仍有大量痰液,可能是呼吸道底部堆积的痰液,在体外改变时回流所致。术前若完善胸部CT确定肺部情况,可再加强气道准备,如体位引流、叩击排痰、呼吸功能锻炼等。患者入院时稍咳痰,长期的支气管扩张易导致细菌定植,应完善痰培养,根据结果调整术前抗生素的应用。经上述治疗后,与术前1 d复查影像学检查,评价治疗情况。该患者影像学提示双下肺支气管扩张较明显,术中可稍头高脚低位,保证上肺的有效通气。顺式阿曲库铵为苄异喹啉类肌松药,在大剂量快速注射时,较甾类(如维库溴铵、罗库溴铵等)易引起明显的组胺释放,导致支气管平滑肌收缩、气道腺体高分泌等。针对该患者,诱导时可使用罗库溴铵,减少药物对气道的刺激,术后还可及时用舒更葡糖拮抗肌松作用,尽可能早期脱离控制呼吸。另该手术对肌松要求不高,术中可不追加肌松药。为应对慢性阻塞性肺疾病的气道狭窄、高阻力的问题,应选用小潮气量的保护性通气配合一定的PEEP,并运用较高浓度的吸入麻醉剂,患者术中的血气分析提示该策略可行。患者有支气管扩张病史多年,且使用呼吸机治疗,处于长期间断性低氧状态,阿片类受体上调,对阿片类药物敏感度上升。术中在保证足够的镇痛和麻醉深度情况下(减少气道应激),尽可能减少长效阿片类药物使用,因为可能会使患者术后嗜睡、咳嗽减弱、甚至呼吸抑制,将导致低氧血症、肺不张等不良反应[5,6]。KS患者术后肺炎发生率极高,应尽量缩短手术时间和机械通气时间[6]。行气道盥洗时,使用肾上腺素盐水不但有利于舒张支气管、收缩血管,还利于充分回收盥洗液和吸收肺泡内残留液体。术后需加强气道护理、排痰引流,每日需行支气管镜清除痰液[7],积极抗感染治疗,并动态观察体温、肺部情况、感染指标的变化而调整用药。早期开始肺功能锻炼,鼓励患者咳嗽。KS患者合并呼吸衰竭,在治疗过程中容易出现电解质失衡,应及时纠正,防止恶性心律失常的发生。
所有作者均声明不存在利益冲突



























