
探讨炎症性肠病(IBD)患者小肠上皮细胞中维生素D受体(VDR)的表达水平与自噬流受损之间的相关性。
回顾性收集41例IBD患者和13例正常对照者的小肠黏膜组织,分别设为IBD组和正常对照组。采用免疫组化检测两组小肠上皮细胞自噬流相关标志物(LC3、p62)和VDR蛋白的表达。统计分析VDR和LC3以及p62的相关性。
与正常对照组相比,IBD患者小肠上皮细胞中VDR表达显著下降,而LC3和p62的表达增加(均P<0.0001),提示自噬流受损。VDR的表达与LC3(r=-0.59,P<0.01)和p62(r=-0.62,P<0.01)的表达呈负相关。
IBD患者中VDR表达量的减少可能与自噬流受损有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)患者中存在维生素D缺乏的状况,而维生素D受体(vitamin D receptor,VDR)缺乏与IBD的发病相关[1]。VDR是一种细胞核转录因子,可与配体1,25-二羟基维生素D3[1,25-(OH)2D3]特异性结合调控维生素D的功能[2]。自噬是一种进化上保守的分解代谢机制,通过细胞分解代谢产物、细胞器的降解和再循环维持细胞内稳态[3]。自噬流受损的特征在于LC3和p62(自噬的选择性底物)的积聚。研究报告显示:VDR缺失与体内外自噬调节基因ATG16L水平相关[4]。本研究采用免疫组化的方法探讨IBD患者小肠上皮中VDR的表达与自噬流相关蛋白LC3和p62的关系,并为使用VDR配体1,25-(OH)2D3干预IBD提供理论支持。
回顾性分析2013年1月至2018年12月常州市第一人民医院消化内科确诊的41例IBD患者,设为IBD组。IBD患者纳入标准:临床症状及相应检查结果均符合IBD诊断标准;排除标准:合并严重器质性疾病、肿瘤、精神疾病、意识障碍的患者。IBD诊断标准:IBD的诊断基于传统的临床、内镜特征及病理学诊断标准,并最终通过回肠或者结肠活检的组织学检查得到证实[6]。同期招募正常对照者13例,设为正常对照组,纳入标准:肠道标本来源于因腹泻行肠镜检查,最终考虑功能性腹泻的受试者。本研究获得常州市第一人民医院伦理委员会的批准(批准号:2018科第002号)。
内镜下采用活检钳夹取少量怀疑病变的回肠或结肠组织。
收集患者的一般情况,包括年龄、性别、文化程度、病程、用药情况等。
标本采用4%甲醛固定,石蜡包埋,切片机作3 μm切片。为修复抗原,这些切片再水合,并且使用加热的柠檬酸盐回收抗原,最后进行免疫组织化学染色。一抗:兔抗人VDR(浓度1∶200)、兔抗人LC3(浓度1∶200)和兔抗人p62(浓度1∶200)均购自美国Abcam公司。使用辣根-过氧化物酶耦联的二抗(Vectastain elite ABC试剂盒,美国Vector Labs公司)进行可视化染色,3种蛋白阳性染色均为棕褐色颗粒。每种蛋白至少重复3次实验,并选取× 200代表性图像进行分析,采用Image Pro Plus软件测量目的蛋白积分光密度(IOD)。
使用Graphpad Prism V6.0统计软件,年龄、蛋白质表达等计量资料为正态分布且方差齐性,以(Mean ±SD)表示,组间比较行Student′st检验;性别等计数资料以百分数表示,组间比较行卡方检验。VDR与LC3、p62的相关性行Spearman相关性分析。以P<0.05为差异具有统计学意义。
IBD组41例,男26例,女15例;平均年龄(41.6 ± 8.5)岁;平均病程(43.6 ± 13.7)个月。药物治疗情况:5-氨基水杨酸盐治疗33例(80.4%),糖皮质激素治疗5例,营养治疗1例,余2例未接受药物治疗。正常对照组男8例,女5例;平均年龄(45.2 ± 11.7)岁。两组在性别和年龄上差异均无统计学意义(P<0.05),具有可比性。
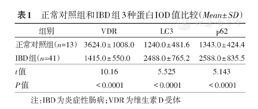
正常对照组和IBD组3种蛋白IOD值比较(Mean± SD)
正常对照组和IBD组3种蛋白IOD值比较(Mean± SD)
| 组别 | VDR | LC3 | p62 |
|---|---|---|---|
| 正常对照组(n=13) | 3624.0 ± 1008.0 | 1240.0 ± 481.6 | 1343.0 ± 424.4 |
| IBD组(n=41) | 1415.0 ± 550.0 | 2488.0 ± 765.2 | 2588.0 ± 835.5 |
| t值 | 10.16 | 5.525 | 5.143 |
| P值 | <0.0001 | <0.0001 | <0.0001 |
注:IBD为炎症性肠病;VDR为维生素D受体
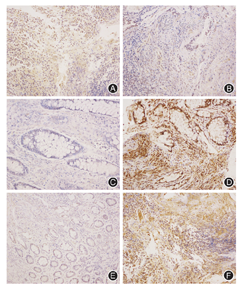

正常人群小肠组织中VDR阳性染色主要表达在细胞核,IBD组VDR表达较正常对照组明显减少,差异具有统计学意义(P<0.0001)。
在正常人群小肠组织中,LC3和p62的阳性染色很少,但IBD患者小肠上皮腺体柱状细胞中LC3和p62大量积聚;定量分析发现:IBD组LC3和p62的表达量均明显高于正常对照组(均P<0.0001),提示自噬流受损。
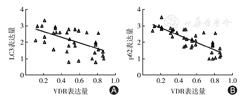

Spearman相关分析表明,IBD组VDR表达与LC3(r=-0.59,P<0.01)和p62(r=-0.62,P<0.01)的表达呈负相关。
IBD是一种胃肠道的慢性特发性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC),两者临床表现及治疗方案有较多相似之处。IBD的病因是机体对肠道内细菌抗原产生先天性和适应性免疫反应,导致肠黏膜通透性增强和肠道免疫失调[5]。
维生素D对IBD和结直肠癌免疫系统的调节作用越来越受到关注[6]。研究表明:超过60%的IBD患者维生素D缺乏[7]。根据生态学研究的结果,太阳光紫外线照射可降低IBD的风险[8]。因此,维生素D缺乏和IBD的发生密切相关。另外,IBD患者维生素D的缺乏与VDR基因的多态性有关,缺乏VDR基因的小鼠体内促炎性NF-κB通路可被激活[9]。与之前报道一致[4],本研究结果显示:与正常对照组比较,IBD患者的小肠上皮细胞VDR水平显著降低(P<0.0001)。这些发现表明:VDR在维持肠道内环境平衡中发挥至关重要的作用。然而,VDR在IBD中的确切分子机制尚不清楚。
自噬与IBD关系密切。自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程。自噬与机体的衰老、生长、神经变性、癌症和免疫有关。自噬相关基因如ATG16L1和IGRM的突变与IBD具有相关性。介导天然免疫的胞质蛋白NOD2可招募ATG16L1蛋白诱导自噬的发生[10]。若IBD患者树突状细胞含有NOD2或ATG16L1变异体,那么在自噬诱导、细菌处理和抗原呈递中存在缺陷[11]。这些自噬基因缺陷可导致肠道菌群的异常相互作用,从而引发过度的促炎症反应。
维生素D和自噬都与IBD的发病机制有关[12],作者进一步研究维生素D与自噬之间的关系。研究表明:VDR可以通过调控Beclin-1、BCL-2、mTOR、细胞内钙离子浓度和溶酶体成熟等环节,通过调节自噬体的起始、成核、成熟等多个过程促进自噬发生[13]。在肠炎动物模型中,VDR缺失导致自噬缺陷是肠炎加重的重要因素[4]。当自噬流被阻断时,LC3和p62的降解会减少,因此根据这两种蛋白质的变化来测量自噬流是一种经典的方法[14]。本研究发现:VDR表达与LC3(r=-0.59,P<0.01)和p62(r=-0.62,P<0.01)的表达呈负相关,说明IBD患者肠道细胞VDR的缺乏与自噬流受损有关。
综上所述,IBD患者中VDR表达量的减少可能与自噬流受损有关,推测肠上皮细胞VDR通过自噬流在肠道内环境平衡中起着调节作用。
所有作者均声明不存在利益冲突



























