
芳香化酶抑制剂(aromatase inhibitors,AIs)能特异性地致芳香化酶失活,阻断雄激素转变为雌激素的过程而减少内源性雌激素生成,目前在临床上广泛应用于雌激素敏感的乳腺癌的治疗。随着对其机制的深入研究,认为AIs可延缓骨骺闭合,促进身高增长,改善终身高,故近年来有临床研究将AIs应用于男性矮小患儿的治疗,特别是青春期启动以后,甚至是青春后期的患儿。现拟对AIs在矮身材青少年男童中使用的有效性和安全性进行综述,以期为临床工作提供一定的参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,重组人生长激素(recombinant human growth hormone,rhGH)被应用于矮身材及相关疾病的治疗[1,2],但对于青春中后期的矮身材患儿及因性早熟导致生长潜能明显受限的患儿来说,单独使用rhGH进行治疗的投入获益比值得商榷。有Meta分析表明,对于性早熟(precocious puberty,PP)的患儿单用促性腺激素释放激素类似物(gonadotropin releasing hormone analogs,GnRHa)使身高的获益不如在使用GnRHa基础上联合rhGH的获益[3],但GnRHa与rhGH两药联用会加重经济负担并带来某些心理问题。近年来,有研究指出,芳香化酶抑制剂(aromatase inhibitors,AIs)能改善青春期已经启动,甚至青春后期矮身材男性患儿的预测终身高或终身高,对这部分患儿可单独使用AIs或在rhGH应用的基础上联合使用AIs,在延缓骨龄愈合、改善成年身高的同时,使投入与获益比实现最大化。AIs相对于GnRHa和rhGH来说,价格低,其给药方式能减少患儿的痛苦和抵触情绪,方便快捷。但迄今为止,关于AIs对矮身材男童终身高影响的研究尚缺乏大样本、多中心、长期的临床研究证据,治疗效果和安全性尚存在一些争议,现综述近年来相关的临床研究,探讨AIs使用的有效性和长期用药的安全性等问题,旨在给临床工作提供一定的参考。
芳香化酶(aromatase,CYP19)为雄激素转化为雌激素的限速酶,可催化雄烯二酮、睾酮转化为雌激素,而雌激素对骨成熟、骨骺闭合及停止生长起关键作用。有临床个案报道,因CYP19缺乏或雌激素受体缺乏而造成雌激素抵抗的患儿有骨龄落后、无青春期生长加速、无骨骺生长板愈合、身高持续增长的表现,在给予雌激素治疗后,可出现生长停止及骨骺愈合的情况[4,5,6]。随着研究的深入,发现矮小症患者使用AIs可抑制雌激素的合成,延缓骨骺愈合,最终改善终身高。
AIs从问世至今经历了三代的演变[7],从第一代到第三代,给药频率在减少,不良反应在降低,安全性在提高。目前,临床上应用的大多数为第三代的AIs——阿那曲唑、来曲唑(表1)。有研究显示,经过1年的治疗,阿那曲唑对延缓骨骺闭合及增加预测成年身高(PAH)更有效,来曲唑对控制激素水平更有效[8]。随后,Mauras等[9]也提出了相似的观点。但上述研究随访时间短,后续结果尚未报道,第三代AIs在改善矮身材男性患儿终身高上有无差异仍需大量的长期随访数据来佐证。

芳香化酶抑制剂的分类及应用特点[7]
Classification and application characteristics of aromatase inhibitors[7]
| 非甾体化合物(可逆) | 甾体化合物(不可逆) | 剂量(非甾体/甾体) | 抑制率(%) | |
|---|---|---|---|---|
| 第一代 | 氨鲁米特 | 睾内脂 | 250 mg,4次/d | 90.6 |
| 10 mg/kg,4次/d | <90.0 | |||
| 第二代 | 法曲唑 | 福美坦 | 2 mg ,2次/d | 92.6 |
| 125 mg,2次/d | 91.9 | |||
| 第三代 | 阿那曲唑 | 1 mg,1次/d | 97.3 | |
| 来曲唑 | 2.5 mg,1次/d | >99.1 | ||
| 特点 | 与血红素的细胞色素P450酶可逆性结合 | 依西美坦与芳香化酶不可逆结合 | NA | NA |
注:NA:未检测
NA:not available
目前,AIs治疗矮身材的研究仅为小范围的研究,研究中应用AIs进行治疗的疾病有特发性矮小(idiopathic short stature,ISS)、生长激素缺乏症(growth hormone deficiency,GHD)、体质性青春发育期延迟(constitutional delay of growth and puberty,CDGP/constitutional delay of puberty,CDP)及PP,不同文献报道的AIs使身高获益的情况及安全性也不同(表2)。
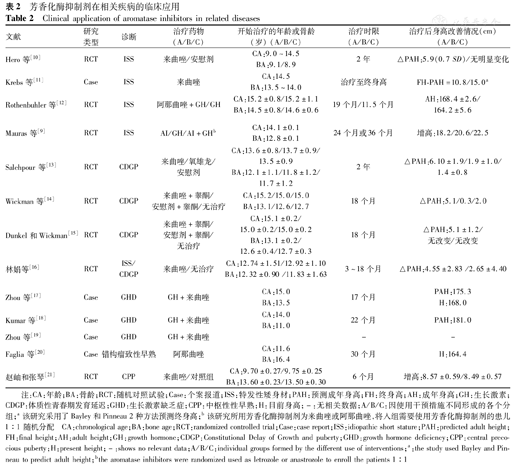
芳香化酶抑制剂在相关疾病的临床应用
Clinical application of aromatase inhibitors in related diseases
芳香化酶抑制剂在相关疾病的临床应用
Clinical application of aromatase inhibitors in related diseases
| 文献 | 研究类型 | 诊断 | 治疗药物(A/B/C) | 开始治疗的年龄或骨龄(岁) (A/B/C) | 治疗时限(A/B/C) | 治疗后身高改善情况(cm) (A/B/C) |
|---|---|---|---|---|---|---|
| Hero等[10] | RCT | ISS | 来曲唑/安慰剂 | CA:9.0~14.5 BA:9.1/8.9 | 2年 | △PAH:5.9(0.7SD)/无明显变化 |
| Krebs等[11] | Case | ISS | 来曲唑 | CA:14.5 BA:13.5~14.0 | 治疗至终身高 | FH-PAH=10.8/15.0a |
| Rothenbuhler等[12] | RCT | ISS | 阿那曲唑+GH/GH | CA:15.2±0.8/15.2±1.1 BA:14.5±0.8/14.6±0.6 | 19个月/11.5个月 | AH:168.4±2.6/164.2±5.6 |
| Mauras等[9] | RCT | ISS | AI/GH/AI+GHb | CA:14.1±0.1 BA:12.8±0.1 | 24个月或36个月 | 增高:18.2/20.6/22.5 |
| Salehpour等[13] | RCT | CDGP | 来曲唑/氧雄龙/安慰剂 | CA:13.6±0.8/13.7±0.9/13.5±0.9 BA:12.1±1.1/11.8±1.2/11.7±1.2 | 2年 | △PAH:6.10±1.9/1.9±1.0/1.4±0.8 |
| Wickman等[14] | RCT | CDGP | 来曲唑+睾酮/安慰剂+睾酮/无治疗 | CA:15.2/15.0/15.0 BA:13.1/12.6/12.7 | 18个月 | △PAH:5.1/0.3/2.0 |
| Dunkel和Wickman[15] | RCT | CDGP | 来曲唑+睾酮/安慰剂+睾酮/无治疗 | CA:15.1±0.2/15.0±0.2/15.0±0.2 BA:13.1±0.2/12.6±0.4/12.7±0.3 | 18个月 | △PAH:5.1±1.2/无改变/无改变 |
| 林娟等[16] | RCT | ISS/ CDGP | 来曲唑/无治疗 | CA:12.74±1.51/12.92±1.10 BA:12.32±0.90 /11.83±1.63 | 3~18个月 | △PAH:4.55±2.83 /2.65±4.40 |
| Zhou等[17] | Case | GHD | GH+来曲唑 | CA:15.0 BA:13.5 | 17个月 | PAH:175.3 H:168.0 |
| Kumar等[18] | Case | GHD | GH+来曲唑 | CA:14.0 BA:11.0 | 22个月 | PAH:181.0 |
| Zhou等[19] | Case | GHD | GH+来曲唑 | - | - | |
| Faglia等[20] | Case | 错构瘤致性早熟 | 阿那曲唑 | CA:11.6 BA:16.4 | 30个月 | H:164.4 |
| 赵岫和张琴[21] | RCT | CPP | 来曲唑/对照组 | CA:9.70±0.27/9.75±0.25 BA:13.60±0.23/13.50±0.30 | 6个月 | 增高:8.57±0.59/8.49±0.57 |
注:CA:年龄;BA:骨龄;RCT:随机对照试验;Case:个案报道;ISS:特发性矮身材;PAH:预测成年身高;FH:终身高;AH:成年身高;GH:生长激素;CDGP:体质性青春期发育延迟;GHD:生长激素缺乏症;CPP:中枢性性早熟;H:目前身高;-:无相关数据;A/B/C:因使用干预措施不同形成的各个分组;a该研究采用了Bayley和Pinneau 2种方法预测终身高;b该研究所用芳香化酶抑制剂为来曲唑或阿那曲唑,将入组需要使用芳香化酶抑制剂的患儿1∶1随机分配
CA:chronological age;BA:bone age;RCT:randomized controlled trial;Case:case report;ISS:idiopathic short stature;PAH:predicted adult height;FH:final height;AH:adult height;GH:growth hormone;CDGP:Constitutional Delay of Growth and puberty;GHD:growth hormone deficiency;CPP:central precocious puberty;H:present height;-:shows no relevant data;A/B/C:individual groups formed by the different use of interventions;a:the study used Bayley and Pinneau to predict adult height;bthe aromatase inhibitors were randomized used as letrozole or anastrozole to enroll the patients 1:1
综合目前研究来看,AIs能使身高获益的结论尚一致,即AIs能改善矮身材男童的PAH或终身高(表2)。在临床上,对于青春后期的矮身材患儿,现有治疗几乎不能使终身高获益,大部分患儿因失去rhGH或GnRHa治疗的最佳时机而放弃治疗,造成终身遗憾,然而就表2总结的研究来看,AIs能改善青春期已经启动、甚至青春后期这部分患儿的终身高,AIs或能成为错过rhGH或GnRHa最佳治疗时期的患儿的新希望。目前,对AIs治疗矮身材患儿的随机对照试验(RCT)大部分为ISS患儿,众所周知,ISS为一个排他性诊断,其实质为病因未明导致矮小疾病的总称,ISS患儿可能存在生长激素(GH)-胰岛素样生长因子(IGF1)轴信号通路异常,故推荐使用相比GHD或其他疾病更大剂量的rhGH[22],治疗起来相对更加棘手。总结针对ISS患儿的RCT试验结果来看,AIs与安慰剂或未应用药物干预相比更能增加ISS患儿的终身高[10,16],AIs联合使用rhGH较单独应用AIs或rhGH的身高获益大[9,12],但单独应用rhGH仍较单独应用AIs身高获益大[9]。总结关于CDGP的RCT研究来看,单独应用AIs较单独应用雄激素或不使用药物干预使预测终身高的获益大[13,14,15,16,17],在均应用雄激素进行治疗的同时加用AIs较加用安慰剂组预测终身高获益大[14,15],显示出AIs对改善CDGP患儿的身高有效。目前尚未见针对GHD患儿设计的AIs治疗的RCT研究,均为个案报道,结果也提示AIs对GHD患儿治疗存在正性作用。对大骨龄的CPP男童来讲,AIs应用的患儿较不给予处理的患儿相比,能有效延缓骨龄老化,改善PAH[21]。综合以上研究来看,对AIs能改善PAH的结论尚一致,但以上研究为期时间尚短,缺乏长期随访至终身高的数据,且PAH的评估或许存在误差,今后患儿持续生长仍存在不确定性,因此AIs对改善终身高的作用仍需进行大量及长期的研究。从人种因素来看,以上研究大部分为非黄种人,其得出的PAH或终身高改善的数据十分可喜,改善情况较好,而黄种人是否能得到同样的结论尚需要关于黄种人的大量RCT研究来进一步验证。
目前AIs应用于临床的数据尚少,对临床医师来说,除疗效外,其使用安全性也很重要。根据AIs的作用机制,性激素水平在体内肯定会随用药出现变化[9,10,23,24,25,26]。有文献报道,应用AIs治疗组患者的睾酮水平与对照组比较呈现成倍增高,而睾酮的增高带来了AIs组Tanner分期提前的情况[10];雌激素在用药期间能被抑制到青春期前水平,而促黄体生成素(LH)、卵泡刺激素(FSH)水平会随治疗的进程稳步上升;IGF-1与生长发育密切相关,有研究显示,IGF-1水平在试验组较之前无明显升高,而安慰剂对照组水平出现升高[23],在试验组加用GH治疗后IGF-1水平才会出现上升[9],追溯AIs及GH的作用机制,AIs可作用于雌激素进而延缓骨骺愈合,GH通过IGF-1作用促进身高增长,故两药联用是否能使身高获益最大化且安全有效成为今后值得研究的问题。
部分研究对AIs应用期间的骨代谢情况进行了监测,Hero等[10]指出,经来曲唑治疗后,腰椎及股骨颈的骨密度较之前增加,且未在为期2年的治疗中发现与骨密度改变相关的不良反应,也有其他文献[13,27]提到AIs可增加骨密度。但Krebs等[11]在其研究中得出了相反的结论,患儿在使用AIs治疗期间出现了暂时性骨密度下降,之后自发恢复。虽然就目前报道来看,大部分研究支持AIs对骨密度有正性作用,但也可能与样本少、不良反应生率低有关。另外,对于AIs对骨代谢是否有远期影响,有文献报道未发现脊柱畸形的后遗症[11,12]。Hero等[28]就来曲唑应用期间对脊柱形态、锥体终板及椎间盘的影响进行了系统随访,发现在青春期前或青春早期使用AIs易导致脊椎畸形,该损害可能表现为影响锥体成熟和生长延迟而不是影响骨质或导致压缩性骨折,因此,若患儿患有增加骨脆性的疾病或在服用增加骨脆性的药物,不应使用AIs进行治疗。
AIs的应用也会影响机体的代谢指标,总结现有文献看,来曲唑能轻微降低高密度脂蛋白水平[13,23,29],抵消青春期过程中出现的胰岛素抵抗[29],胰岛素水平降低导致胰岛素敏感性增加,但停药后会恢复至治疗前水平[23]。低密度脂蛋白及三酰甘油水平在治疗期间未出现变化[23,29],随着青春期的进展,来曲唑治疗组及安慰剂组均出现体质量及体质量指数(BMI)增加,这可能提示在青春早期和中期,性激素并不直接参与血清中低密度脂蛋白胆固醇或三酰甘油水平的调节[23]。关于糖代谢,来曲唑治疗组与安慰剂对照组在治疗期间空腹血糖、胰岛素及稳态模式评估(HOMA)指数与治疗前保持一致[29],提示来曲唑对糖代谢无不良效应。
有文献报道,雌激素具有调节语言记忆的功能,绝经后妇女若给予雌激素替代治疗能增加语言记忆能力[30,31],而AIs是否会影响患儿的认知功能,Hero等[32]就其进行了研究,结果显示,经来曲唑治疗2年,患者认知功能无明显改变,因此认为来曲唑对认知功能的发育无影响。但以上研究仅为治疗2年的数据,AIs对认知功能是否存在远期的影响,尚需要长期的随访评估。
AIs的应用有其优势存在,首先,AIs不会影响青春期的正常发育进程,虽有Tanner分期提前的情况,但患儿不会出现类似使用GnRHa治疗后青春期发育被抑制的情况,血清中各项激素指标除雌激素与睾酮因其作用机制出现变化以外,血清LH、FSH、IGF-1等均呈现较正常的发展趋势[15,19,20];其次,其给药方式较rhGH更加方便,来曲唑及阿那曲唑均为口服,而rhGH为皮下注射,部分患儿会对打针的操作产生抵触情绪从而导致药物使用不规律而影响最终效果;最后,AIs会大大减小患儿家庭的经济负担,rhGH的治疗费较高,因经济原因而放弃治疗,对患儿及家庭来说非常遗憾,而AIs的应用,能大大减少花费,在一定程度上改善PAH,甚至终身高。
综上,AIs能改善各类型矮身材患儿的PAH或终身高,为矮身材患儿改善终身高提供了新的治疗途径,尚未见严重不良事件及严重后遗症的报道。但目前临床研究的样本量尚少,缺乏长期随访资料,远期后遗症仍不明确,在临床应用中,医师应根据患儿病情、治疗意愿、依从性及家庭经济状况等情况综合考虑,并注意做到长期定时随访。在AIs普遍应用于临床治疗前仍需进行大样本、长时程的人群随机对照研究以明确其疗效、安全性及远期并发症等情况。
所有作者均声明不存在利益冲突



























