
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,28岁,左侧全髋关节置换术后9年余,左髋部疼痛3个月。患者自幼左下肢短缩、行走呈跛行,5岁时在当地医院行双髋X线检查,提示左侧髋臼发育不良伴髋关节脱位,未予重视。2008年12月20日患者因左髋部疼痛明显加重就诊于南京大学医学院附属金陵医院,双髋X线片示左侧髋关节发育不良伴高脱位(图1A),于2008年12月25日行左侧全髋关节置换术(图1B),术后左髋部功能恢复良好。3个月前,患者无明显诱因下出现左髋部疼痛不适伴活动受限,短时行走左髋部疼痛明显,于2018年4月18日再次住院。专科检查:脊柱无畸形,生理弯曲存在,棘突无压痛,叩击痛;左髋部可见长12 cm左右陈旧性手术瘢痕,无明显淤血瘀斑、无皮下出血;腹股沟处明显压痛;左下肢无明显畸形;右下肢肌力5级,左下肢4级,肌张力良好。髋关节活动度:右侧前屈90°、后伸30°、外展30°、内收15°、外旋30°、内旋30°,左侧前屈80°、后伸20°、外展10°、内收10°、外旋25°、内旋20°。远端肢体血运良好,膝反射、跟腱反射正常,Babinski征、Hoffmann征、Kernig征均阴性。辅助检查:双髋X线提示左侧全髋关节置换术后假体周围骨溶解,螺钉穿出髋臼杯(图1C);双髋CT提示左侧全髋关节置换术后,髋臼前柱及后柱缺损(图1D)。入院诊断:左侧全髋关节置换术后假体周围骨溶解。
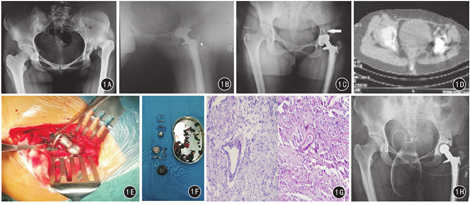

2018年4月25日在全身麻醉下行左侧全髋关节翻修术(LINK防脱位臼)。术中见:髋关节假体大量变性黑色电解组织,术后病理证实为炎性假瘤;髋臼端螺钉穿出臼杯,内衬碎裂、髋臼杯严重磨损;髋臼外上方可见螺钉固定植骨,臼底腔隙性缺损。术中常规取出髋臼假体及股骨金属头(股骨假体无松动未取出),发现髋臼后壁存在,前壁及底部大量骨缺损,无法形成假体压配,遂置入骨水泥防脱位臼。见图1E,图1F,图1G。患者术后第2天下地行走,左髋功能恢复良好,双下肢等长,无明显疼痛。术后X线提示:左侧全髋关节翻修术后,假体位置良好(图1H)。术后1个月门诊复查左髋关节功能良好,左髋Harris评分为89分,较术前(64分)明显提高。
假体周围骨溶解是全髋关节置换术后常见的并发症,主要由于磨损微粒诱发的局部慢性炎症反应引起巨噬细胞介导的破骨细胞活化、成骨细胞自噬和降解等反应,最终导致假体周围髋臼和股骨的溶解[1,2,3]。约20%的全髋关节置换术患者均有不同程度的骨溶解,而其中髋臼端骨溶解高达34%[4]。本例患者髋臼端出现严重骨溶解,并且导致了螺钉穿出髋臼。本例患者首次行右侧全髋关节置换术时为19岁,日常活动量较大,且患者体态肥胖(BMI为29.10 kg/m2),因此,关节活动造成的界面磨损远高于正常体态的患者。该患者首次置入假体其摩擦界面为金属和聚乙烯。据相关研究报道,直径在200~10 000 nm的磨损颗粒最容易导致巨噬细胞介导的溶骨性改变,而摩擦界面产生的金属和聚乙烯微粒大小也处于这一范围[5,6]。此外,患者首次术后双髋X线片显示患髋臼杯外展角<45°,翻修术中取出的臼杯证实臼杯内下部严重磨损,假体位置不佳也可能促成臼杯磨损。因此,笔者认为该患者的活动状态、BMI、假体界面以及假体位置可能是本例患者出现髋臼端严重骨溶解的原因。
对于全髋关节置换术后髋臼周围骨溶解的分型和治疗,赵建宁[7]曾提出金陵分型,即将髋臼侧分为Ⅰ~Ⅲ型,其中Ⅲ型患者髋臼假体内上、外上或外下均有骨溶解,髋臼前后壁不完整,治疗建议结构性植骨,使用防内陷Cage加深磨锉,同时使用高旋转中心技术等。本例患者属于Ⅲ型,首次手术因假体不稳而采用术中髋臼外上方结构性植骨,翻修手术时发现髋臼后壁存在,前壁及底部大量骨缺损,无法形成假体压配,遂置入骨水泥防脱位臼,而股骨端无明显松动,因此仅更换适配的金属头。
全髋关节置换术后髋臼周围骨溶解的风险因素,可分为患者因素、手术因素和假体因素三个方面。典型的骨溶解患者多年轻、活跃、BMI高,由于髋关节承受高压力负荷,可导致假体磨损,形成磨损微粒;而假体磨损微粒触发的破骨细胞介导的假体周围骨溶解,是无菌性假体松动的主要病理生理途径[8]。对于这类患者,建议适当减轻体质量,限制活动量,以减轻假体的磨损;同时也可酌情服用一些抑制骨吸收、促进骨形成的药物,比如阿伦膦酸钠、雷奈酸锶[9,10]。从手术的角度来看,合适的髋臼外展角可减轻假体的压力,限制假体的冲击和偏心磨损[11]。对于假体,应选择耐磨的摩擦界面,如陶对陶摩擦界面或陶对高交联聚乙烯摩擦界面[12]。同时要预防假体周围感染和假体周围骨折。本例患者10年前因陶瓷界面尚未普及,所以未能得到最佳的治疗方案。目前针对45岁以下年轻患者,推荐首选陶瓷头对陶瓷内衬界面可以明显减少界面磨损(本例因为股骨假体未更换,无法选择陶瓷头)。而对于全髋关节术后严重骨溶解的患者的治疗,金陵分型可提供一定的参考。
所有作者均声明不存在利益冲突


























