
胶原性肠炎是显微镜下胃肠道炎症性疾病的一种亚型,在我国较为罕见,临床多表现为慢性非血性水样泻伴或不伴吸收不良综合征,诊断主要依靠特征性组织学表现,其活检阳性率低,诊断困难。目前我国大陆布地奈德口服制剂尚未上市,胶原性肠炎的治疗以泼尼松/泼尼松龙为主。本文报道1例以水肿、低白蛋白血症起病,后以慢性腹泻为主要表现的患者,经反复内镜下多点活检发现胶原带沉积而确诊胶原性肠炎,口服布地奈德治疗。目前我国尚缺乏对胶原性肠炎的诊治经验,希望通过本例加强临床医生对该病的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,69岁,因"水肿3个月,腹泻、进行性消瘦2个月"于2019年8月30日入住北京协和医院消化内科。2019年6月患者开始出现双下肢对称性可凹性水肿,大便正常,查白蛋白18 g/L,尿蛋白阴性,肝肾功能、抗核抗体谱及肿瘤标志物均正常;超声心动图示少量心包积液,胃镜及结肠镜检查无异常;予输注白蛋白后水肿减轻。2019年7月患者开始出现腹泻,黄色稀水样便5~8次/d,味臭,总量2 500~3 000 ml/d,半个月内体重下降20 kg,之后1个月余体重缓慢下降约2 kg。查粪便常规+潜血阴性。胸腹部增强CT示胃窦部胃壁增厚;双侧胸腔积液、腹腔积液;横结肠近肝曲肠壁增厚,肠系膜多发肿大淋巴结;乙状结肠多发肠壁明显强化。胃镜检查未见异常,病理:(十二指肠)表面绒毛部分萎缩,部分腺体增生,固有膜见纤维蛋白样物沉积;(胃窦大弯)慢性炎。结肠镜:回肠末端黏膜萎缩;病理:(回肠末端)绒毛大部分消失,腺体增生,固有膜纤维蛋白沉积。后为进一步诊治收入病房。起病以来精神、食欲差,睡眠可,小便量少,大便及体重变化如上。既往史:类风湿关节炎10余年,曾口服非甾体类抗炎药(NSAID)治疗5~6年,具体用药种类未能提供;2018年停药,近2年无关节痛。个人、家族史无特殊。入院查体:体质指数(BMI)13.34 kg/m2,消瘦明显;心肺(-),舟状腹,全腹轻压痛,无反跳痛,肠鸣音2~3次/min;左手肘部畸形,双手、双足尺侧偏斜畸形。
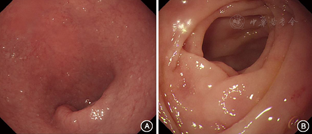
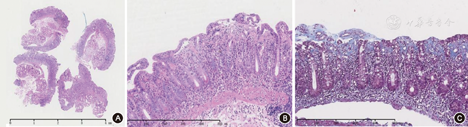
诊疗经过:入院查血常规:血红蛋白93 g/L,余(-);粪便常规+潜血、苏丹Ⅲ染色均(-);尿常规(-);白蛋白22 g/L,纤维蛋白原1.4 g/L,余肝肾功能(-);心肌酶谱、N末端B型利钠肽原、甲状腺功能(-);超敏C反应蛋白20.51 mg/L,红细胞沉降率2 mm/h。小肠吸收功能评估:总25羟基维生素D<3 μg/L,D木糖吸收试验0.2 g/5 h。感染筛查:血EB病毒DNA、巨细胞病毒DNA、粪便病原学、肥达外斐试验均(-)。免疫筛查:抗环瓜氨酸多肽抗体>3 200 KU/L,余(-)。肿瘤筛查:癌胚抗原7.2 μg/L,癌抗原125 37.8 KU/L,余(-)。乳糜泻抗体:抗麦胶蛋白抗体(AGA)IgG(+)2.28×105 RU/L,IgA弱阳性4.0×104 RU/L;抗肌内膜抗体(EMA)IgG、IgA,抗网硬蛋白抗体(ARA)IgG、IgA及抗组织谷氨酰胺转移酶抗体(anti-tTG)床旁初筛均阴性。胃镜:胃窦大弯侧几处糜烂灶,十二指肠黏膜平薄(图1)。结肠镜:局部灌肠后乙状结肠、直肠未见异常。肠道超声:胃窦、十二指肠球部肠壁增厚。腹盆增强CT+小肠重建:胃窦处胃壁增厚,第2、3、6组小肠部分节段,横结肠近段及乙状结肠部分节段肠壁增厚,肠腔变窄(经与放射科医生核实,考虑可能与肠壁水肿及充盈不佳有关,无特异性);腹膜后、肠系膜多发淋巴结。正电子发射计算机断层显像(PET-CT):部分肠道节段性代谢增高,首先考虑生理性摄取或炎性病变可能。舌体、齿龈组织活检及刚果红染色(-)。禁食水试验后便次减为4~6次/d(便量480~800 ml/d)。治疗方面,除外感染后予地衣芽孢杆菌活菌胶囊、双歧杆菌三联活菌散、小檗碱、蒙脱石散及营养支持治疗,腹泻无好转。我院活检病理最终回报:胃窦大弯及直肠黏膜病理无明显异常;(十二指肠降部、十二指肠球部)绒毛萎缩消失(图2A),表面上皮损伤部分脱落,表面上皮下见胶原沉积(图2B),未见明显上皮内淋巴细胞增多,Masson染色(+)(图2C),考虑为胶原性肠炎。


患者转归:患者出院后口服布地奈德(患者自行购买)治疗,9 mg/d,用药3 d后腹泻明显好转,大便成形,减至3次/d,10 d内体重增加2 kg,用药4周时大便已正常。患者继续用药9 mg/d满8周,后减量至6 mg/d口服2周,再减量至3 mg/d口服2周后停药。药物减量期间以及停药后1个月内大便正常,体重增加5 kg。停药1个月后大便次数再次增多,约10次/d,为成形便或稀糊便。由于新型冠状肺炎疫情原因,未于我院门诊就诊,于当地医院排除感染后再次口服布地奈德9 mg/d治疗。再次用药后大便次数于1周内逐渐正常,但药物减量至3 mg/d后病情反复,遂再次加量至9 mg/d,大便可再次逐渐恢复正常。截至2020年5月7日患者布地奈德加量至9 mg/d已2周,大便正常,偶有3~5次/d。患者尚未复查组织学。
患者腹泻突出,但消化道黏膜外观几乎正常,外院多次消化道黏膜活检未能明确诊断,诊断困难。
患者病初主要表现为水肿、低白蛋白血症,无胶原性肠炎典型的腹泻症状,更增加了该病早期确诊的难度。
对于不明原因的慢性腹泻,即便消化道黏膜外观几乎正常,也应重视黏膜活检。
对于慢性非血性水样泻的老年患者,应注意与显微镜下结肠炎鉴别。
患者老年女性,慢性病程,临床表现分两个阶段,病初表现为水肿和低白蛋白血症,第二阶段主要表现为慢性非血性水样泻。禁食水试验提示为混合性腹泻,存在部分渗透性因素,同时存在小肠吸收不良,病程中体重下降明显。患者低白蛋白血症明确,无摄入不足及肝脏合成功能障碍,无高热等消耗证据,尿蛋白阴性,结合腹泻表现,病变定位于胃肠道,考虑蛋白丢失性胃肠病可能性大。
蛋白丢失性胃肠病的病因可概括为糜烂性胃肠病、非糜烂性胃肠病和淋巴管阻塞性疾病。糜烂性胃肠病指胃肠道黏膜存在糜烂或溃疡,如炎症性肠病(IBD)、胃癌、淋巴瘤、特殊感染和NSAID相关胃病等,从而导致蛋白渗出。淋巴管阻塞性疾病则指原发或各种继发因素导致肠道淋巴管扩张、淋巴循环压力升高,蛋白随淋巴液从肠道漏出。该患者多次胃镜及结肠镜未见明确的黏膜糜烂或溃疡,未见淋巴管扩张样改变,且淋巴细胞不低,故可基本排除糜烂性胃肠病和淋巴管阻塞性疾病,而将诊断思路重点放在非糜烂性胃肠病上。
非糜烂性胃肠病的病因包括乳糜泻、淀粉样变、显微镜结肠炎(MC)、风湿性疾病(如系统性红斑狼疮、类风湿关节炎等)、感染性疾病(如Whipple病、小肠细菌过度生长等)等。具体鉴别诊断如下:(1)乳糜泻:该患者腹泻突出、存在明确的小肠吸收不良,十二指肠及回肠末端黏膜萎缩、表面绒毛大部分消失,血清学提示AGA IgG(+)2.28×105 RU/L、IgA弱阳性4.0×104 RU/L,EMA、ARA、anti-tTG均阴性,以上特点提示乳糜泻可能。但患者腹泻与进食种类无关,且在乳糜泻的诊断中,IgA EMA、IgA tTG的诊断准确度最高,而IgA AGA和IgG AGA的准确度较低,常假阳性[1]。故考虑诊断证据不足,予试验性去麦胶饮食的同时继续寻找病因。(2)淀粉样变:患者血尿免疫固定电泳和轻链筛查无明显异常,可除外浆细胞病相关的免疫球蛋白轻链(AL)型淀粉样变。因患者有类风湿关节炎病史,炎症指标升高,需警惕有无慢性活动或反复发作性炎症致血清淀粉样蛋白A沉积相关的AA型淀粉样变[2]。但患者无心、肾、神经系统等其他部位受累证据,类风湿关节炎DAS28评分仅为轻度活动,最终舌体、齿龈及胃肠道组织活检和刚果红染色无阳性证据。(3)胃肠道淋巴瘤:患者消瘦明显,呈恶病质表现,需警惕淋巴瘤。但其乳酸脱氢酶不高,免疫固定电泳无明显异常,淋巴结超声、腹盆CT及PET-CT均阴性,无淋巴瘤客观证据,必要时需重复胃镜及结肠镜取活检。(4)显微镜结肠炎:患者老年女性,慢性非血性水样泻,消化内镜下黏膜外观几乎正常,需与MC鉴别。最终重复胃肠道活检,十二指肠病理回报上皮下见胶原沉积,Masson染色阳性,因病变累及十二指肠,故最终诊断胶原性肠炎。胶原性肠炎可同时累及结肠、小肠、十二指肠,故亦可解释其小肠吸收不良相关症状。
MC是一种慢性复发性肠道炎症性疾病,包括淋巴细胞性结肠炎(LC)和胶原性结肠炎(CC)两种临床亚型,其共同的临床表现为慢性非血性水样泻,而肠道黏膜的内镜下表现几乎正常,但该特点并非疾病特异,最终诊断主要依据组织活检。基于欧洲和北美人群的调查研究显示,CC和LC的年发病率分别为1.1~14.9/10万、1.3~12.0/10万,且近年呈增加趋势,其发病率甚至不亚于IBD[3],所以在一些西方国家,MC被认为是老年人慢性腹泻的较常见原因之一。据报道,除CC外,以上皮下胶原沉积为特点的显微镜下炎症还可累及胃、十二指肠及小肠,其中胶原性胃炎和十二指肠炎均较为罕见,且常同时合并结肠受累,而单纯胃或十二指肠受累者则极其罕见[4,5]。该患者虽无小肠和结肠黏膜下胶原沉积的病理学证据,但综合其明显的小肠吸收不良、慢性非血性水样泻的临床表现及外院结肠病理的提示(回肠末端绒毛大部分消失,固有膜纤维蛋白沉积),考虑其病变累及十二指肠、小肠和结肠的可能性极大,故最终诊断为胶原性肠炎。
消化道黏膜组织活检病理对于胶原性肠炎的确诊至关重要。胶原性肠炎的主要病理学特征为连续的上皮下胶原带异常增厚超过10 μm[6]。国外经验认为,各节段肠道病变受累的严重程度并不均一,通常右半结肠较左半结肠严重,故一般活检取材的阳性率在右半结肠较高[7]。为提高活检阳性率,国外普遍推荐的活检方式为升结肠、横结肠、降结肠及乙状结肠至少各活检2块。对于存在小肠吸收不良的患者,小肠特别是空肠和十二指肠的活检对提高阳性率可能有一定的帮助。在临床工作中,病理科医生对该病的认识程度在其诊断中起着至关重要的作用。回顾外院十二指肠和回肠末端的活检病理报告,或许其中所描述的固有膜纤维蛋白样物沉积存在一定意义,但遗憾的是当时并未进一步行Masson染色来明确。
MC的病因及发病机制尚未完全阐明,目前推测可能与遗传易感的机体对肠腔内抗原(如药物、感染等)异常反应,导致免疫调节紊乱或自身免疫有关。因此,MC的病因大致包括遗传因素、感染、药物、自身免疫等几个方面[3]。关于MC家族性发病的研究发现,该病可能与人类白细胞抗原(HLA)、肿瘤坏死因子(TNF)等基因多态性有关,本例患者否认有相关家族史[7]。该患者有类风湿关节炎病史,存在一定的自身免疫背景,同时长期服用NSAID类药物,故考虑该患者的发病可能与自身免疫及药物因素均有一定相关性。
一些西方国家已相继出台针对MC诊治的专家共识或临床指南[6,7,8],但截至目前我国尚缺乏该病的诊治经验。北京协和医院曾报道2例接受泼尼松治疗的MC患者(LC与CC各1例),其中1例因激素减量过程中病情反复且合并了机会性感染,最后加用了硫唑嘌呤治疗[9]。对于水样泻严重、对症止泻效果不佳的患者,美国等西方国家的指南或专家共识中均推荐布地奈德作为一线治疗方案。但国外指南中同时指出,布地奈德治疗也存在停药后复发及激素依赖的问题[8]。一项纳入80例接受糖皮质激素治疗(泼尼松组17例、布地奈德组63例)的MC患者(LC与CC各40例)的回顾性研究显示,布地奈德组完全缓解率明显高于泼尼松组,而布地奈德组复发的可能性小于泼尼松组[10]。该病例中患者口服布地奈德后病情明显好转,但停药后病情反复,再次应用布地奈德治疗后减量困难,考虑可能出现激素依赖,已建议患者近期复查评估病情,将继续随诊后续治疗情况。另外,患者口服布地奈德约半年时间,未出现机会性感染。
本例胶原性肠炎的诊治过程提示,对于内镜下黏膜外观几乎正常的老年人慢性非血性水样泻,MC是需重点鉴别的疾病之一,确诊需多节段多点黏膜活检,合并小肠吸收不良者应加做小肠特别是空肠和十二指肠的活检,病理科医生对该病的认知程度至关重要,布地奈德可有效缓解病情,但可能存在停药后复发及激素依赖的问题。
所有作者均声明不存在利益冲突



























